一定温度下,在恒容密闭容器中充入乙烯和环丙烷,发生反应:

下列叙述错误的是

下列叙述错误的是
| A.其他条件不变,增大乙烯浓度,能提高正反应速率 |
| B.当压强不变时,反应达到平衡状态 |
C.其他条件不变,增大光照强度, 会增大 会增大 |
| D.平衡后加入催化剂,平衡不移动 |
更新时间:2024-02-08 14:40:27
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】根据下列实验操作,预测的实验现象和实验结论或解释均正确的是
| 实验操作 | 预测实验现象 | 实验结论或解释 | |
| A | 相同温度下,同时向①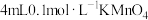 酸性溶液和② 酸性溶液和②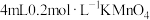 酸性溶液中分别加入 酸性溶液中分别加入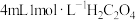 溶液 溶液 | ②中溶液先褪色 | 该实验条件下, 浓度越大,反应速率越快 浓度越大,反应速率越快 |
| B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| C | 白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴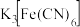 溶液 溶液 | 无明显现象 | 该过程未发生原电池反应 |
| D | 分别测定室温下等物质的量浓度的 与 与 溶液的pH 溶液的pH | 后者较大 | 证明非金属性:S>C |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
【推荐2】煤的液化可以合成甲醇.下列有关说法正确的是
①“气化”:
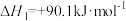 ;
;
②催化液化I:
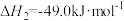 ;
;
③催化液化II:
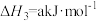 ;
;
①“气化”:

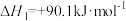 ;
;②催化液化I:

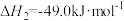 ;
;③催化液化II:

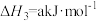 ;
;A.催化液化I中使用催化剂,反应的活化能 、 、 都减小 都减小 |
B.反应  |
| C.升高温度,①速率增大:②速率减小 |
D. 为电解质溶液的甲醇燃料电池中正极的电极反应为: 为电解质溶液的甲醇燃料电池中正极的电极反应为: |
您最近一年使用:0次
【推荐3】已知完全分解1molH2O2放出热量为98kJ,在含有少量I-的溶液中H2O2分解的机理为反应I:H2O2(aq)+I-(aq) IO-(aq)+H2O(l) △H1;反应II:H2O2(aq)+IO-(aq)
IO-(aq)+H2O(l) △H1;反应II:H2O2(aq)+IO-(aq) O2(g)+I-(aq)+H2O(l) △H2。在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是
O2(g)+I-(aq)+H2O(l) △H2。在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是

 IO-(aq)+H2O(l) △H1;反应II:H2O2(aq)+IO-(aq)
IO-(aq)+H2O(l) △H1;反应II:H2O2(aq)+IO-(aq) O2(g)+I-(aq)+H2O(l) △H2。在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是
O2(g)+I-(aq)+H2O(l) △H2。在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是
| A.反应I是焓减小的反应 |
| B.H2O2分解产生氧气的决速步是反应I |
| C.I-、IO-都是催化剂 |
| D.△H1+△H2=-196kJ•mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知在一定条件下,反应X(g)+3Y(g) 2Z(g) ΔH=-akJ·mol-1(a>0),某实验小组测得X的转化率(α)在不同温度与压强(p)下的实验数据,三者之间关系如图所示。下列说法正确的是( )
2Z(g) ΔH=-akJ·mol-1(a>0),某实验小组测得X的转化率(α)在不同温度与压强(p)下的实验数据,三者之间关系如图所示。下列说法正确的是( )

 2Z(g) ΔH=-akJ·mol-1(a>0),某实验小组测得X的转化率(α)在不同温度与压强(p)下的实验数据,三者之间关系如图所示。下列说法正确的是( )
2Z(g) ΔH=-akJ·mol-1(a>0),某实验小组测得X的转化率(α)在不同温度与压强(p)下的实验数据,三者之间关系如图所示。下列说法正确的是( )
| A.图中A、B两点对应的平衡常数相等 |
| B.上述反应在达到平衡后,缩小体积,Y的转化率提高 |
| C.升高温度,正、逆反应速率增大,平衡向正反应方向移动 |
| D.将2.0molX、6.0molY置于密闭容器中发生反应,放出的热量为2akJ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】在一定温度下,将气体X和气体Y各0.4mol充入4L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
| t/min | 2 | 4 | 10 | 15 |
| n(Y)/mol | 0.32 | 0.28 | 0.20 | 0.20 |
| A.反应前4min平均速率v(X)=7.510-3mol·L-1·min-1 |
| B.该温度下此反应的平衡常数:K=20 |
| C.其他条件不变,降低温度,反应达到新平衡前:v(逆)<v(正) |
| D.保持其他条件不变,起始时向容器中充入0.8mol气体X和0.8mol气体Y,到达平衡时,Y的转化率为50% |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法不正确的是
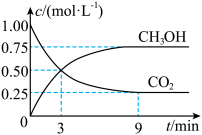

| A.从3min到9min,v(H2)为0.125mol·L-1·min-1 |
| B.若混合气体密度不变时,该反应达平衡状态 |
| C.平衡时向容器中充入Ne,反应速率不变 |
| D.9min时,反应处于平衡状态 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】一定温度下,在恒容密闭容器中充入 和
和 ,同时发生两个反应:
,同时发生两个反应:
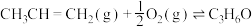 (g,甲基环氧乙烷)、
(g,甲基环氧乙烷)、 (g,丙醛)
(g,丙醛)
下列不能表明反应已达到平衡状态的是
 和
和 ,同时发生两个反应:
,同时发生两个反应: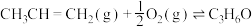 (g,甲基环氧乙烷)、
(g,甲基环氧乙烷)、 (g,丙醛)
(g,丙醛)下列不能表明反应已达到平衡状态的是
| A.混合气体的密度不随时间变化 |
| B.混合气体的总压强不随时间变化 |
| C.混合气体的平均摩尔质量不随时间变化 |
D.消耗丙烯的速率等于生成 速率的2倍 速率的2倍 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅 HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅 |
B.对2HI(g)  H2(g)+I2(g)的平衡,保持其他条件不变,压缩体积可使平衡体系颜色变深 H2(g)+I2(g)的平衡,保持其他条件不变,压缩体积可使平衡体系颜色变深 |
| C.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施 |
| D.用饱和食盐水除去氯气中的氯化氢 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列有关实验现象的原因分析错误的是
| 实验操作及现象 | 原因 | |
| A | 向深蓝色的 溶液中加入乙醇,析出深蓝色晶体 溶液中加入乙醇,析出深蓝色晶体 | 乙醇与配离子反应生成了难溶于水的晶体 |
| B | 向碘的四氯化碳溶液中加入浓的KI溶液,溶液紫色变浅 | 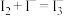 |
| C | 将注射器中的 气体加压,气体颜色先变深,随后变浅 气体加压,气体颜色先变深,随后变浅 | 加压时 浓度增大,平衡 浓度增大,平衡 正向移动 正向移动 |
| D | 酸性高锰酸钾溶液和草酸反应时,开始褪色较慢随后褪色加快 | 反应产生的 对该反应有催化作用 对该反应有催化作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次


 。将
。将 、
、
 、
、 的关系:
的关系:



