名校
1 . 过硫酸钠(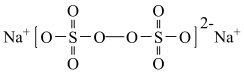 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
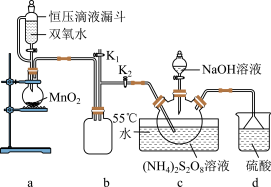
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。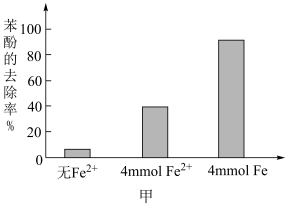
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为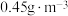 ,
,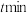 达到最大去除率,NO去除的平均反应速率:
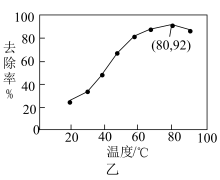
达到最大去除率,NO去除的平均反应速率: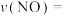
 。
。
您最近一年使用:0次
解题方法
2 . 以CO、 为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.

回答下列问题:
(1)已知某反应的平衡常数表达式为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为__________ 。
(2)向一容积为2L的恒容密闭容器中通入1mol 和3mol
和3mol ,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得
,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时总压为________ Pa。
②0~20min内,用 表示的平均反应速率
表示的平均反应速率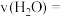
________  ,
, 的平衡浓度
的平衡浓度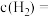
________ 
(3)在一定条件下发生反应Ⅰ、Ⅲ( 过量),若反应Ⅰ中
过量),若反应Ⅰ中 的转化率为90%,Ⅲ中
的转化率为90%,Ⅲ中 的转化率为40%,则
的转化率为40%,则 的产率为
的产率为________ .
(4)工业上,以一定比例混合的 与
与 的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ.
的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ. 转化率与温度的关系如图1所示.在催化剂b作用下,温度高于
转化率与温度的关系如图1所示.在催化剂b作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是__________ 。 分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中
分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中 的体积分数(
的体积分数(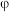 )如图2所示。
)如图2所示。 、
、 和
和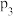 由大到小的顺序是
由大到小的顺序是________ 。
②若在250℃、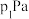 的条件下,反应达到平衡,则该反应的平衡常数
的条件下,反应达到平衡,则该反应的平衡常数
________ 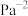 (分压
(分压 总压
总压 物质的量分数)。
物质的量分数)。
 为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:Ⅰ.


Ⅱ.


Ⅲ.


Ⅳ.


回答下列问题:
(1)已知某反应的平衡常数表达式为
 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)向一容积为2L的恒容密闭容器中通入1mol
 和3mol
和3mol ,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得
,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时总压为
②0~20min内,用
 表示的平均反应速率
表示的平均反应速率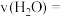
 ,
, 的平衡浓度
的平衡浓度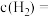

(3)在一定条件下发生反应Ⅰ、Ⅲ(
 过量),若反应Ⅰ中
过量),若反应Ⅰ中 的转化率为90%,Ⅲ中
的转化率为90%,Ⅲ中 的转化率为40%,则
的转化率为40%,则 的产率为
的产率为(4)工业上,以一定比例混合的
 与
与 的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ.
的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ. 转化率与温度的关系如图1所示.在催化剂b作用下,温度高于
转化率与温度的关系如图1所示.在催化剂b作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是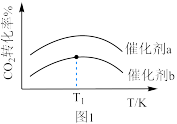
 分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中
分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中 的体积分数(
的体积分数(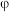 )如图2所示。
)如图2所示。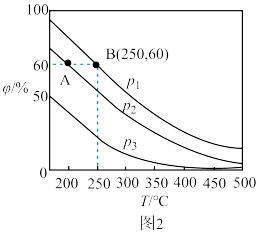
 、
、 和
和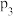 由大到小的顺序是
由大到小的顺序是②若在250℃、
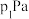 的条件下,反应达到平衡,则该反应的平衡常数
的条件下,反应达到平衡,则该反应的平衡常数
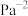 (分压
(分压 总压
总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2024-05-21更新
|
68次组卷
|
2卷引用:河南省九师联盟2023-2024学年高三下学期5月月考理综试题-高中化学
名校
解题方法
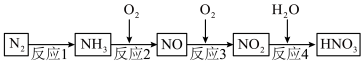
3 . 氮及其化合物在生产、生活中有重要应用价值。工业上用氮气制取硝酸的流程如图所示:
(1)反应1为合成氨反应。
①该反应在298K时:△H=-92.2kJmol-1,△S=-198.2J·K-1·mol-1,该反应在298K时_______ (填“能”或“不能”)正向自发进行。
②在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为 △H<0.则铜氨液吸收CO适宜的生产条件有
△H<0.则铜氨液吸收CO适宜的生产条件有_______ (填序号)。
a.适当降低温度 b.适当减小压强
c.减小[Cu(NH3)2]+浓度 d.增大NH3浓度
吸收生成的[Cu(NH3)3CO]+中配体为_______ (写化学式)。
(2)反应2为氨的催化氧化,该过程中生成的NO还会与NH3发生副反应生成N2,副反应的反应方程式为_______ 。
(3)取氨催化氧化后得到的气体,其起始成分为2.8molNO、1.2molN2、1.45molO2,恒容条件下继续发生反应3: ,生成的NO2会发生二聚:
,生成的NO2会发生二聚: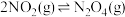 ,达到平衡时气体的总压强为0.5MPa,体系中N2O4、O2均为0.1mol,则反应3的平衡常数Kp=
,达到平衡时气体的总压强为0.5MPa,体系中N2O4、O2均为0.1mol,则反应3的平衡常数Kp=_______ MPa-1。
(4)N2O5是硝酸的酸酐,一定温度下,在N2O5的四氯化碳溶液中发生分解反应: 。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:
。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:
在600~1200s内,用NO2浓度变化表示该反应的平均速率为_______ 。
(5)利用数字化色度传感器探究压强对化学平衡的影响。色度传感器能感受被分辨物体的色度,并转换成可输出信号由计算机自动记录透射率的变化,颜色越深,透射率越小。在注射器中收集一定量的NO2,存在反应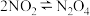 ,利用色度传感器记录注射器活塞移动时混合气体的透射率变化,结果如图所示。
,利用色度传感器记录注射器活塞移动时混合气体的透射率变化,结果如图所示。_______ (填“压缩”或“扩大”)注射器内气体的体积,F→G段化学平衡_______ (填“正”或“逆”)向移动。
②N2O4分子为平面结构,存在一个大π键,可表示为_______ (分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为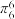 )。
)。
(1)反应1为合成氨反应。
①该反应在298K时:△H=-92.2kJmol-1,△S=-198.2J·K-1·mol-1,该反应在298K时
②在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为
 △H<0.则铜氨液吸收CO适宜的生产条件有
△H<0.则铜氨液吸收CO适宜的生产条件有a.适当降低温度 b.适当减小压强
c.减小[Cu(NH3)2]+浓度 d.增大NH3浓度
吸收生成的[Cu(NH3)3CO]+中配体为
(2)反应2为氨的催化氧化,该过程中生成的NO还会与NH3发生副反应生成N2,副反应的反应方程式为
(3)取氨催化氧化后得到的气体,其起始成分为2.8molNO、1.2molN2、1.45molO2,恒容条件下继续发生反应3:
 ,生成的NO2会发生二聚:
,生成的NO2会发生二聚: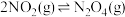 ,达到平衡时气体的总压强为0.5MPa,体系中N2O4、O2均为0.1mol,则反应3的平衡常数Kp=
,达到平衡时气体的总压强为0.5MPa,体系中N2O4、O2均为0.1mol,则反应3的平衡常数Kp=(4)N2O5是硝酸的酸酐,一定温度下,在N2O5的四氯化碳溶液中发生分解反应:
 。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:
。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:| t/s | 0 | 600 | 1200 | 1710 | 2220 | 2820 | ······ |
| c(N2O5)/(mol·L-1) | 1.40 | 0.96 | 0.66 | 0.48 | 0.35 | 0.24 | ······ |
(5)利用数字化色度传感器探究压强对化学平衡的影响。色度传感器能感受被分辨物体的色度,并转换成可输出信号由计算机自动记录透射率的变化,颜色越深,透射率越小。在注射器中收集一定量的NO2,存在反应
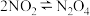 ,利用色度传感器记录注射器活塞移动时混合气体的透射率变化,结果如图所示。
,利用色度传感器记录注射器活塞移动时混合气体的透射率变化,结果如图所示。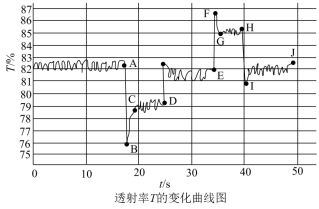
②N2O4分子为平面结构,存在一个大π键,可表示为
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为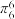 )。
)。
您最近一年使用:0次
2024-05-12更新
|
71次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
4 . 碳单质及其化合物广泛存在于人们的生产和生活中。研究碳单质及其化合物的结构、性质、转化是科技工作者的研究热点。
(1)实验室常用邻二氮菲检验亚铁离子,生成橙红色的邻二氮菲亚铁络离子X: 的最外层电子排布式是
的最外层电子排布式是________________ 。
②X中除含共价键外,还含配位键, X含
X含________ mol配位键。
(2)温度为T时,在恒容密闭容器中充入一定量的 和
和 混合气体,发生反应:
混合气体,发生反应:

 。
。
已知该反应存在: ,
,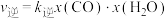 ,其中
,其中 、
、 为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若
为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若 、
、 转化率均为60%,且该反应的
转化率均为60%,且该反应的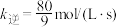 ,则
,则
________ 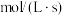 ,压强平衡常数
,压强平衡常数
________ 。
(3)氧化锰八面体分子筛(简称OMS-2)是一种纳米级别的新型环保催化剂,对挥发性有机物(VOCs)的氧化去除有着很好的催化作用。如用OMS-2为催化剂(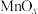 为对比催化实验)氧化处理甲醛的反应生成
为对比催化实验)氧化处理甲醛的反应生成 、
、 ,在等时间内HCHO转化率随温度的变化关系如图所示。
,在等时间内HCHO转化率随温度的变化关系如图所示。 、
、 反应的化学方程式是
反应的化学方程式是________________________ 。
②下列有关说法中,正确的有________ 。
A.相比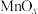 ,OMS-2能提高甲醛氧化的平衡转化率
,OMS-2能提高甲醛氧化的平衡转化率
B.OMS-2能降低甲醛氧化反应的活化能
C.OMS-2作为纳米材料,表面积大,催化效果好
D.两种催化剂的平衡转化率均随温度的升高而增大
(4)以合成气( 、
、 )为原料合成乙二醇的反应:
)为原料合成乙二醇的反应:
反应ⅰ.
反应ⅱ.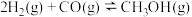
温度为473K,在恒容(2.0L)密闭容器中充入一定量的合成气(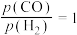 ,测得体系总压为40MPa),在
,测得体系总压为40MPa),在 (其中含
(其中含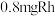 )催化剂作用下,进行上述反应。测得
)催化剂作用下,进行上述反应。测得 的时空收率为
的时空收率为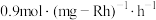 ,反应速率
,反应速率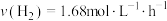 。
。
【注】(催化剂)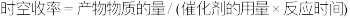 。
。
①反应速率
________  。
。
②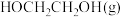 的时空收率为
的时空收率为________ 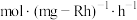 。
。
(1)实验室常用邻二氮菲检验亚铁离子,生成橙红色的邻二氮菲亚铁络离子X:

 的最外层电子排布式是
的最外层电子排布式是②X中除含共价键外,还含配位键,
 X含
X含(2)温度为T时,在恒容密闭容器中充入一定量的
 和
和 混合气体,发生反应:
混合气体,发生反应:
 。
。已知该反应存在:
 ,
,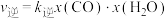 ,其中
,其中 、
、 为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若
为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若 、
、 转化率均为60%,且该反应的
转化率均为60%,且该反应的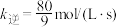 ,则
,则
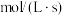 ,压强平衡常数
,压强平衡常数
(3)氧化锰八面体分子筛(简称OMS-2)是一种纳米级别的新型环保催化剂,对挥发性有机物(VOCs)的氧化去除有着很好的催化作用。如用OMS-2为催化剂(
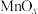 为对比催化实验)氧化处理甲醛的反应生成
为对比催化实验)氧化处理甲醛的反应生成 、
、 ,在等时间内HCHO转化率随温度的变化关系如图所示。
,在等时间内HCHO转化率随温度的变化关系如图所示。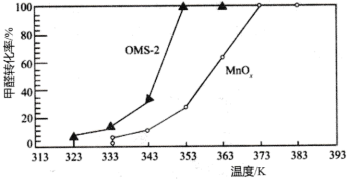
 、
、 反应的化学方程式是
反应的化学方程式是②下列有关说法中,正确的有
A.相比
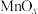 ,OMS-2能提高甲醛氧化的平衡转化率
,OMS-2能提高甲醛氧化的平衡转化率B.OMS-2能降低甲醛氧化反应的活化能
C.OMS-2作为纳米材料,表面积大,催化效果好
D.两种催化剂的平衡转化率均随温度的升高而增大
(4)以合成气(
 、
、 )为原料合成乙二醇的反应:
)为原料合成乙二醇的反应:反应ⅰ.

反应ⅱ.
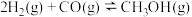
温度为473K,在恒容(2.0L)密闭容器中充入一定量的合成气(
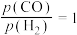 ,测得体系总压为40MPa),在
,测得体系总压为40MPa),在 (其中含
(其中含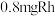 )催化剂作用下,进行上述反应。测得
)催化剂作用下,进行上述反应。测得 的时空收率为
的时空收率为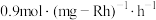 ,反应速率
,反应速率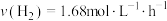 。
。【注】(催化剂)
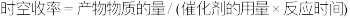 。
。①反应速率

 。
。②
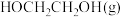 的时空收率为
的时空收率为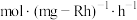 。
。
您最近一年使用:0次
解题方法
5 . NH3(含6个H-N)是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
注:拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能
可逆反应N2(g)+3H2(g) 2NH(g) ∆H=
2NH(g) ∆H=___________ kJ•mol-1。
(2)在一定条件下,体积固定的体系中,建立如图所示的N2+3H2 2NH3平衡体系。
2NH3平衡体系。___________ (填“曲线A”、“曲线B”或“曲线C”)。
②0~tomin时,用H2表示化学反应速率是___________ mol•L•min-1。
③下列能说明该反应达到平衡的是___________ 。
A.混合气体的压强不再变化 B.c(H2)=c(NH3)
C.混合气体的质量不再变化 D.NH3的体积分数不再变化
(3)潜艇的液氨-液氧燃料电池示意图如图所示:___________ ,其中电极b是该电池的___________ 。
②电解质溶液中OH-离子向___________ 移动(填“电极a”或“电极b”)。
(4)火箭燃料N2H4具有强还原性,可用氨水与NaClO溶液反应制取,反应装置如图所示,其中分液漏斗中溶液是___________ 。
(1)已知:
| 共价键 | H-H | N≡N | N-H |
| 键能/kJ•mol-1 | 436 | 946 | 391 |
可逆反应N2(g)+3H2(g)
 2NH(g) ∆H=
2NH(g) ∆H=(2)在一定条件下,体积固定的体系中,建立如图所示的N2+3H2
 2NH3平衡体系。
2NH3平衡体系。
②0~tomin时,用H2表示化学反应速率是
③下列能说明该反应达到平衡的是
A.混合气体的压强不再变化 B.c(H2)=c(NH3)
C.混合气体的质量不再变化 D.NH3的体积分数不再变化
(3)潜艇的液氨-液氧燃料电池示意图如图所示:

②电解质溶液中OH-离子向
(4)火箭燃料N2H4具有强还原性,可用氨水与NaClO溶液反应制取,反应装置如图所示,其中分液漏斗中溶液是
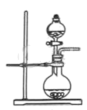
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题
(1)理论研究表明,在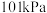 和
和 下,
下, 异构化反应的能量变化如图。
异构化反应的能量变化如图。
_______ 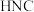 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②该异构化反应的
______________  。
。
(2)“长征2F”运载火箭使用 和
和 (偏二甲册)作推进剂。
(偏二甲册)作推进剂。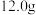 液态
液态 在液态
在液态 中燃烧生成
中燃烧生成 、
、 、
、 三种气体,放出
三种气体,放出 热量,该反应的热化学方程式为
热量,该反应的热化学方程式为_______________ 。
(3)工业燃烧煤、石油等化石燃料释放出大量氮氧化物( )、
)、 、
、 等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:催化剂存在下, 还原
还原 生成水蒸气和其他无毒物质的化学方程式为
生成水蒸气和其他无毒物质的化学方程式为_______________ 。
Ⅱ.脱碳:向2L密闭容器中加入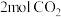 、
、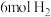 ,在恒温恒容的条件下发生反应
,在恒温恒容的条件下发生反应
 。
。
(4)下列叙述中,能说明此反应达到平衡状态的是_____________(填字母)。
(5)该反应过程中的部分数据见下表:
前10min内的平均反应速率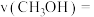
________  ;平衡时
;平衡时 的转化率为
的转化率为__________ 。
(6)汽车中的电瓶使用的就是铅酸电池,工作时电池总反应为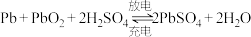 ,下列说法正确的是_________。
,下列说法正确的是_________。
(7)甲醇( )—空气燃料电池是一种高效能、轻污染的车载电池,以
)—空气燃料电池是一种高效能、轻污染的车载电池,以 为电解质溶液,负极发生的电极反应式为
为电解质溶液,负极发生的电极反应式为___________ 。
(1)理论研究表明,在
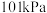 和
和 下,
下, 异构化反应的能量变化如图。
异构化反应的能量变化如图。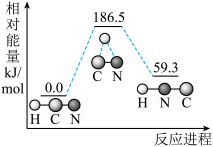

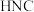 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②该异构化反应的

 。
。(2)“长征2F”运载火箭使用
 和
和 (偏二甲册)作推进剂。
(偏二甲册)作推进剂。 液态
液态 在液态
在液态 中燃烧生成
中燃烧生成 、
、 、
、 三种气体,放出
三种气体,放出 热量,该反应的热化学方程式为
热量,该反应的热化学方程式为(3)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(
 )、
)、 、
、 等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。I.脱硝:催化剂存在下,
 还原
还原 生成水蒸气和其他无毒物质的化学方程式为
生成水蒸气和其他无毒物质的化学方程式为Ⅱ.脱碳:向2L密闭容器中加入
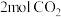 、
、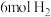 ,在恒温恒容的条件下发生反应
,在恒温恒容的条件下发生反应
 。
。(4)下列叙述中,能说明此反应达到平衡状态的是_____________(填字母)。
A.单位时间内生成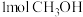 的同时生成 的同时生成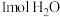 |
B.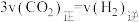 |
C. 和 和 的浓度保持不变 的浓度保持不变 |
| D.混合气体的密度保持不变 |
(5)该反应过程中的部分数据见下表:
反应时间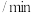 |  | 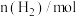 | 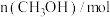 | 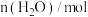 |
| 0 | 2 | 6 | 0 | 0 |
| 10 | 4.5 | |||
| 20 | 1 | |||
| 30 | 1 |
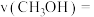
 ;平衡时
;平衡时 的转化率为
的转化率为(6)汽车中的电瓶使用的就是铅酸电池,工作时电池总反应为
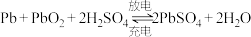 ,下列说法正确的是_________。
,下列说法正确的是_________。A.放电时,负极的电极反应式为:P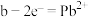 |
B.放电时,正极附近溶液 增大 增大 |
C.放电时,理论上每生成 硫酸铅,外电路中转移的电子为 硫酸铅,外电路中转移的电子为 |
| D.充电过程是原电池的工作原理 |
(7)甲醇(
 )—空气燃料电池是一种高效能、轻污染的车载电池,以
)—空气燃料电池是一种高效能、轻污染的车载电池,以 为电解质溶液,负极发生的电极反应式为
为电解质溶液,负极发生的电极反应式为
您最近一年使用:0次
解题方法
7 . 船舶柴油机发动机工作时,反应产生的 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。
已知: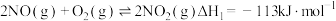 ;
; ;
;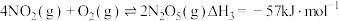
(1) 氧化脱除
氧化脱除 的总反应是
的总反应是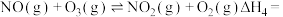
_______ 。
(2)该反应过程有两步: ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数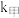
_______  (填“
(填“ ”、“
”、“ ”或“
”或“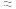 ”),原因是
”),原因是 _______ 。 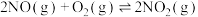 的反应历程分两步:
的反应历程分两步:
①则反应Ⅰ与反应Ⅱ的活化能:
_______ 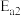 (填“
(填“ ”“
”“ ”或“
”或“ ”)。反应
”)。反应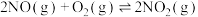 的平衡常数
的平衡常数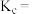
_______ (用 、
、 、
、 、
、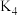 表示)。
表示)。
②在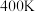 、初始压强为
、初始压强为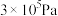 的恒温刚性容器(体积为VL)中,按
的恒温刚性容器(体积为VL)中,按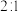 通入
通入 和
和 一定条件下发生反应。达平衡时
一定条件下发生反应。达平衡时 转化率为
转化率为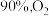 转化率为
转化率为
____________ 。
(4)某研究小组将 、
、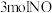 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应
催化剂表面发生反应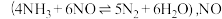 的转化率随温度的变化情况如图所示:
的转化率随温度的变化情况如图所示: 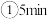 内温度从
内温度从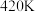 升高到
升高到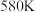 ,此时段内
,此时段内 的平均反应速率
的平均反应速率
_______ (保留 位有效数字)。
位有效数字)。
②无氧条件下, 生成
生成 的转化率较低,原因可能是
的转化率较低,原因可能是 _______ 。
 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。 已知:
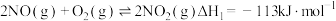 ;
; ;
;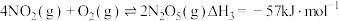
(1)
 氧化脱除
氧化脱除 的总反应是
的总反应是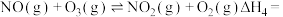
(2)该反应过程有两步:
 ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数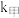
 (填“
(填“ ”、“
”、“ ”或“
”或“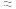 ”),原因是
”),原因是 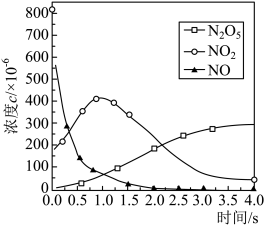
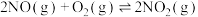 的反应历程分两步:
的反应历程分两步: | 步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
| Ⅰ |  (快) (快) |  | 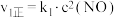 | 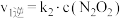 |
| Ⅱ | 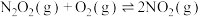 (慢) | 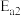 | 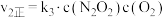 |  |

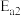 (填“
(填“ ”“
”“ ”或“
”或“ ”)。反应
”)。反应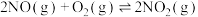 的平衡常数
的平衡常数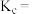
 、
、 、
、 、
、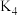 表示)。
表示)。 ②在
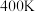 、初始压强为
、初始压强为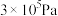 的恒温刚性容器(体积为VL)中,按
的恒温刚性容器(体积为VL)中,按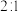 通入
通入 和
和 一定条件下发生反应。达平衡时
一定条件下发生反应。达平衡时 转化率为
转化率为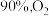 转化率为
转化率为
(4)某研究小组将
 、
、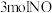 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应
催化剂表面发生反应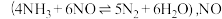 的转化率随温度的变化情况如图所示:
的转化率随温度的变化情况如图所示: 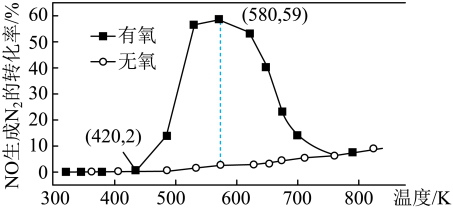
 内温度从
内温度从 升高到
升高到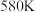 ,此时段内
,此时段内 的平均反应速率
的平均反应速率
 位有效数字)。
位有效数字)。 ②无氧条件下,
 生成
生成 的转化率较低,原因可能是
的转化率较低,原因可能是
您最近一年使用:0次
名校
解题方法
8 . 可以证明可逆反应 已达到平衡状态的是
已达到平衡状态的是
①一个 键断裂的同时,有6个
键断裂的同时,有6个 键断裂;
键断裂;
②一个 键断裂的同时,有3个
键断裂的同时,有3个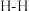 键断裂;
键断裂;
③其它条件不变时,混合气体平均相对分子质量不再改变;
④保持其它条件不变时,体系压强不再改变;
⑤恒温恒容时,密度保持不变;
⑥正反应速率 ,逆反应速率
,逆反应速率
 已达到平衡状态的是
已达到平衡状态的是①一个
 键断裂的同时,有6个
键断裂的同时,有6个 键断裂;
键断裂;②一个
 键断裂的同时,有3个
键断裂的同时,有3个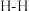 键断裂;
键断裂;③其它条件不变时,混合气体平均相对分子质量不再改变;
④保持其它条件不变时,体系压强不再改变;
⑤恒温恒容时,密度保持不变;
⑥正反应速率
 ,逆反应速率
,逆反应速率
| A.全部 | B.只有②③④⑤ | C.①③④⑥ | D.只有②③⑤⑧ |
您最近一年使用:0次
名校
解题方法
9 . 在恒温恒压下,向密闭容器中充入4mol  和2mol
和2mol  ,发生如下反应:
,发生如下反应: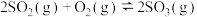 △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是
 和2mol
和2mol  ,发生如下反应:
,发生如下反应: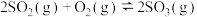 △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是A.若反应开始时容器体积为2L,则 |
B.若把条件“恒温恒压”改为“恒压恒容”,则平衡后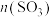 大于1.4mol 大于1.4mol |
C.2min后,向容器中再通入一定量的 气体,重新达到平衡时 气体,重新达到平衡时 的含量变小 的含量变小 |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于Q kJ |
您最近一年使用:0次
名校
解题方法
10 . 氮的单质及其化合物的综合利用是目前社会普遍关注的热点之一。
已知:Ⅰ.N2(g)+3H2(g) 2NH3(g) △H1=-92.4kJ/mol;
2NH3(g) △H1=-92.4kJ/mol;
Ⅱ.N2(g)+O2(g) 2NO(g) △H2=+180.0kJ/mol;
2NO(g) △H2=+180.0kJ/mol;
Ⅲ.2NO(g)+O2(g) 2NO2(g) △H3=-113.0kJ/mol。
2NO2(g) △H3=-113.0kJ/mol。
回答下列问题:
(1)已知反应Ⅲ中的NO(g)和O2(g)经步骤1和步骤2转化为NO2(g),该过程的能量变化如图所示: N2O4(g) △H4=-akJ/mol,平衡常数K1;
N2O4(g) △H4=-akJ/mol,平衡常数K1;
步骤2:______________ △H5,平衡常数K2;
①步骤2对应反应的热化学方程式为:______________ 。
②反应Ⅲ的平衡常数K=____ (用含K1、K2的代数式表示)。
下列措施既能提高反应Ⅲ的平衡转化率,又能加快生成NO2的反应速率的是______ (填字母)。
a.升高温度 b.缩小容器体积 c.加入催化剂
(2)在不同压强下,向密闭容器中充入物质的量分数(物质i的物质的量分数:xi=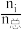 ×100%)分别为67.5%、22.5%、10.0%的H2、N2和Ar的混合气体发生反应I,测得NH3的平衡物质的量分数x(NH3)与温度T、压强p的关系如图所示。
×100%)分别为67.5%、22.5%、10.0%的H2、N2和Ar的混合气体发生反应I,测得NH3的平衡物质的量分数x(NH3)与温度T、压强p的关系如图所示。_______ v逆(b)填“>”“<”或“=”)。
②曲线L2对应p2压强下,x(NH3)=25%时,N2的转化率α=_____ %(保留三位有效数字)。
③若维持起始曲线L2对应的外界条件不变时,以x(H2)=75%、x(N2)=25%进行重复实验,则曲线L2是否可移至曲线L4:______ (填“是”或“否”),理由为__________ 。
(3)一定温度下,向5L恒容密闭容器中充入5molN2、5molH2、1molO2,发生反应I、Ⅱ、Ⅲ。实验测得反应前容器内气体压强为p0MPa。10min末达到平衡时N2的转化率为30%,NH3和NO2物质的量分别为2mol、0.8mol。
①0~10min内平均反应速率v(O2)=________ mol/(L·min)。
②反应Ⅱ的Kp=_______ (Kp是用分压表示的平衡常数,保留三位有效数字)。
③提高反应Ⅰ选择性的有效措施为____________ 。
已知:Ⅰ.N2(g)+3H2(g)
 2NH3(g) △H1=-92.4kJ/mol;
2NH3(g) △H1=-92.4kJ/mol;Ⅱ.N2(g)+O2(g)
 2NO(g) △H2=+180.0kJ/mol;
2NO(g) △H2=+180.0kJ/mol;Ⅲ.2NO(g)+O2(g)
 2NO2(g) △H3=-113.0kJ/mol。
2NO2(g) △H3=-113.0kJ/mol。回答下列问题:
(1)已知反应Ⅲ中的NO(g)和O2(g)经步骤1和步骤2转化为NO2(g),该过程的能量变化如图所示:

 N2O4(g) △H4=-akJ/mol,平衡常数K1;
N2O4(g) △H4=-akJ/mol,平衡常数K1;步骤2:______________ △H5,平衡常数K2;
①步骤2对应反应的热化学方程式为:
②反应Ⅲ的平衡常数K=
下列措施既能提高反应Ⅲ的平衡转化率,又能加快生成NO2的反应速率的是
a.升高温度 b.缩小容器体积 c.加入催化剂
(2)在不同压强下,向密闭容器中充入物质的量分数(物质i的物质的量分数:xi=
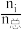 ×100%)分别为67.5%、22.5%、10.0%的H2、N2和Ar的混合气体发生反应I,测得NH3的平衡物质的量分数x(NH3)与温度T、压强p的关系如图所示。
×100%)分别为67.5%、22.5%、10.0%的H2、N2和Ar的混合气体发生反应I,测得NH3的平衡物质的量分数x(NH3)与温度T、压强p的关系如图所示。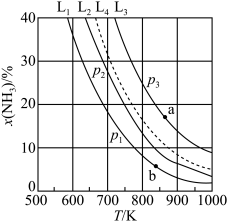
②曲线L2对应p2压强下,x(NH3)=25%时,N2的转化率α=
③若维持起始曲线L2对应的外界条件不变时,以x(H2)=75%、x(N2)=25%进行重复实验,则曲线L2是否可移至曲线L4:
(3)一定温度下,向5L恒容密闭容器中充入5molN2、5molH2、1molO2,发生反应I、Ⅱ、Ⅲ。实验测得反应前容器内气体压强为p0MPa。10min末达到平衡时N2的转化率为30%,NH3和NO2物质的量分别为2mol、0.8mol。
①0~10min内平均反应速率v(O2)=
②反应Ⅱ的Kp=
③提高反应Ⅰ选择性的有效措施为
您最近一年使用:0次



