名校
解题方法
1 . 合成氨工业对化工发展和国防工业具有重要意义,可以进一步获取氮肥和硝酸。工业合成氨生产流程如图所示。已知 。回答下列问题。
。回答下列问题。

(1)工业合成氨中对原料气必须净化的原因是___________ 。铁触媒为 的原因是
的原因是___________ 。
(2)Y气体是___________ ,分离X气体的目的是___________ 。
(3)某实验小组在实验室中模拟合成氨过程,在 时,将
时,将 和
和 置于恒温、体积为
置于恒温、体积为 的容器中反应。测得氨气的浓度随时间变化的曲线如图所示。
的容器中反应。测得氨气的浓度随时间变化的曲线如图所示。

①则用氢气表示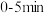 的化学反应速率为
的化学反应速率为
___________ 。反应结束时 的转化率为
的转化率为___________ 。
②下列情况能判断反应已达平衡的是___________ 。
A. 与
与 浓度比为
浓度比为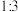
B.混合气体密度不变
C.混合气体压强不变
D.生成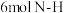 键同时生成
键同时生成 键
键
(4)工业上采取以下措施提高原料利用率,其中能用勒夏特列原理解释的是___________。
 。回答下列问题。
。回答下列问题。
(1)工业合成氨中对原料气必须净化的原因是
 的原因是
的原因是(2)Y气体是
(3)某实验小组在实验室中模拟合成氨过程,在
 时,将
时,将 和
和 置于恒温、体积为
置于恒温、体积为 的容器中反应。测得氨气的浓度随时间变化的曲线如图所示。
的容器中反应。测得氨气的浓度随时间变化的曲线如图所示。
①则用氢气表示
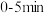 的化学反应速率为
的化学反应速率为
 的转化率为
的转化率为②下列情况能判断反应已达平衡的是
A.
 与
与 浓度比为
浓度比为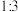
B.混合气体密度不变
C.混合气体压强不变
D.生成
 键同时生成
键同时生成 键
键(4)工业上采取以下措施提高原料利用率,其中能用勒夏特列原理解释的是___________。
| A.加入催化剂 | B.增大反应容器的压强 |
| C.升高温度 | D.设法分离产生的氨 |
您最近一年使用:0次
名校
2 . 在一定条件下,容积为2L的密闭容器中,将2molL气体和3molM气体混合,发生如下反应:2L(g)+3M(g) xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4mol•L-1。计算:
xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4mol•L-1。计算:
(1)10s末L的物质的量浓度为_______ 。
(2)前10s内用M表示的化学反应速率为_______ 。
(3)化学方程式中x值为_______ 。
(4)L(g)的转化率为_______ 。
(5)在恒温恒容条件下,往容器中加入1mol氦气,反应速率________ 。(填“增大”、“减小”或“不变”,下同)。
(6)在恒温恒压条件,往容器中加入1mol氦气,反应速率________ 。
 xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4mol•L-1。计算:
xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4mol•L-1。计算:(1)10s末L的物质的量浓度为
(2)前10s内用M表示的化学反应速率为
(3)化学方程式中x值为
(4)L(g)的转化率为
(5)在恒温恒容条件下,往容器中加入1mol氦气,反应速率
(6)在恒温恒压条件,往容器中加入1mol氦气,反应速率
您最近一年使用:0次
名校
3 . 汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) △H>0,已知该反应在T℃时,平衡常数K=9.0。请回答:
2NO(g) △H>0,已知该反应在T℃时,平衡常数K=9.0。请回答:
(1)该反应的平衡常数表达式为:K=_______ 。
(2)某温度下,向2L的密闭容器中充入N2和O2各1mol,5s后O2的物质的量为0.4mol,则0~5s内NO的反应速率_______ mol•L-1•min-1。
(3)下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是_______ 。
(4)将N2、O2混合充入恒温恒容密闭容器中,下列变化趋势正确的是_______ (填字母序号)。
(5)T℃时,某时刻测得容器内N2、O2、NO的浓度分别为0.20mol/L,0.20mol/L和0.50mol/L,此时反应v正(N2)______ v逆(N2)(填“>”、“=”或“<”)原因为______ 。
 2NO(g) △H>0,已知该反应在T℃时,平衡常数K=9.0。请回答:
2NO(g) △H>0,已知该反应在T℃时,平衡常数K=9.0。请回答:(1)该反应的平衡常数表达式为:K=
(2)某温度下,向2L的密闭容器中充入N2和O2各1mol,5s后O2的物质的量为0.4mol,则0~5s内NO的反应速率
(3)下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是
| A.v(N2)=0.4mol•L-1•min-1 | B.v(NO)=0.6mol•L-1•min-1 |
| C.v(O2)=0.3mol•L-1•s-1 | D.v(NO)=0.4mol•L-1•s-1 |
(4)将N2、O2混合充入恒温恒容密闭容器中,下列变化趋势正确的是

(5)T℃时,某时刻测得容器内N2、O2、NO的浓度分别为0.20mol/L,0.20mol/L和0.50mol/L,此时反应v正(N2)
您最近一年使用:0次
2023-10-27更新
|
67次组卷
|
2卷引用:四川省凉山州民族中学2023-2024学年高二上学期10月月考化学试题
名校
4 . Ⅰ.将CO2转化成甲醇燃料是减排、环保的一种科学方法。
已知:2H2(g)+O2(g) =2H2O(g);ΔH=-483.6kJ·mol-1 ①
2CO2(g)+4H2O(g) = 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
(1)用CO2与H2反应制备 CH3OH(g),同时生成水蒸气的热化学方程式为:CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH=___________ 。
Ⅱ.在容积为2L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。

试回答下列问题:
(2)800℃时,0~5min内,以B表示的平均反应速率为___________ 。
(3)能判断该反应达到化学平衡状态的依据是___________ 。
a.容器中压强不变 b.混合气体中c(A)不变
c.v正(B)=2v逆(D) d.c(A)=c(C)
(4)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=___________ ,该反应为___________ 反应(填吸热或放热),判断理由是___________ 。
(5)800℃时,某时刻测得体系中各物质的量如下:n(A)=0.9mol,n(B)=2.0mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应___________ 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
已知:2H2(g)+O2(g) =2H2O(g);ΔH=-483.6kJ·mol-1 ①
2CO2(g)+4H2O(g) = 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
(1)用CO2与H2反应制备 CH3OH(g),同时生成水蒸气的热化学方程式为:CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH=
Ⅱ.在容积为2L的密闭容器中,进行如下反应:A(g)+2B(g)
 C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(2)800℃时,0~5min内,以B表示的平均反应速率为
(3)能判断该反应达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(A)不变
c.v正(B)=2v逆(D) d.c(A)=c(C)
(4)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=
(5)800℃时,某时刻测得体系中各物质的量如下:n(A)=0.9mol,n(B)=2.0mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应
您最近一年使用:0次
名校
解题方法
5 . 反应 ,在
,在 的密闭容器中进行,
的密闭容器中进行, 后,
后, 的物质的量增加了
的物质的量增加了 。下列叙述正确的是
。下列叙述正确的是
 ,在
,在 的密闭容器中进行,
的密闭容器中进行, 后,
后, 的物质的量增加了
的物质的量增加了 。下列叙述正确的是
。下列叙述正确的是A.A的平均反应速率是 |
B.容器中含 物质的量至少为 物质的量至少为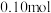 |
| C.容器中A、B、C、D的物质的量的比一定是2:4:3:1 |
D.容器中B的物质的量浓度一定增加了 |
您最近一年使用:0次
2023-07-29更新
|
355次组卷
|
3卷引用:四川省凉山州民族中学2023-2024学年高二上学期10月月考化学试题
四川省凉山州民族中学2023-2024学年高二上学期10月月考化学试题云南省昆明市西山区2022-2023学年高二上学期1月期末考试化学试题(已下线)专题03 化学反应速率-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
6 .  高效转化利用是实现“碳达峰”“碳中和”的重要一环。
高效转化利用是实现“碳达峰”“碳中和”的重要一环。 催化加氢制甲醇反应的方程式为:
催化加氢制甲醇反应的方程式为: 。回答下列问题:
。回答下列问题:
(1)写出一种能加快 催化加氢制甲醇反应速率的措施
催化加氢制甲醇反应速率的措施___________ 。
(2)在温度恒定、容器容积不变的条件下,能说明 催化加氢制甲醇反应已达平衡状态的___________。
催化加氢制甲醇反应已达平衡状态的___________。
(3)某温度下,在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,测得
,测得 、
、 的物质的量随时间变化如图:
的物质的量随时间变化如图:

① 末时的正反应速率
末时的正反应速率___________ 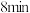 末时的正反应速率(填“大于”“小于”或“等于”,下同),
末时的正反应速率(填“大于”“小于”或“等于”,下同), 末时的正反应速率
末时的正反应速率___________  末时逆反应速率。
末时逆反应速率。
② 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为___________ 。
③平衡时 的转化率为
的转化率为___________ 。
 高效转化利用是实现“碳达峰”“碳中和”的重要一环。
高效转化利用是实现“碳达峰”“碳中和”的重要一环。 催化加氢制甲醇反应的方程式为:
催化加氢制甲醇反应的方程式为: 。回答下列问题:
。回答下列问题:(1)写出一种能加快
 催化加氢制甲醇反应速率的措施
催化加氢制甲醇反应速率的措施(2)在温度恒定、容器容积不变的条件下,能说明
 催化加氢制甲醇反应已达平衡状态的___________。
催化加氢制甲醇反应已达平衡状态的___________。A. 体积分数保持不变 体积分数保持不变 |
B.容器中 与 与 物质的量相等 物质的量相等 |
| C.容器内气体的密度不再变化 |
D. 的生成速率与 的生成速率与 的生成速率相等 的生成速率相等 |
 的密闭容器中,充入
的密闭容器中,充入 和
和 ,测得
,测得 、
、 的物质的量随时间变化如图:
的物质的量随时间变化如图:
①
 末时的正反应速率
末时的正反应速率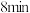 末时的正反应速率(填“大于”“小于”或“等于”,下同),
末时的正反应速率(填“大于”“小于”或“等于”,下同), 末时的正反应速率
末时的正反应速率 末时逆反应速率。
末时逆反应速率。②
 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为③平衡时
 的转化率为
的转化率为
您最近一年使用:0次
2023-07-14更新
|
355次组卷
|
2卷引用:四川省凉山州2022-2023学年高一下学期7月期末考试化学试题
7 . 为探究反应物浓度、温度对化学反应速率的影响,某实验小组设计了如下实验(反应原理为: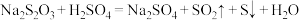 ),下列说法正确的是
),下列说法正确的是
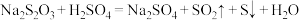 ),下列说法正确的是
),下列说法正确的是| 实验编号 | 加入 溶液的体积/mL 溶液的体积/mL | 加入蒸馏水的体积/mL | 加入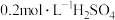 溶液的体积/mL 溶液的体积/mL | 反应温度/℃ | 浑浊出现时间/s |
| 1 | 2 | 0 | 2 | 20 | t1 |
| 2 | 1 | V1 | 2 | 20 | t2 |
| 3 | 2 | 0 | 2 | 50 | t3 |
| 4 | 2 | 1 | V2 | 50 | t4 |
| A.V1=V2=1 |
| B.实验1、4可探究温度对化学反应速率的影响 |
| C.t1<t3 |
D.实验1中反应速率可表示为: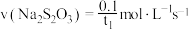 |
您最近一年使用:0次
名校
8 . 汽车尾气作为空气污染的主要来源之一,尾气中含有大量的有害物质,包括氮氧化物、一氧化碳、碳氢化合物和固体悬浮颗粒,其直接危害人体健康,还会对人类生活的环境产生深远影响。研究氮的氧化物和碳的氧化物等大气污染物的处理具有重要意义。
(1)高温情况下,气缸中1molN2和1molO2反应生成2molNO的能量变化如图所示。
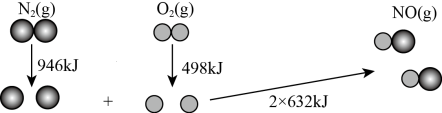
该条件下反应生成2molNO(g)___________ (填“吸收”或“放出”)___________ kJ的热量。
(2)为减少汽车尾气的排放,在排气管内安装的三元催化转化器可使尾气的主要污染物NO和CO转化为无毒无害的大气循环物质。在一定温度下,恒容密闭容器中发生反应如下: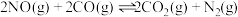 ,将0.8molNO和1.2molCO充入2L密闭容器中,模拟尾气转化,容器中NO物质的量随时间变化关系如图所示:
,将0.8molNO和1.2molCO充入2L密闭容器中,模拟尾气转化,容器中NO物质的量随时间变化关系如图所示:
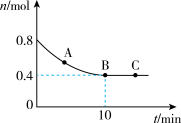
①图中A、B、C三点未达到化学平衡状态的点是___________ ;
②反应0~10min内,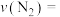
___________  ;CO的转化率为
;CO的转化率为___________ (保留三位有效数字)。
③只改变下列某一反应条件时,能使上述转化速率加快的是___________ (填序号)。
a.使用高效催化剂 b.向容器中充入氩气
c.降低温度 d.减小NO的物质的量
④下列能判断该反应达到化学平衡状态的是___________ (填序号)。
A.CO的浓度保持不变 B.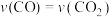
C. D.NO、CO、CO2、N2的物质的量之比为2∶2∶2∶1
D.NO、CO、CO2、N2的物质的量之比为2∶2∶2∶1
(3)在碱性条件下,NH3和NO可设计为原电池装置,将一氧化氮转化为N2,电池的总反应为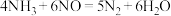 。其工作原理如图所示:
。其工作原理如图所示:
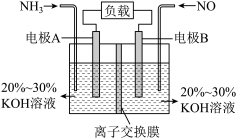
①电极A为___________ 极(填“正”“负”)。
②电极B发生的电极反应为___________ 。
③标准状况下,若电极B上消耗44.8L一氧化氮时,则转移的电子总数为___________ 。
(1)高温情况下,气缸中1molN2和1molO2反应生成2molNO的能量变化如图所示。

该条件下反应生成2molNO(g)
(2)为减少汽车尾气的排放,在排气管内安装的三元催化转化器可使尾气的主要污染物NO和CO转化为无毒无害的大气循环物质。在一定温度下,恒容密闭容器中发生反应如下:
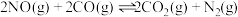 ,将0.8molNO和1.2molCO充入2L密闭容器中,模拟尾气转化,容器中NO物质的量随时间变化关系如图所示:
,将0.8molNO和1.2molCO充入2L密闭容器中,模拟尾气转化,容器中NO物质的量随时间变化关系如图所示:
①图中A、B、C三点未达到化学平衡状态的点是
②反应0~10min内,
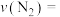
 ;CO的转化率为
;CO的转化率为③只改变下列某一反应条件时,能使上述转化速率加快的是
a.使用高效催化剂 b.向容器中充入氩气
c.降低温度 d.减小NO的物质的量
④下列能判断该反应达到化学平衡状态的是
A.CO的浓度保持不变 B.
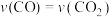
C.
 D.NO、CO、CO2、N2的物质的量之比为2∶2∶2∶1
D.NO、CO、CO2、N2的物质的量之比为2∶2∶2∶1(3)在碱性条件下,NH3和NO可设计为原电池装置,将一氧化氮转化为N2,电池的总反应为
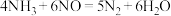 。其工作原理如图所示:
。其工作原理如图所示:
①电极A为
②电极B发生的电极反应为
③标准状况下,若电极B上消耗44.8L一氧化氮时,则转移的电子总数为
您最近一年使用:0次
2023-07-06更新
|
99次组卷
|
2卷引用:四川省凉山州安宁河联盟2022-2023学年高一下学期期末联考化学试题
解题方法
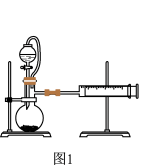
9 . Ⅰ.某课外活动小组利用如图1装置探究Zn与酸反应速率的影响因素。记录生成氢气的体积及时间。
(1)阴离子对反应速率的影响
实验药品:500mL0.4mol•L-1盐酸、500mLamol•L-1硫酸,等质量、等大小的过量Zn片。记录数据绘制成图2。回答下列问题:
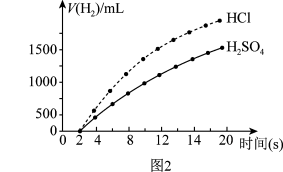
①实验中所用硫酸的浓度为______ 。
②反应开始的0~2s内,未产生氢气,可能的原因是______ 。
③根据实验数据绘制的图像可知,在相同时间段内,锌与500mL0.4mol•L-1盐酸反应速率_____ (填“大于”或“小于”)锌与500mLamol•L-1硫酸反应速率。
(2)温度对反应速率的影响
取2L1mol/LHCl溶液于图一装置中,分别加入同等大小的锌粒,在不同温度下反应,记录相同时间内产生的H2的体积,实验数据记录如表(换算成标况):
①计算308K时在0s~40s时间内氯化氢的平均反应速率v(HCl)=______ (忽略溶液体积变化)。
②根据表中数据可知,温度越高,化学反应速率越______ (填“快”或“慢”)。
(3)催化剂对反应速率的影响
该研究小组的同学为研究Fe3+对H2O2分解的催化效果,设计了如图所示的实验。
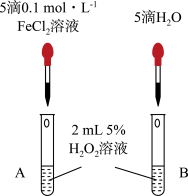
产生气泡更快的是______ (填“A”或“B”)。
Ⅱ.回答下列问题:
(4)某实验小组在温度为T时,向烧杯中加入10mL0.1mol/LFeCl3溶液和20mL0.1mol/LKI溶液,发生反应2Fe3++2I- 2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是
2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是______ 。

(1)阴离子对反应速率的影响
实验药品:500mL0.4mol•L-1盐酸、500mLamol•L-1硫酸,等质量、等大小的过量Zn片。记录数据绘制成图2。回答下列问题:

①实验中所用硫酸的浓度为
②反应开始的0~2s内,未产生氢气,可能的原因是
③根据实验数据绘制的图像可知,在相同时间段内,锌与500mL0.4mol•L-1盐酸反应速率
(2)温度对反应速率的影响
取2L1mol/LHCl溶液于图一装置中,分别加入同等大小的锌粒,在不同温度下反应,记录相同时间内产生的H2的体积,实验数据记录如表(换算成标况):
| 实验① | 298K | 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积(mL) | 14.5 | 36.6 | 61.6 | 141.6 | 224 | 389 | 450 | 496 | 517.6 | 534 | ||
| 实验② | 308K | 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算308K时在0s~40s时间内氯化氢的平均反应速率v(HCl)=
②根据表中数据可知,温度越高,化学反应速率越
(3)催化剂对反应速率的影响
该研究小组的同学为研究Fe3+对H2O2分解的催化效果,设计了如图所示的实验。

产生气泡更快的是
Ⅱ.回答下列问题:
(4)某实验小组在温度为T时,向烧杯中加入10mL0.1mol/LFeCl3溶液和20mL0.1mol/LKI溶液,发生反应2Fe3++2I-
 2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是
2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是| A.溶液颜色不再发生变化 | B.v(Fe3+)=2v(I2) |
| C.Fe2+浓度不再发生变化 | D.消耗1molFe3+的同时生成1molI- |
您最近一年使用:0次
名校
10 . 恒温恒容下,将2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g)  xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2 mol∙L−1,下列说法中不正确的是
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2 mol∙L−1,下列说法中不正确的是
 xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2 mol∙L−1,下列说法中不正确的是
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2 mol∙L−1,下列说法中不正确的是| A.从开始反应至达到平衡状态,生成C的平均反应速率为0.6 mol/(L·min) |
| B.x=3 |
| C.A的转化率与B的转化率之比为2∶1 |
| D.平衡时A的浓度为0.4mol·L-1 |
您最近一年使用:0次
2023-05-07更新
|
271次组卷
|
2卷引用:四川省凉山州宁南中学2023-2024学年高二上学期开学考试化学试题



