名校
1 . 常温下,向恒容密闭容器中充入一定量X、Y和M气体,所得体系中同时存在如下平衡:① ②
② ③
③
 ②
② ③
③

A.100~400s内, |
| B.100s时反应③的逆反应速率大于正反应速率 |
C.若改为恒压密闭容器,体系达平衡后再充入Ar(不参与反应),再次达平衡后 不变 不变 |
D.若反应③的活化能 ,则X比Y更稳定 ,则X比Y更稳定 |
您最近一年使用:0次
名校
2 .  溶液和
溶液和 溶液可发生反应:
溶液可发生反应: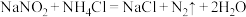 。为探究反应速率v与
。为探究反应速率v与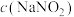 的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积V的
的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积V的
 溶液、
溶液、 溶液和水,充分搅拌,无明显现象。控制体系温度,通过分液漏斗向锥形瓶中加入
溶液和水,充分搅拌,无明显现象。控制体系温度,通过分液漏斗向锥形瓶中加入 醋酸。当导管口气泡均匀稳定冒出时,用排水法收集气体。用秒表测量收集1.0mL
醋酸。当导管口气泡均匀稳定冒出时,用排水法收集气体。用秒表测量收集1.0mL 所需时间t。实验数据如下表。下列说法正确的
所需时间t。实验数据如下表。下列说法正确的
 溶液和
溶液和 溶液可发生反应:
溶液可发生反应: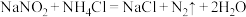 。为探究反应速率v与
。为探究反应速率v与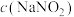 的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积V的
的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积V的
 溶液、
溶液、 溶液和水,充分搅拌,无明显现象。控制体系温度,通过分液漏斗向锥形瓶中加入
溶液和水,充分搅拌,无明显现象。控制体系温度,通过分液漏斗向锥形瓶中加入 醋酸。当导管口气泡均匀稳定冒出时,用排水法收集气体。用秒表测量收集1.0mL
醋酸。当导管口气泡均匀稳定冒出时,用排水法收集气体。用秒表测量收集1.0mL 所需时间t。实验数据如下表。下列说法正确的
所需时间t。实验数据如下表。下列说法正确的V/mL | t/s | ||||
|
| 醋酸 | 水 | ||
1 | 4.0 |
| 4.0 | 8.0 | 334 |
2 |
| 4.0 | 4.0 |
| 150 |
3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
A.实验3中,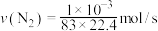 |
B.若实验4反应从开始到结束历时bs,则整个过程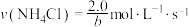 |
C. ;若 ;若 ,则 ,则 |
| D.醋酸可能作该反应的催化剂,且不改变反应历程 |
您最近一年使用:0次
名校
解题方法
3 . 氟化学在现代无机化学中占有相当重要的地位。请回答下列问题:
(1)1886年法国化学家莫瓦桑首次通过电解熔融的氟氢化钾(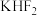 )制备
)制备 ,两极均有气体产生。装置如图所示,钢电极与电源的
,两极均有气体产生。装置如图所示,钢电极与电源的_____ (填“正极”或“负极”)相连,阳极反应式为______ ,两极产生的气体产物必须隔开的原因是________ 。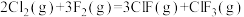
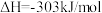 ;F-Cl(ClF中)的键能为248kJ/mol,F-Cl(
;F-Cl(ClF中)的键能为248kJ/mol,F-Cl( 中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为
中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为_______ kJ/mol。
(3)氟单质的氧化性很强,可与稀有气体氙(Xe)同时发生如下三个反应。
已知:分压=总压×该组分物质的量分数,对于反应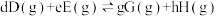 ,
,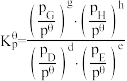 ,其中
,其中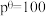 kPa,
kPa, 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。
①在恒温、恒容条件下,向密闭容器中通入一定量的Xe和 ,下列有关说法不正确的是
,下列有关说法不正确的是_______ (填序号)。
A.当混合气体的密度不变时,体系达到平衡
B.当Xe与 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于Xe
C.达到平衡后将 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
D.反应ⅰ、ⅱ、ⅲ均为放热反应
②在600K条件下,向体积为2L的密闭容器中通入30.0mol Xe和60.0mol ,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为
,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为_____  ,
, 的转化率为
的转化率为______ 。
③523K时,以Xe和 制取
制取 。反应达到平衡时,欲使产物
。反应达到平衡时,欲使产物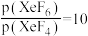 ,
, 的分压为
的分压为______ kPa。
(1)1886年法国化学家莫瓦桑首次通过电解熔融的氟氢化钾(
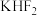 )制备
)制备 ,两极均有气体产生。装置如图所示,钢电极与电源的
,两极均有气体产生。装置如图所示,钢电极与电源的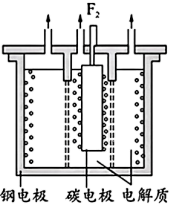
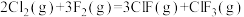
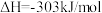 ;F-Cl(ClF中)的键能为248kJ/mol,F-Cl(
;F-Cl(ClF中)的键能为248kJ/mol,F-Cl( 中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为
中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为(3)氟单质的氧化性很强,可与稀有气体氙(Xe)同时发生如下三个反应。
| 标准平衡常数 | 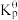 (523K) (523K) | 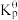 (673K) (673K) |
ⅰ.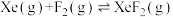 | 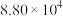 | 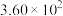 |
ⅱ. | 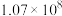 | 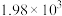 |
ⅲ. | 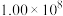 | 36 |
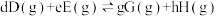 ,
,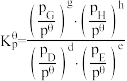 ,其中
,其中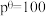 kPa,
kPa, 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。①在恒温、恒容条件下,向密闭容器中通入一定量的Xe和
 ,下列有关说法不正确的是
,下列有关说法不正确的是A.当混合气体的密度不变时,体系达到平衡
B.当Xe与
 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于XeC.达到平衡后将
 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动D.反应ⅰ、ⅱ、ⅲ均为放热反应
②在600K条件下,向体积为2L的密闭容器中通入30.0mol Xe和60.0mol
 ,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为
,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为 ,
, 的转化率为
的转化率为| 物质 |  |  |  |
| n/mol | 3.6 | 17.4 | 0.4 |
 制取
制取 。反应达到平衡时,欲使产物
。反应达到平衡时,欲使产物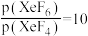 ,
, 的分压为
的分压为
您最近一年使用:0次
4 . 工业生产中常常产生硫的氧化物和氮的氧化物,对环境产生重大影响,为减少对环境的污染,科学工作者采用“O3氧化法”和“光催化氧化法”对工业烟气脱硫、脱硝,原理如下。回答下列问题:
I.O3氧化法
(1)用O3氧化烟气中的SO2时,体系中存在以下反应:
a)SO2(g)+O3(g)⇌SO3(g)+O2(g) △H1=-241.6kJ/mol K1
b)2O3(g)⇌3O2(g) △H2=-286.6kJ/mol K2
c)2SO2(g)+O2(g)⇌2SO3(g) △H3 K3
根据盖斯定律,△H3=_______ ,K3=_______ (用含K1、K2的式子表示)。
(2)在密闭容器中充入1molN2O4和1molO3,发生以下反应:
d)N2O4(g)⇌2NO2(g) △H4=+57kJ/mol
e)N2O4(g)+O3(g)⇌N2O5(g)+O2(g) △H5
不同压强(P)下,N2O4平衡转化率α(N2O4)随反应温度(T)的变化关系如图1所示。_______ 0(填“>”或“<”),若缩小体积增大压强,B点可能向_______ 点移动(填“A”或“C”)。
②下列有关该反应体系的说法正确的是_______ (填标号)。
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在n(NO2)+n(N2O4)+n(N2O5)>1mol
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大N2O4的浓度,反应d的正反应速率增大,e的正反应速率减小
③某温度下,t分钟后达到平衡,此时N2O4的物质的量分数为1/3,且NO2与O2的物质的量分数相等,v(O2)=_______ mol/min
Ⅱ.光催化氧化法
光照条件下,催化剂TiO2表面产生电子(e-)和空穴(h+)。电子与O2作用生成离子自由基(·O ),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO
),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO 。变化过程如图2所示。
。变化过程如图2所示。_______ 。
(4)已知该过程中生成的HNO2可继续与·OH发生反应:HNO2+2·OH=H++NO +H2O;该反应可分两步进行,请补充反应i:
+H2O;该反应可分两步进行,请补充反应i:
i:_______ ;
ii.NO2+·OH=H++NO 。
。
I.O3氧化法
(1)用O3氧化烟气中的SO2时,体系中存在以下反应:
a)SO2(g)+O3(g)⇌SO3(g)+O2(g) △H1=-241.6kJ/mol K1
b)2O3(g)⇌3O2(g) △H2=-286.6kJ/mol K2
c)2SO2(g)+O2(g)⇌2SO3(g) △H3 K3
根据盖斯定律,△H3=
(2)在密闭容器中充入1molN2O4和1molO3,发生以下反应:
d)N2O4(g)⇌2NO2(g) △H4=+57kJ/mol
e)N2O4(g)+O3(g)⇌N2O5(g)+O2(g) △H5
不同压强(P)下,N2O4平衡转化率α(N2O4)随反应温度(T)的变化关系如图1所示。

②下列有关该反应体系的说法正确的是
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在n(NO2)+n(N2O4)+n(N2O5)>1mol
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大N2O4的浓度,反应d的正反应速率增大,e的正反应速率减小
③某温度下,t分钟后达到平衡,此时N2O4的物质的量分数为1/3,且NO2与O2的物质的量分数相等,v(O2)=
Ⅱ.光催化氧化法
光照条件下,催化剂TiO2表面产生电子(e-)和空穴(h+)。电子与O2作用生成离子自由基(·O
 ),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO
),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO 。变化过程如图2所示。
。变化过程如图2所示。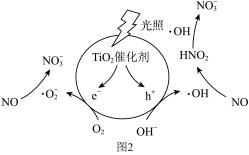
(4)已知该过程中生成的HNO2可继续与·OH发生反应:HNO2+2·OH=H++NO
 +H2O;该反应可分两步进行,请补充反应i:
+H2O;该反应可分两步进行,请补充反应i:i:
ii.NO2+·OH=H++NO
 。
。
您最近一年使用:0次
5 . 研究二氧化碳的转化与减排具有重要的社会意义。用 还原
还原 的反应过程如下:
的反应过程如下:
①
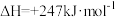
②

回答下列问题:
(1)

_______ 。
(2)同时提高 与
与 的平衡转化率和速率的措施是
的平衡转化率和速率的措施是_______ 。
(3)在密闭容器中分别充入0.1mol 与0.3mol
与0.3mol 。
。
①保持密闭容器体积为10L,只发生①②反应,经10min反应达到平衡,测定出 和
和 均为0.05mol。10min内
均为0.05mol。10min内 的平均反应速率为
的平均反应速率为____ ;该条件下,反应②的平衡常数为_____ 。
②在150℃时,改变密闭容器的体积,测得 和
和 平衡转化率随压强变化如图所示。
平衡转化率随压强变化如图所示。 平衡转化率随压强增大而减小的主要原因是
平衡转化率随压强增大而减小的主要原因是____ ; 后
后 平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是
平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是_______ 。 和
和 ,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下: 体积分数很低,主要原因是活化能
体积分数很低,主要原因是活化能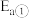
_______ 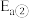 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②随温度升高, 的体积分数变化趋势为先增后减小,其可能原因是
的体积分数变化趋势为先增后减小,其可能原因是_______ 。
 还原
还原 的反应过程如下:
的反应过程如下:①

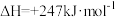
②


回答下列问题:
(1)


(2)同时提高
 与
与 的平衡转化率和速率的措施是
的平衡转化率和速率的措施是(3)在密闭容器中分别充入0.1mol
 与0.3mol
与0.3mol 。
。①保持密闭容器体积为10L,只发生①②反应,经10min反应达到平衡,测定出
 和
和 均为0.05mol。10min内
均为0.05mol。10min内 的平均反应速率为
的平均反应速率为②在150℃时,改变密闭容器的体积,测得
 和
和 平衡转化率随压强变化如图所示。
平衡转化率随压强变化如图所示。 平衡转化率随压强增大而减小的主要原因是
平衡转化率随压强增大而减小的主要原因是 后
后 平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是
平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是
 和
和 ,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下: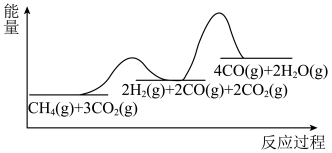
 体积分数很低,主要原因是活化能
体积分数很低,主要原因是活化能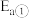
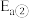 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②随温度升高,
 的体积分数变化趋势为先增后减小,其可能原因是
的体积分数变化趋势为先增后减小,其可能原因是
您最近一年使用:0次
名校
6 . 某密闭容器中含有X和Y,同时发生以下两个反应:① ;②
;② 。反应①的正反应速率
。反应①的正反应速率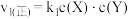 ,反应②的正反应速率
,反应②的正反应速率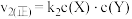 ,其中
,其中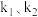 为速率常数。某温度下,体系中生成物浓度
为速率常数。某温度下,体系中生成物浓度 随时间
随时间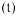 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是
 ;②
;② 。反应①的正反应速率
。反应①的正反应速率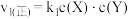 ,反应②的正反应速率
,反应②的正反应速率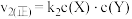 ,其中
,其中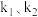 为速率常数。某温度下,体系中生成物浓度
为速率常数。某温度下,体系中生成物浓度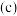 随时间
随时间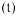 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是
A. 时,正反应速率 时,正反应速率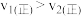 |
B.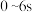 内,X的平均反应速率 内,X的平均反应速率 |
C.若升高温度, 时容器中 时容器中 的比值减小 的比值减小 |
| D.反应①的活化能大于反应② |
您最近一年使用:0次
2024-03-08更新
|
426次组卷
|
5卷引用:四川省成都市石室中学2023-2024学年高二下学期4月月考化学试卷
四川省成都市石室中学2023-2024学年高二下学期4月月考化学试卷2024届河北省各市高三下学期一模联考化学试题(已下线)选择题11-14(已下线)提升练03 反应历程探究与催化原理-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河北省衡水市衡水董子高级中学2023-2024学年高三下学期3月月考化学试题
名校
7 . 工业生产硝酸的核心反应之一是在恒压装置中将NO转化为 :
:
反应Ⅰ:

目前认为反应Ⅰ分两步进行:
反应Ⅱ:
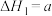
反应Ⅲ: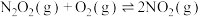
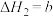
回答下列问题:
(1)已知: (C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
(C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
_____  。该工艺适宜的压强条件是
。该工艺适宜的压强条件是_____ (填“高压”或“低压”)。
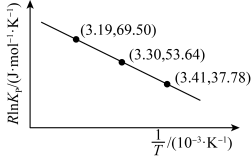
(2)Raoult定律表明:一定温度下,在稀溶液中,溶剂的饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶液中溶剂的物质的量分数。下图中甲烧杯盛有甲醇,乙烧杯盛有氢氧化钠的甲醇溶液,常温下,将甲、乙两烧杯置于真空密闭容器中,足够长的时间后,从下图中选择出可能会观察到的现象_____ (用字母表示)。
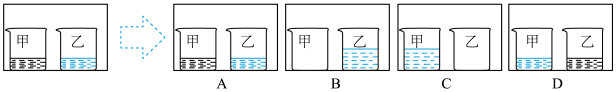
(3)控制原料比 ,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当
,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当 、90℃时,NO转化率达到50%的过程中,
、90℃时,NO转化率达到50%的过程中,
_____  (保留3位有效数字)。
(保留3位有效数字)。
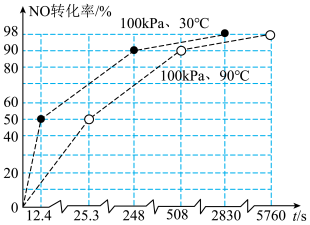
(4)由图可知,反应Ⅰ的速率随温度升高而_____ (填“增大”“减小”或“不变”),可能的原因是_____ 。[已知反应Ⅱ为快速平衡, ,反应Ⅲ的速率方程为
,反应Ⅲ的速率方程为 ]。
]。
(5)T℃、 时,控制原料比
时,控制原料比 发生反应Ⅰ(
发生反应Ⅰ( 由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
_____ 。
(6)已知不同温度下反应Ⅰ的浓度平衡常数 如表。
如表。
NO由 催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有
催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有_____ (写出两条即可)。
 :
:反应Ⅰ:


目前认为反应Ⅰ分两步进行:
反应Ⅱ:

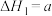
反应Ⅲ:
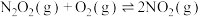
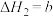
回答下列问题:
(1)已知:
 (C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
(C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
 。该工艺适宜的压强条件是
。该工艺适宜的压强条件是
(2)Raoult定律表明:一定温度下,在稀溶液中,溶剂的饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶液中溶剂的物质的量分数。下图中甲烧杯盛有甲醇,乙烧杯盛有氢氧化钠的甲醇溶液,常温下,将甲、乙两烧杯置于真空密闭容器中,足够长的时间后,从下图中选择出可能会观察到的现象

(3)控制原料比
 ,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当
,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当 、90℃时,NO转化率达到50%的过程中,
、90℃时,NO转化率达到50%的过程中,
 (保留3位有效数字)。
(保留3位有效数字)。
(4)由图可知,反应Ⅰ的速率随温度升高而
 ,反应Ⅲ的速率方程为
,反应Ⅲ的速率方程为 ]。
]。(5)T℃、
 时,控制原料比
时,控制原料比 发生反应Ⅰ(
发生反应Ⅰ( 由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
(6)已知不同温度下反应Ⅰ的浓度平衡常数
 如表。
如表。| 温度/℃ | 27 | 77 | 127 | 177 | 227 | 500 |
平衡常数 | 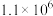 |  |  |  |  | 1.0 |
 催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有
催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有
您最近一年使用:0次
解题方法
8 . 碳的资源化利用是实现碳中和目标的重要环节,将碳氧化物催化氢化制备燃料甲醇,对绿色化与可持续发展意义重大。已知催化氢化时同时存在:
反应I: (主反应)
(主反应)
反应Ⅱ: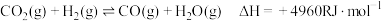 (R为大于0的常数,下同)
(R为大于0的常数,下同)
反应Ⅲ: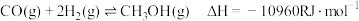
回答下列问题:
(1)在500K下,增大 平衡产率的方法有
平衡产率的方法有___________ (写两条)。
(2)目前应着力开发活性温度___________ (填“更低”或“更高”)的催化剂。
(3)已知 (K为平衡常数,
(K为平衡常数, 、R和C均视为常数),反应Ⅰ在不同温度T下的
、R和C均视为常数),反应Ⅰ在不同温度T下的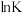 如下表中数据:
如下表中数据:
(i)反应I的
___________ (填“>”或“<”)0,判断理由是___________ 。
(ii)反应I的
___________  (用含常数R的式子表示)。
(用含常数R的式子表示)。
(4)判断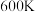 时,反应
时,反应___________ (填“I”或“Ⅲ”)在热力学上趋势更大。
(5)在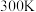 、恒压
、恒压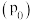 容器中加入
容器中加入 和
和 ,发生上述反应I和Ⅱ,
,发生上述反应I和Ⅱ, 后达平衡,
后达平衡, 平衡转化率为20%,甲醇的选择性(
平衡转化率为20%,甲醇的选择性(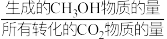 )为50%。
)为50%。
(i)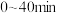 时,
时,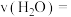
___________ 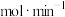 。
。
(ii)反应I的分压平衡常数
___________ (列出计算式)。
反应I:
 (主反应)
(主反应)反应Ⅱ:
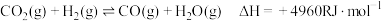 (R为大于0的常数,下同)
(R为大于0的常数,下同)反应Ⅲ:
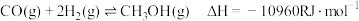
回答下列问题:
(1)在500K下,增大
 平衡产率的方法有
平衡产率的方法有(2)目前应着力开发活性温度
(3)已知
 (K为平衡常数,
(K为平衡常数, 、R和C均视为常数),反应Ⅰ在不同温度T下的
、R和C均视为常数),反应Ⅰ在不同温度T下的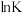 如下表中数据:
如下表中数据: | 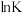 |
| 300 | 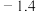 |
| 600 | 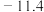 |

(ii)反应I的

 (用含常数R的式子表示)。
(用含常数R的式子表示)。(4)判断
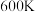 时,反应
时,反应(5)在
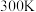 、恒压
、恒压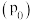 容器中加入
容器中加入 和
和 ,发生上述反应I和Ⅱ,
,发生上述反应I和Ⅱ, 后达平衡,
后达平衡, 平衡转化率为20%,甲醇的选择性(
平衡转化率为20%,甲醇的选择性(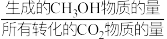 )为50%。
)为50%。(i)
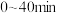 时,
时,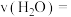
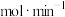 。
。(ii)反应I的分压平衡常数

您最近一年使用:0次
2024-01-06更新
|
246次组卷
|
2卷引用:2024届四川省成都市高中毕业班第一次诊断性检测理科综合
名校
9 . 某学习小组利用5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O来探究“外界条件对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4(一种弱酸)溶液,然后倒入大试管中迅速振荡,通过测定褪色所需时间来判断反应的快慢。
(1)下列因素能加快该反应速率的是___________。
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)___________ 。
(3)甲同学设计了如下实验
①探究温度对化学反应速率影响的组合实验编号是___________ 。
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。___________

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=___________ (保留3位有效数字)。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:___________ 。
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或 该反应有催化作用
该反应有催化作用
丙同学认为假设4不合理,其理由是___________ 。
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入___________ mL蒸馏水,然后在两支试管中同时分别加入1mL0.1mol·L-1KMnO4酸性溶液。预期的实验现象是___________ 。在B试管中加入蒸馏水的目的是___________ 。同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)___________ 。
(1)下列因素能加快该反应速率的是___________。
| A.加入少量K2SO4固体 | B.加入少量NaCl固体 |
| C.增大压强 | D.加入少量Na2C2O4固体 |
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)
(3)甲同学设计了如下实验
| 实验 编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | 褪色时间/s | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| a | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| b | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| c | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或
 该反应有催化作用
该反应有催化作用丙同学认为假设4不合理,其理由是
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入
您最近一年使用:0次
名校
解题方法
10 . 把2.5 mol A和2.5 mol B混合,装入容积为2 L的密闭容器里,发生反应:3 A(g)+B(g) xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D,下列叙述错误的是
xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D,下列叙述错误的是
 xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D,下列叙述错误的是
xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D,下列叙述错误的是| A.x=4 |
| B.达到平衡时容器内气体的压强与起始时的压强比为6:5 |
| C.达到平衡时B的体积分数约为33% |
| D.该反应的平衡常数Kc=8 |
您最近一年使用:0次






