解题方法
1 . 某温度下,在一个 的密闭容器中,加入
的密闭容器中,加入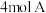 和
和 发生反应:
发生反应: ,反应
,反应 后达到平衡,测得生成
后达到平衡,测得生成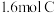 ,则下列说法正确的是
,则下列说法正确的是
 的密闭容器中,加入
的密闭容器中,加入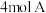 和
和 发生反应:
发生反应: ,反应
,反应 后达到平衡,测得生成
后达到平衡,测得生成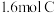 ,则下列说法正确的是
,则下列说法正确的是A.前 ,D的平均反应速率为 ,D的平均反应速率为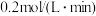 |
B.达到平衡时,B的平衡转化率是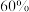 |
| C.升高该体系的温度,化学平衡常数不变 |
| D.增加C,逆向反应速率增大 |
您最近一年使用:0次
2 . Ⅰ.恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)  xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_________ 。
(2)x=__________ 。
(3)下列各项可作为该反应达到平衡状态的标志是________(填字母)。
Ⅱ.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
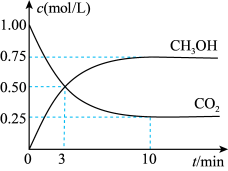
(4)氢气的转化率=________ 。
(5)下列措施能使平衡体系中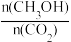 增大的是_______(填字母)。
增大的是_______(填字母)。
Ⅲ.恒温下,在容积为2L的恒容密闭容器A中通入1mol N2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
(6)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态_______ (填“是”或“否"),此时若没有达平衡,反应向_____ (填“正反应”或“逆反应”)方向进行。
 xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)下列各项可作为该反应达到平衡状态的标志是________(填字母)。
| A.压强不再变化 |
| B.气体密度不再变化 |
| C.气体平均相对分子质量不再变化 |
| D.A的消耗速率与B的消耗速率之比为2:1 |
Ⅱ.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(4)氢气的转化率=
(5)下列措施能使平衡体系中
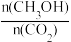 增大的是_______(填字母)。
增大的是_______(填字母)。| A.将H2O(g)从体系中分离出去 | B.充入He,使体系压强增大 |
| C.升高温度 | D.再充入1molH2 |
Ⅲ.恒温下,在容积为2L的恒容密闭容器A中通入1mol N2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g)
 2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。(6)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态
您最近一年使用:0次
解题方法
3 . 一定温度下,在2L的恒容密闭容器中发生反应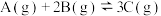 ,反应过程中的部分数据如下表所示:
,反应过程中的部分数据如下表所示:
n/mol t/min | n(A) | n(B) | n(C) |
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是
A.0~5min用A表示的平均反应速率为0.9 |
| B.该反应达到平衡后,升高温度,平衡常数增大 |
C.平衡状态时,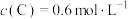 |
| D.物质B的平衡转化率为20% |
您最近一年使用:0次
4 . I.目前,常用三元催化将汽车尾气中NO和CO转化为CO2和N2。在密闭容器中模拟进行如下反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用分析判断其他物理量变化情况。
(1)增加CO的浓度,该反应的平衡常数K_______ 。
(2)保持反应容器压强和温度不变,通入He,平衡向_______ 移动,该反应的△H______ 。
Ⅱ.某温度时,在2L密闭容器中,加入气体A、B,经过一段时间后,气体A、B的物质的量随时间变化的曲线如图所示,回答下列问题:
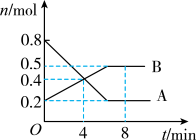
(3)该反应的化学方程式为______ 。
(4)0~4min内,用A表示反应速率v(A)=______ mol/(L•min)
(5)反应达平衡时容器内混合气体的平均相对分子质量比起始时______ (填“变大”、“变小”或“相等”)。
(6)下列措施能加快反应速率的是______ 。
 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用分析判断其他物理量变化情况。(1)增加CO的浓度,该反应的平衡常数K
(2)保持反应容器压强和温度不变,通入He,平衡向
Ⅱ.某温度时,在2L密闭容器中,加入气体A、B,经过一段时间后,气体A、B的物质的量随时间变化的曲线如图所示,回答下列问题:

(3)该反应的化学方程式为
(4)0~4min内,用A表示反应速率v(A)=

(5)反应达平衡时容器内混合气体的平均相对分子质量比起始时
(6)下列措施能加快反应速率的是
| A.缩小体积,使压强增大 | B.恒温恒容充入氦气 |
| C.恒温恒压充入氦气 | D.使用催化剂 |
您最近一年使用:0次
5 . I.科学家对汽车尾气进行无害化处理反应为:2CO+2NO⇌2CO2+N2。一定条件下,在1 L密闭容器中充入2.00mol CO和2.00mol NO,一段时间后测得CO、CO2浓度随时间变化如图1所示,CO的平衡转化率与温度、起始投料比m的关系如图2所示,图中起始投料比m= ,
,
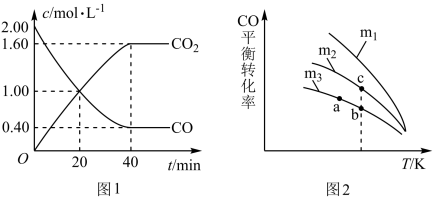
(1)该反应的化学平衡常数表达式是_______ 。根据图1,用N2表示该反应达平衡过程中的平均反应速率是_______ 。
(2)该反应的正反应是_______ 反应(填“吸热”或“放热”)。图2中a、b、c三点对应的平衡常数Ka、Kb、Kc相对大小关系是_______ 。
(3)关于该可逆反应的说法正确的是_______ 。
a.加入催化剂可提高NO的平衡转化率
b.当体系中c(CO2):c(N2)=2:1时,该反应达到平衡状态
c.保持其他条件不变,若升高温度,正反应速率减小,逆反应速率增大
d.投料比:m1>m2>m3
II.某温度下,等物质的量的碘与环戊烯(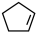 )在刚性容器内发生反应:
)在刚性容器内发生反应: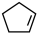 (g)+I2(g)⇌
(g)+I2(g)⇌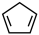 (g)+2HI(g) ΔH>0。
(g)+2HI(g) ΔH>0。
(4)起始的总压强为105Pa,平衡时总压强比起始时总压强增加了20%,则环戊烯的转化率为_______ ,该反应的平衡常数Kp=_______ Pa(平衡分压=总压×物质的量分数,结果保留三位有效数字)。
 ,
,
(1)该反应的化学平衡常数表达式是
(2)该反应的正反应是
(3)关于该可逆反应的说法正确的是
a.加入催化剂可提高NO的平衡转化率
b.当体系中c(CO2):c(N2)=2:1时,该反应达到平衡状态
c.保持其他条件不变,若升高温度,正反应速率减小,逆反应速率增大
d.投料比:m1>m2>m3
II.某温度下,等物质的量的碘与环戊烯(
 )在刚性容器内发生反应:
)在刚性容器内发生反应: (g)+I2(g)⇌
(g)+I2(g)⇌ (g)+2HI(g) ΔH>0。
(g)+2HI(g) ΔH>0。(4)起始的总压强为105Pa,平衡时总压强比起始时总压强增加了20%,则环戊烯的转化率为
您最近一年使用:0次
名校
6 . 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应: ,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
 ,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是| 编号 | 时间/min c(NH3)/(10-3mol/L) 表面积/cm2 | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 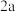 | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
A.相同条件下,增加 的浓度,反应速率增大 的浓度,反应速率增大 |
B.实验①,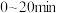 , ,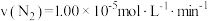 |
C.实验②, 时处于平衡状态, 时处于平衡状态, |
| D.相同条件下,增加催化剂的表面积,反应速率增大 |
您最近一年使用:0次
7 . 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①
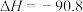 kJ⋅mol
kJ⋅mol
②
 kJ⋅mol
kJ⋅mol
③
 kJ⋅mol
kJ⋅mol
总反应: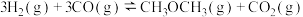 的
的
______ ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是______ (填字母代号)。
a.高温高压 b.加入催化剂 c.减少 的浓度 d.增加CO的浓度 e.分离出二甲醚
的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应② 某温度下的平衡常数为400。此温度下,在密闭容器中加入
某温度下的平衡常数为400。此温度下,在密闭容器中加入 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②若加入 后,经10 min反应达到平衡,此时
后,经10 min反应达到平衡,此时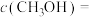
______ mol/L;该时间内反应速率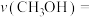
______ 。
(1)利用水煤气合成二甲醚的三步反应如下:
①

 kJ⋅mol
kJ⋅mol
②

 kJ⋅mol
kJ⋅mol
③

 kJ⋅mol
kJ⋅mol
总反应:
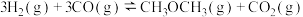 的
的
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
a.高温高压 b.加入催化剂 c.减少
 的浓度 d.增加CO的浓度 e.分离出二甲醚
的浓度 d.增加CO的浓度 e.分离出二甲醚(2)已知反应②
 某温度下的平衡常数为400。此温度下,在密闭容器中加入
某温度下的平衡常数为400。此温度下,在密闭容器中加入 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下:| 物质 |  |  |  |
浓度/(mol·L ) ) | 0.44 | 0.6 | 0.6 |

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②若加入
 后,经10 min反应达到平衡,此时
后,经10 min反应达到平衡,此时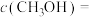
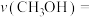
您最近一年使用:0次
名校
解题方法
8 . 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g) ΔH。不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是
N2O5(g)+O2(g) ΔH。不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是

 N2O5(g)+O2(g) ΔH。不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是
N2O5(g)+O2(g) ΔH。不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 2molNO2,1molO3 | 2molNO2,1molO3 | 2mol N2O5,1molO2 |
| 温度 | T1 | T2 | T2 |

| A.0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L﹣1•min﹣1 |
| B.T1<T2,ΔH>0 |
| C.平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) |
| D.T1℃时,若起始时间向容器甲中充入2molNO2、1molO3、2molN2O5和2molO2,则脱硝反应达到平衡前,v(正)<c(逆) |
您最近一年使用:0次
名校
9 . 回答下列问题。
(1)汽车行驶时, 和
和 在电火花作用下产生
在电火花作用下产生 ,各物质所含化学键键能数据如表:
,各物质所含化学键键能数据如表:

___________ 。
(2)肼 是一种可燃性液体,可作火箭燃料。在常温下,
是一种可燃性液体,可作火箭燃料。在常温下, 肼在氧气中完全燃烧生成氮气,放出QkJ的热量,写出
肼在氧气中完全燃烧生成氮气,放出QkJ的热量,写出 燃烧热的热化学方程式
燃烧热的热化学方程式___________ 。
(3)在一体积为 的容器中,通入一定量的
的容器中,通入一定量的 和
和 ,在
,在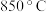 时发生如下反应:
时发生如下反应: ,
, 和
和 浓度变化如图:
浓度变化如图:

① 的平均反应速率
的平均反应速率
___________ ,该反应的化学平衡常数为___________ 。
②若在该条件下,向相同容器中充入 和
和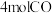 ,则达平衡时,
,则达平衡时, 的浓度为
的浓度为___________  。
。
(4)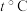 (高于
(高于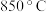 )时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表: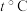 时物质浓度
时物质浓度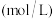 的变化
的变化
①表中 之间反应
之间反应___________ (填“正反应方向”,“逆反应方向”或“平衡”); 数值
数值___________ 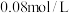 (填大于、小于或等于)。
(填大于、小于或等于)。
②反应在 ,平衡向逆反应方向移动,可能的原因是
,平衡向逆反应方向移动,可能的原因是___________ 。
A.减少 的浓度 B.使用催化剂 C.降温 D.增加氢气浓度
的浓度 B.使用催化剂 C.降温 D.增加氢气浓度
(1)汽车行驶时,
 和
和 在电火花作用下产生
在电火花作用下产生 ,各物质所含化学键键能数据如表:
,各物质所含化学键键能数据如表:| 物质 |  |  |  |
键能/ | 946 | 498 | 632 |

(2)肼
 是一种可燃性液体,可作火箭燃料。在常温下,
是一种可燃性液体,可作火箭燃料。在常温下, 肼在氧气中完全燃烧生成氮气,放出QkJ的热量,写出
肼在氧气中完全燃烧生成氮气,放出QkJ的热量,写出 燃烧热的热化学方程式
燃烧热的热化学方程式(3)在一体积为
 的容器中,通入一定量的
的容器中,通入一定量的 和
和 ,在
,在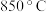 时发生如下反应:
时发生如下反应: ,
, 和
和 浓度变化如图:
浓度变化如图:
①
 的平均反应速率
的平均反应速率
②若在该条件下,向相同容器中充入
 和
和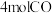 ,则达平衡时,
,则达平衡时, 的浓度为
的浓度为 。
。(4)
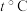 (高于
(高于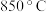 )时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表: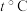 时物质浓度
时物质浓度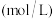 的变化
的变化| 时间(min) | 0 | 2 | 3 | 4 | 5 |
 | 0.200 | 0.138 |  |  | 0.116 |
 | 0.300 | 0.238 |  |  | 0.216 |
 | 0 | 0.062 | 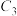 | 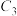 | 0.084 |
 | 0 | 0.062 | 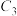 | 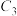 | 0.104 |
 之间反应
之间反应 数值
数值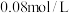 (填大于、小于或等于)。
(填大于、小于或等于)。②反应在
 ,平衡向逆反应方向移动,可能的原因是
,平衡向逆反应方向移动,可能的原因是A.减少
 的浓度 B.使用催化剂 C.降温 D.增加氢气浓度
的浓度 B.使用催化剂 C.降温 D.增加氢气浓度
您最近一年使用:0次
10 . 对含氮物质的研究和利用有着极为重要的意义。
(1) 、
、 和
和 相互之间可以发生化合反应,已知反应的热化学方程式如下:
相互之间可以发生化合反应,已知反应的热化学方程式如下:

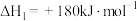 ,
, ;
;

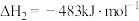 ,
, ;
;

 ,
,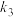 。
。
则氨的催化氧化反应 的
的
______ ,平衡常数为K=______ 。(用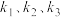 表示)。
表示)。
(2)汽车尾气净化的一个反应原理为: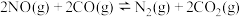
 .一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
.一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
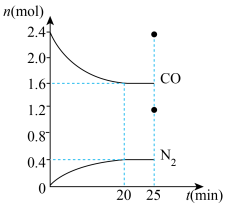
0~20min平均反应速率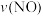 为
为______ 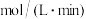 ;25min时,若保持反应温度不变,再向容器中充入CO、
;25min时,若保持反应温度不变,再向容器中充入CO、 各0.8mol,则
各0.8mol,则
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)合成氨反应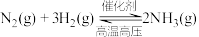 是目前最有效的工业固氮方法,解决数亿人口生存问题。在T℃、压强为
是目前最有效的工业固氮方法,解决数亿人口生存问题。在T℃、压强为 条件下,向一恒压密闭容器中通入
条件下,向一恒压密闭容器中通入 的混合气体,体系中各气体的含量与时间变化关系如图所示:
的混合气体,体系中各气体的含量与时间变化关系如图所示:

①以下叙述不能说明该条件下反应达到平衡状态的是______ (填字母)。
a.氨气的体积分数保持不变 b.容器中 保持不变
保持不变
c.气体平均相对分子质量保持不变 d.气体密度保持不变
e.
②若起始条件相同,在恒容容器中发生反应,则达到平衡时 的含量符合图中
的含量符合图中______ 点(填“a”、“b”、“c”、“d”、“e”、“f”或“g”)。
(4)25℃用甲酸吸收氨气可得到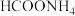 溶液。
溶液。
已知:25℃时甲酸的 ,
, 的
的 。
。
则反应 的平衡常数
的平衡常数
______ 。
(1)
 、
、 和
和 相互之间可以发生化合反应,已知反应的热化学方程式如下:
相互之间可以发生化合反应,已知反应的热化学方程式如下:
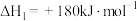 ,
, ;
;
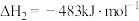 ,
, ;
;
 ,
,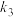 。
。则氨的催化氧化反应
 的
的
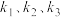 表示)。
表示)。(2)汽车尾气净化的一个反应原理为:
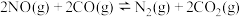
 .一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
.一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
0~20min平均反应速率
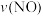 为
为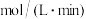 ;25min时,若保持反应温度不变,再向容器中充入CO、
;25min时,若保持反应温度不变,再向容器中充入CO、 各0.8mol,则
各0.8mol,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(3)合成氨反应
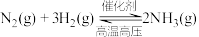 是目前最有效的工业固氮方法,解决数亿人口生存问题。在T℃、压强为
是目前最有效的工业固氮方法,解决数亿人口生存问题。在T℃、压强为 条件下,向一恒压密闭容器中通入
条件下,向一恒压密闭容器中通入 的混合气体,体系中各气体的含量与时间变化关系如图所示:
的混合气体,体系中各气体的含量与时间变化关系如图所示:
①以下叙述不能说明该条件下反应达到平衡状态的是
a.氨气的体积分数保持不变 b.容器中
 保持不变
保持不变c.气体平均相对分子质量保持不变 d.气体密度保持不变
e.

②若起始条件相同,在恒容容器中发生反应,则达到平衡时
 的含量符合图中
的含量符合图中(4)25℃用甲酸吸收氨气可得到
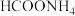 溶液。
溶液。已知:25℃时甲酸的
 ,
, 的
的 。
。则反应
 的平衡常数
的平衡常数
您最近一年使用:0次



