名校
解题方法
1 . 在2L密闭容器中进行反应: ,式中a、b、c、d为化学计量数。在
,式中a、b、c、d为化学计量数。在 内,各物质的物质的量(单位为mol)的变化如下表所示:
内,各物质的物质的量(单位为mol)的变化如下表所示:
已知2min内 ,
,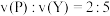 。
。
(1)起始时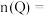
___________ ,2min末是否达到平衡___________ (填“是”或“否”)。
(2)上述反应的化学方程式为___________ 。
(3)下列各项为1min内各物质所表示的反应速率,其中最快的是___________ 。
a. b.
b. c.
c.
(4)用Y表示2min内的反应速率为___________ 。2min末,Q在混合气体中的体积分数为___________ 。
(5)在保持绝热和容积不变的情况下,下列关于上述反应的叙述不正确的是___________ 。
a.向容器内加入固体X,会使反应速率明显提高
b.向容器内充入稀有气体Ar(不参与反应),会导致体系压强增大,反应速率加快
c.随着反应的进行,混合气体的平均相对分子质量不再改变即说明反应已经达到平衡
d.随着反应的进行,混合气体的密度不再改变即说明反应已经达到平衡
e.随着反应的进行,混合气体的压强不再改变即说明反应已经达到平衡
 ,式中a、b、c、d为化学计量数。在
,式中a、b、c、d为化学计量数。在 内,各物质的物质的量(单位为mol)的变化如下表所示:
内,各物质的物质的量(单位为mol)的变化如下表所示:| 物质 时间 | X | Y | P | Q |
| 起始 | 0.5 | 2.2 | 1.0 | |
| 2min末 | 0.7 | 2.7 | 1.2 | |
| 3min末 | 0.8 |
 ,
,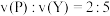 。
。(1)起始时
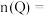
(2)上述反应的化学方程式为
(3)下列各项为1min内各物质所表示的反应速率,其中最快的是
a.
 b.
b. c.
c.
(4)用Y表示2min内的反应速率为
(5)在保持绝热和容积不变的情况下,下列关于上述反应的叙述不正确的是
a.向容器内加入固体X,会使反应速率明显提高
b.向容器内充入稀有气体Ar(不参与反应),会导致体系压强增大,反应速率加快
c.随着反应的进行,混合气体的平均相对分子质量不再改变即说明反应已经达到平衡
d.随着反应的进行,混合气体的密度不再改变即说明反应已经达到平衡
e.随着反应的进行,混合气体的压强不再改变即说明反应已经达到平衡
您最近一年使用:0次
名校
解题方法
2 . 甲醇(化学式: )是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
)是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知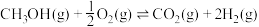 的能量变化如图所示,下列说法正确的是
的能量变化如图所示,下列说法正确的是___________ (填字母)。 转变成
转变成 的过程是一个吸收能量的过程
的过程是一个吸收能量的过程
b.化学变化不仅有新物质生成,同时也一定有能量变化
c. 的生成速率与
的生成速率与 的消耗速率之比为
的消耗速率之比为
d.1mol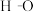 键断裂的同时2mol
键断裂的同时2mol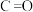 键断裂,则反应达最大限度
键断裂,则反应达最大限度
(2)某温度下,将5mol 和2mol
和2mol 充入2L的密闭容器中,经过4min反应达到平衡,测得
充入2L的密闭容器中,经过4min反应达到平衡,测得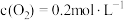 ,4min内平均反应速率
,4min内平均反应速率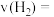
___________ ,则 的转化率为
的转化率为___________ 。
(3) 燃料电池是目前开发最成功的燃料电池之一,这种燃料电池如图所示,由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为
燃料电池是目前开发最成功的燃料电池之一,这种燃料电池如图所示,由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为___________ ,下列说法正确的是___________ (填序号)。
b.电池放电时,电解质溶液的碱性逐渐减弱
c.电池放电时每消耗6.4g 转移1.2mol电子
转移1.2mol电子
d.电池放电时 向a电极移动
向a电极移动
(4)科学家制造出了一种使用固体电解质的燃料电池,其效率很高,可用于航天航空。如图所示装置中,以稀土金属材料为惰性电极,在两极上分别加入甲醇和空气,其中固体电解质是掺杂了 的
的 固体,它在高温下能传导
固体,它在高温下能传导 。则c电极的名称为
。则c电极的名称为___________ (填“正极”或“负极”),d电极上的电极反应式为___________ 。
 )是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
)是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。(1)已知
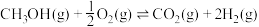 的能量变化如图所示,下列说法正确的是
的能量变化如图所示,下列说法正确的是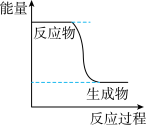
 转变成
转变成 的过程是一个吸收能量的过程
的过程是一个吸收能量的过程b.化学变化不仅有新物质生成,同时也一定有能量变化
c.
 的生成速率与
的生成速率与 的消耗速率之比为
的消耗速率之比为
d.1mol
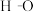 键断裂的同时2mol
键断裂的同时2mol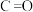 键断裂,则反应达最大限度
键断裂,则反应达最大限度(2)某温度下,将5mol
 和2mol
和2mol 充入2L的密闭容器中,经过4min反应达到平衡,测得
充入2L的密闭容器中,经过4min反应达到平衡,测得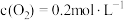 ,4min内平均反应速率
,4min内平均反应速率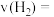
 的转化率为
的转化率为(3)
 燃料电池是目前开发最成功的燃料电池之一,这种燃料电池如图所示,由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为
燃料电池是目前开发最成功的燃料电池之一,这种燃料电池如图所示,由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为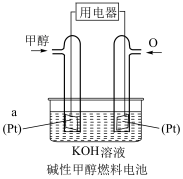
b.电池放电时,电解质溶液的碱性逐渐减弱
c.电池放电时每消耗6.4g
 转移1.2mol电子
转移1.2mol电子d.电池放电时
 向a电极移动
向a电极移动(4)科学家制造出了一种使用固体电解质的燃料电池,其效率很高,可用于航天航空。如图所示装置中,以稀土金属材料为惰性电极,在两极上分别加入甲醇和空气,其中固体电解质是掺杂了
 的
的 固体,它在高温下能传导
固体,它在高温下能传导 。则c电极的名称为
。则c电极的名称为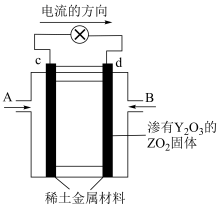
您最近一年使用:0次
名校
解题方法
3 . 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇: ,分别在300℃和500℃下生成甲醇的量如图所示。根据图像,计算在500℃时,从反应开始到平衡的氢气的平均反应速率为
,分别在300℃和500℃下生成甲醇的量如图所示。根据图像,计算在500℃时,从反应开始到平衡的氢气的平均反应速率为
 ,分别在300℃和500℃下生成甲醇的量如图所示。根据图像,计算在500℃时,从反应开始到平衡的氢气的平均反应速率为
,分别在300℃和500℃下生成甲醇的量如图所示。根据图像,计算在500℃时,从反应开始到平衡的氢气的平均反应速率为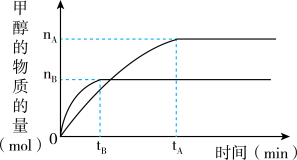
A.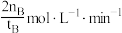 | B. | C. | D.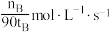 |
您最近一年使用:0次
解题方法
4 . A~D是四种烃分子的球棍模型(如图)___________ 。
(2)能使酸性高锰酸钾溶液褪色的物质是___________ (填序号)。
(3)B的结构简式___________ 。
(4)从下列各组物质中,找出合适的序号填在对应的空格内:
①甲烷和丙烷②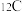 和
和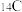 ③金刚石和石墨④H和D
③金刚石和石墨④H和D___________ (填序号,下同)。
(二)互为同分异构体的是___________ 。
(三)互为同系物的是___________ 。
(四)互为同素异形体的是___________ 。
(5)一定温度下,在体积为2 L的恒容密闭容器中充入1 mol N2和3 mol H2,一定条件下发生反应: ,测得其中N2的物质的量随时间的变化如图所示。
,测得其中N2的物质的量随时间的变化如图所示。___________ 。
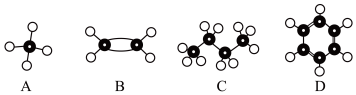
(2)能使酸性高锰酸钾溶液褪色的物质是
(3)B的结构简式
(4)从下列各组物质中,找出合适的序号填在对应的空格内:
①甲烷和丙烷②
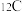 和
和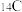 ③金刚石和石墨④H和D
③金刚石和石墨④H和D⑤异戊烷( )和新戊烷(
)和新戊烷(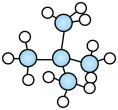 )⑥
)⑥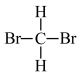 和
和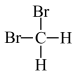
⑦正丁烷和异丁烷⑧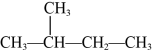 和
和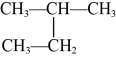 ⑨
⑨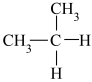 和
和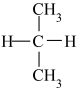
(二)互为同分异构体的是
(三)互为同系物的是
(四)互为同素异形体的是
(5)一定温度下,在体积为2 L的恒容密闭容器中充入1 mol N2和3 mol H2,一定条件下发生反应:
 ,测得其中N2的物质的量随时间的变化如图所示。
,测得其中N2的物质的量随时间的变化如图所示。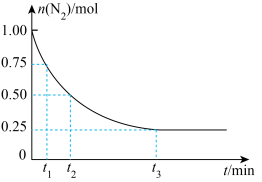
您最近一年使用:0次
名校
5 . 在起始温度均为T℃.容积均为 的密闭容器A(恒温)、B(绝热)中均加入
的密闭容器A(恒温)、B(绝热)中均加入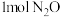 和
和 ,发生反应
,发生反应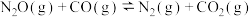
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数,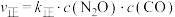 ,
,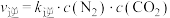 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。下列说法中错误的是
的转化率随时间的变化关系如图所示。下列说法中错误的是
 的密闭容器A(恒温)、B(绝热)中均加入
的密闭容器A(恒温)、B(绝热)中均加入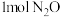 和
和 ,发生反应
,发生反应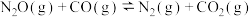
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数,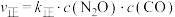 ,
,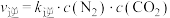 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。下列说法中错误的是
的转化率随时间的变化关系如图所示。下列说法中错误的是
A.曲线M、N的平衡常数大小为: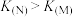 |
B. 与 与 浓度比为 浓度比为 且保持不变,不能说明反应达到平衡状态 且保持不变,不能说明反应达到平衡状态 |
C.T℃时,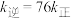 |
D.用CO的浓度变化表示曲线N在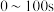 内的平均速率为 内的平均速率为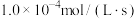 |
您最近一年使用:0次
名校
6 . 向两个锥形瓶中各加入0.048g镁条,塞紧橡胶塞,然后用注射器分别注入2 mL 2 mol⋅L 盐酸、2 mL 2 mol⋅L
盐酸、2 mL 2 mol⋅L 醋酸,测得锥形瓶内气体的压强随时间的变化如图所示,下列说法错误的是
醋酸,测得锥形瓶内气体的压强随时间的变化如图所示,下列说法错误的是
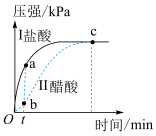
已知: 。
。
 盐酸、2 mL 2 mol⋅L
盐酸、2 mL 2 mol⋅L 醋酸,测得锥形瓶内气体的压强随时间的变化如图所示,下列说法错误的是
醋酸,测得锥形瓶内气体的压强随时间的变化如图所示,下列说法错误的是
已知:
 。
。A.0~t min内,反应速率 mol⋅L mol⋅L ⋅min ⋅min |
| B.溶液的pH:c>b |
C.反应结束后,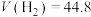 mL(标准状况下) mL(标准状况下) |
D.对于曲线Ⅱ,c点溶液中一定含有 、 、 、 、 和 和 |
您最近一年使用:0次
2024-01-19更新
|
52次组卷
|
2卷引用:辽宁省抚顺市六校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . 400℃时,向容积为2L的密闭容器中充入一定量的CO和 ,发生如下反应:
,发生如下反应: 。反应过程中测得的部分数据见下表:
。反应过程中测得的部分数据见下表:
下列说法中,正确的是
 ,发生如下反应:
,发生如下反应: 。反应过程中测得的部分数据见下表:
。反应过程中测得的部分数据见下表:
| 0 | 10 | 20 | 30 |
| 0.10 | 0.04 | 0.02 | |
| 0.20 | 0.04 |
A.反应在前10min内的平均速率为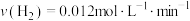 |
B.保持其他条件不变,再向平衡体系中同时通入物质的量均为0.08mol的CO、 和 和 ,则达到新平衡前 ,则达到新平衡前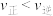 |
C.保持其他条件不变,升高温度,平衡时 ,则反应的 ,则反应的 |
D.保持其他条件不变,起始时向容器中充入0.05molCO和 ,达到平衡时, ,达到平衡时,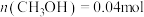 |
您最近一年使用:0次
名校
解题方法
8 . 汽车尾气是否为导致空气质量问题的主要原因,由此引发的“汽车限行”争议,是当前备受关注的社会性科学议题。
(1)我国学者结合实验与计算机模拟结果,研究了均相NO-CO的反应历程。此反应为 2CO(g) + 2NO(g) 2CO2(g) + N2(g) ∆H = -620.9kJ/mol,可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态、IM表示中间产物)。
2CO2(g) + N2(g) ∆H = -620.9kJ/mol,可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态、IM表示中间产物)。

三个基元反应中,属于放热反应的是___________ (填标号)
(2)探究温度、压强(2MPa,5MPa)对反应 2CO(g) + 2NO(g) 2CO2(g) + N2(g)的影响,如图所示,表示2MPa的是
2CO2(g) + N2(g)的影响,如图所示,表示2MPa的是___________ (填标号)。

(3)一定温度下,向一容积为2L的恒容密闭容器中充入4 mol CO和6 mol NO,发生上述反应,当反应达到平衡时,容器内压强变为起始时的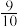 。
。
①判断该反应达到平衡状态的标志是___________ (填字母)。
a.CO、NO、CO2、N2浓度之比为2∶2∶2∶1
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.容器内混合气体的平均摩尔质量保持不变
e.CO2的生成速率和CO的生成速率相等
②CO的转化率为___________ 。此温度下该反应的平衡常数K=___________ L·mol 。
。
(4)用NH3可以消除NO污染 4NH3(g) + 6NO(g) 5N2(g) + 6H2O(l) ∆H<0
5N2(g) + 6H2O(l) ∆H<0
①某条件下该反应速率v正 = k正·c4(NH3)·c6(NO),v逆 = k逆·ca(N2)·cb(H2O),该反应的平衡常数 ,则a=
,则a=___________ ,b=___________ 。
②若在相同时间内测得NH3的转化率随温度的变化曲线如图,NH3的转化率在400℃~900℃之间下降由缓到急的原因是___________ 。

(1)我国学者结合实验与计算机模拟结果,研究了均相NO-CO的反应历程。此反应为 2CO(g) + 2NO(g)
 2CO2(g) + N2(g) ∆H = -620.9kJ/mol,可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态、IM表示中间产物)。
2CO2(g) + N2(g) ∆H = -620.9kJ/mol,可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态、IM表示中间产物)。
三个基元反应中,属于放热反应的是
(2)探究温度、压强(2MPa,5MPa)对反应 2CO(g) + 2NO(g)
 2CO2(g) + N2(g)的影响,如图所示,表示2MPa的是
2CO2(g) + N2(g)的影响,如图所示,表示2MPa的是
(3)一定温度下,向一容积为2L的恒容密闭容器中充入4 mol CO和6 mol NO,发生上述反应,当反应达到平衡时,容器内压强变为起始时的
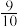 。
。①判断该反应达到平衡状态的标志是
a.CO、NO、CO2、N2浓度之比为2∶2∶2∶1
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.容器内混合气体的平均摩尔质量保持不变
e.CO2的生成速率和CO的生成速率相等
②CO的转化率为
 。
。(4)用NH3可以消除NO污染 4NH3(g) + 6NO(g)
 5N2(g) + 6H2O(l) ∆H<0
5N2(g) + 6H2O(l) ∆H<0①某条件下该反应速率v正 = k正·c4(NH3)·c6(NO),v逆 = k逆·ca(N2)·cb(H2O),该反应的平衡常数
 ,则a=
,则a=②若在相同时间内测得NH3的转化率随温度的变化曲线如图,NH3的转化率在400℃~900℃之间下降由缓到急的原因是

您最近一年使用:0次
名校
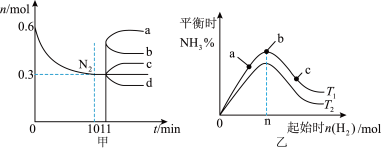
9 . 一定条件下,关于工业合成氨的反应, ,图甲表示1L密闭容器中
,图甲表示1L密闭容器中 随时间的变化曲线,图乙表示在恒温恒容下,初始投料0.6mol
随时间的变化曲线,图乙表示在恒温恒容下,初始投料0.6mol ,改变起始时
,改变起始时 对该平衡的影响。下列说法正确的是
对该平衡的影响。下列说法正确的是
 ,图甲表示1L密闭容器中
,图甲表示1L密闭容器中 随时间的变化曲线,图乙表示在恒温恒容下,初始投料0.6mol
随时间的变化曲线,图乙表示在恒温恒容下,初始投料0.6mol ,改变起始时
,改变起始时 对该平衡的影响。下列说法正确的是
对该平衡的影响。下列说法正确的是
A.甲:10min内该反应的平均速率 |
B.甲:从11min起其他条件不变,压缩容器体积,则 的变化曲线为b 的变化曲线为b |
C.乙:a、b、c三点所处的平衡状态中,b点 的转化率最高 的转化率最高 |
D.乙: |
您最近一年使用:0次
10 . 某温度下,在1L恒容密闭容器中投入20 X,发生反应
X,发生反应 ,有关数据如表所示,下列说法正确的是
,有关数据如表所示,下列说法正确的是
 X,发生反应
X,发生反应 ,有关数据如表所示,下列说法正确的是
,有关数据如表所示,下列说法正确的是时间段/s | 产物Z的平均生成速率/( |
0~10 | 0.4 |
0~20 | 0.3 |
0~30 | 0.2 |
A.5s时,Y的浓度为1 |
B.10s时,加入1 Z,此时 Z,此时 |
| C.25s时,X的转化率为45% |
D.30s时,加入1 Y和2 Y和2 Z,再次平衡时体系压强增大 Z,再次平衡时体系压强增大 |
您最近一年使用:0次



 )
)

