1 . Ⅰ.按要求回答下列问题:
(1)下列变化中属于吸热反应的是___________ 。
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化
④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应 ⑥ 与盐酸的反应
与盐酸的反应
(2)反应 在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是___________ 。
①增加 的量
的量
②将容器的体积缩小一半
③保持体积不变,充入 使体系压强增大
使体系压强增大
④保持压强不变,充入 使容器体积变大
使容器体积变大
Ⅱ.在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,一定条件下反应:
,一定条件下反应: ,测得
,测得 和
和 的浓度随时间变化如图:
的浓度随时间变化如图:
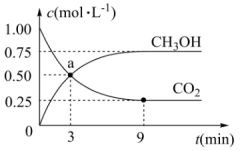
(3)从3min到9min,v(CO2)=___________ (结果保留两位有效数字);a点时v(正)___________ v(逆)(填>、<或=);
Ⅲ.某研究小组在实验室用硫化碱法制备 ,实验装置如图:
,实验装置如图:
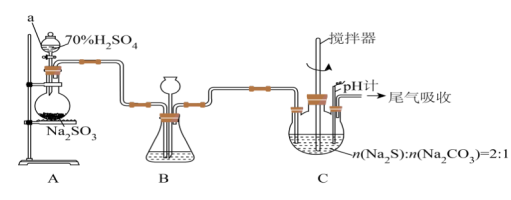
(4)装置 的作用是
的作用是___________ 。
(5)配制 溶液时,常加入少量
溶液时,常加入少量___________ 以防止出现浑浊和 的逸出。
的逸出。
(6)为了提高 的吸收效率,在不改变装置
的吸收效率,在不改变装置 中的溶液浓度、体积的条件下,还可采取的合理措施是
中的溶液浓度、体积的条件下,还可采取的合理措施是___________ (填序号)。
a.适当加快搅拌速率 b.加快 的流速 c.增大
的流速 c.增大 的接触面积
的接触面积
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化
④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应 ⑥
 与盐酸的反应
与盐酸的反应(2)反应
 在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是①增加
 的量
的量②将容器的体积缩小一半
③保持体积不变,充入
 使体系压强增大
使体系压强增大④保持压强不变,充入
 使容器体积变大
使容器体积变大Ⅱ.在体积为
 的密闭容器中,充入
的密闭容器中,充入 和
和 ,一定条件下反应:
,一定条件下反应: ,测得
,测得 和
和 的浓度随时间变化如图:
的浓度随时间变化如图:
(3)从3min到9min,v(CO2)=
Ⅲ.某研究小组在实验室用硫化碱法制备
 ,实验装置如图:
,实验装置如图:
(4)装置
 的作用是
的作用是(5)配制
 溶液时,常加入少量
溶液时,常加入少量 的逸出。
的逸出。(6)为了提高
 的吸收效率,在不改变装置
的吸收效率,在不改变装置 中的溶液浓度、体积的条件下,还可采取的合理措施是
中的溶液浓度、体积的条件下,还可采取的合理措施是a.适当加快搅拌速率 b.加快
 的流速 c.增大
的流速 c.增大 的接触面积
的接触面积
您最近一年使用:0次
2 . 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为_______ 。
(2)反应开始至2min,气体Y的平均反应速率是_______ 。
(3)该条件下,化学平衡常数K=_______ (只书写计算式)。
(4)若升高温度,化学平衡常数K值减小,则上述反应的正反应是_____ (填“吸热”或“放热”)反应。
(5)若上述反应在2min后的, 内反应速率与反应时间关系如图所示:
内反应速率与反应时间关系如图所示:

①下列时刻各改变一种不同的外界条件分别是:
_______ ,
_______ 。
②X的转化率最高的时间段_______ (填字母)。
A. B.
B. C.
C. D.
D.

(1)该反应的化学方程式为
(2)反应开始至2min,气体Y的平均反应速率是
(3)该条件下,化学平衡常数K=
(4)若升高温度,化学平衡常数K值减小,则上述反应的正反应是
(5)若上述反应在2min后的,
 内反应速率与反应时间关系如图所示:
内反应速率与反应时间关系如图所示:
①下列时刻各改变一种不同的外界条件分别是:


②X的转化率最高的时间段
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
3 . 一定温度下,在 的四氯化碳溶液(
的四氯化碳溶液( )中发生分解反应:
)中发生分解反应: 。不同时刻测量放出的
。不同时刻测量放出的 体积,换算成
体积,换算成 浓度如下表所示(
浓度如下表所示( 为阿伏加德罗常数的值):
为阿伏加德罗常数的值):
下列说法错误的是
 的四氯化碳溶液(
的四氯化碳溶液( )中发生分解反应:
)中发生分解反应: 。不同时刻测量放出的
。不同时刻测量放出的 体积,换算成
体积,换算成 浓度如下表所示(
浓度如下表所示( 为阿伏加德罗常数的值):
为阿伏加德罗常数的值):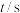 | 0 | 600 | 1200 | 1710 | 2220 | 2820 |
 | 1.40 | 0.96 | 0.66 | 0.48 | 0.35 | 0.24 |
| A.N、O均位于周期表中的p区 |
B.生成 时,转移电子的数目为 时,转移电子的数目为 |
C.反应 时,生成 时,生成 体积为 体积为 (标准状况) (标准状况) |
D.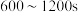 ,生成 ,生成 的平均速率为 的平均速率为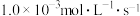 |
您最近一年使用:0次
解题方法
4 . 温度为 时,将1.6mol气体X和1.6mol气体Y充入10L恒容密闭容器中,发生反应
时,将1.6mol气体X和1.6mol气体Y充入10L恒容密闭容器中,发生反应 ,一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
,一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
 时,将1.6mol气体X和1.6mol气体Y充入10L恒容密闭容器中,发生反应
时,将1.6mol气体X和1.6mol气体Y充入10L恒容密闭容器中,发生反应 ,一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
,一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是 | 2 | 4 | 7 | 9 |
 | 1.2 | 1.1 | 1.0 | 1.0 |
A. 内的平均反应速率 内的平均反应速率 |
B. 时,反应的平衡常数 时,反应的平衡常数 |
C.其他条件不变,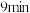 后,向容器中再充入 后,向容器中再充入 ,平衡向正反应方向移动,与改变条件前相比再次达到平衡时X的浓度减小,Y的转化率增大 ,平衡向正反应方向移动,与改变条件前相比再次达到平衡时X的浓度减小,Y的转化率增大 |
D.其他条件不变,降温到 达到化学平衡时,平衡常数 达到化学平衡时,平衡常数 ,则该反应为放热反应 ,则该反应为放热反应 |
您最近一年使用:0次
名校
解题方法
5 . 一定温度下,在2L的密闭容器中发生如下反应:
 ,B、C的物质的量随时间变化的关系如图1,达平衡后在
,B、C的物质的量随时间变化的关系如图1,达平衡后在 、
、 、
、 、
、 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
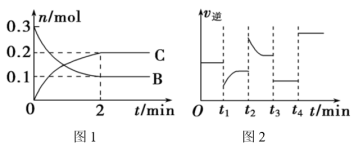
下列说法正确的是

 ,B、C的物质的量随时间变化的关系如图1,达平衡后在
,B、C的物质的量随时间变化的关系如图1,达平衡后在 、
、 、
、 、
、 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
下列说法正确的是
A. ,反应开始至2min内, ,反应开始至2min内,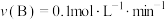 |
B. 时改变的条件是降温,平衡逆向移动 时改变的条件是降温,平衡逆向移动 |
C. 时改变的条件可能是减小 时改变的条件可能是减小 ,平衡正向移动 ,平衡正向移动 |
D. 时可能是减小压强,平衡不移动, 时可能是减小压强,平衡不移动, 时可能是使用催化剂, 时可能是使用催化剂,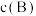 不变 不变 |
您最近一年使用:0次
名校
解题方法
6 . 乙烯的产量是衡量一个国家石油化工发展水平的标志,近几年各国都加大了乙烯制备的研发力度。回答下列问题:
(1)乙烷分解法
已知CO的燃烧热为 。以
。以 和
和 为原料可以协同制取
为原料可以协同制取 和CO,发生的反应如下:
和CO,发生的反应如下:
反应1: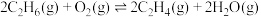
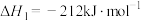
反应2:

① 的
的
_____  。
。
②恒温条件下,下列能够提高反应 中乙烯产率的措施有
中乙烯产率的措施有______ (填标号)。
A.保持体积不变,通入氮气 B.保持压强不变,通入乙烷
C.保持体积不变,通入乙烷 D.及时分离出氢气
③恒温恒压(100kPa)下,在密闭容器中通入乙烷和稀有气体,平衡时各组分的体积分数分别为:乙烷5%、氢气20%、乙烯20%。该温度下反应 的平衡常数
的平衡常数
_____ kPa(用物质的平衡分压代替平衡浓度,平衡分压=总压强×体积分数)。
(2)二氧化碳转化法反应原理为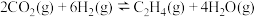 。在体积固定的密闭容器中,加入一定量的
。在体积固定的密闭容器中,加入一定量的 、
、 和催化剂,一段时间内测得二氧化碳的浓度变化如图1所示。在相同时间段内,测得乙烯的体积分数随温度变化如图2所示。
和催化剂,一段时间内测得二氧化碳的浓度变化如图1所示。在相同时间段内,测得乙烯的体积分数随温度变化如图2所示。
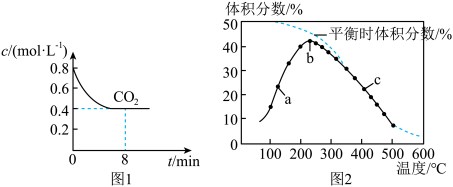
①由图1可知,0~8min用乙烯表示的平均反应速率为______  。
。
②图2中,a、b、c三点表示的化学平衡常数由大到小的顺序为______ ;b点的反应速率
___  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
③b点后乙烯的体积分数随温度升高逐渐减小的原因可能是_______ 、_______ (任写两条)。
④实验测定,反应中,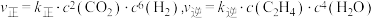 (
( 、
、 为速率常数,只与温度有关),精确实验表明,达到平衡时
为速率常数,只与温度有关),精确实验表明,达到平衡时 的值为
的值为 的2倍,则该反应的平衡常数
的2倍,则该反应的平衡常数
_______ 。
(1)乙烷分解法
已知CO的燃烧热为
 。以
。以 和
和 为原料可以协同制取
为原料可以协同制取 和CO,发生的反应如下:
和CO,发生的反应如下:反应1:
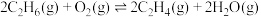
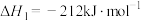
反应2:


①
 的
的
 。
。②恒温条件下,下列能够提高反应
 中乙烯产率的措施有
中乙烯产率的措施有A.保持体积不变,通入氮气 B.保持压强不变,通入乙烷
C.保持体积不变,通入乙烷 D.及时分离出氢气
③恒温恒压(100kPa)下,在密闭容器中通入乙烷和稀有气体,平衡时各组分的体积分数分别为:乙烷5%、氢气20%、乙烯20%。该温度下反应
 的平衡常数
的平衡常数
(2)二氧化碳转化法反应原理为
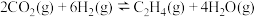 。在体积固定的密闭容器中,加入一定量的
。在体积固定的密闭容器中,加入一定量的 、
、 和催化剂,一段时间内测得二氧化碳的浓度变化如图1所示。在相同时间段内,测得乙烯的体积分数随温度变化如图2所示。
和催化剂,一段时间内测得二氧化碳的浓度变化如图1所示。在相同时间段内,测得乙烯的体积分数随温度变化如图2所示。
①由图1可知,0~8min用乙烯表示的平均反应速率为
 。
。②图2中,a、b、c三点表示的化学平衡常数由大到小的顺序为

 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。③b点后乙烯的体积分数随温度升高逐渐减小的原因可能是
④实验测定,反应中,
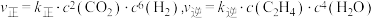 (
( 、
、 为速率常数,只与温度有关),精确实验表明,达到平衡时
为速率常数,只与温度有关),精确实验表明,达到平衡时 的值为
的值为 的2倍,则该反应的平衡常数
的2倍,则该反应的平衡常数
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
(1)硫代硫酸钠与稀硫酸反应的化学方程式为 ___________ 。
(2)该反应速率的快慢可通过观察___________ 来判断。
(3)计算实验①中ν(Na2S2O3)=___________
(4)该实验中此V1是___________ 。实验①、③可探究___________ 对反应速率的影响,因此V3是___________ 。
Ⅱ.在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:2X (g)+Y(g) 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4,10min反应达平衡。
2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4,10min反应达平衡。
(5)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为___________ ;平衡时,气体的总物质的量是___________ ;X的转化率为___________ ;
(6)若保持恒温恒容,起始物质的量相同,则平衡后,Z的体积分数为___________ 0.4,达平衡的时间___________ 10min。(填“>”“<”或“=”)
| 实验序号 | 反应温度 | Na2S2O3浓度 | 稀硫酸 | H2O | 反应结束时间 | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | min | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 | t1 |
| ② | 40 | V1 | 0.10 | 10.0 | 0.50 | V2 | t2 |
| ③ | 20 | 10.0 | 0.10 | 4.0 | 0.50 | V3 | t3 |
(2)该反应速率的快慢可通过观察
(3)计算实验①中ν(Na2S2O3)=
(4)该实验中此V1是
Ⅱ.在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:2X (g)+Y(g)
 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4,10min反应达平衡。
2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4,10min反应达平衡。(5)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为
(6)若保持恒温恒容,起始物质的量相同,则平衡后,Z的体积分数为
您最近一年使用:0次
8 . 丙烯是三大合成材料的基本原料之一,其中生产聚丙烯时丙烯用量最大。另外,丙烯还可用于生产多种重要有机化工原料。由丙烷( )制丙烯(
)制丙烯( )的两种方法如下:
)的两种方法如下:
Ⅰ.丙烷催化脱氢法:

Ⅱ.丙烷催化氧化法:
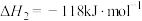
请回答下列问题:
(1)已知
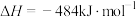 ,由此计算
,由此计算
____  。
。
(2) 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 ,加入催化剂发生催化脱氢反应。体系内压强变化如表所示。
,加入催化剂发生催化脱氢反应。体系内压强变化如表所示。
①下列能说明该反应达到平衡状态的是_____ (填标号)。
a.丙烷的消耗速率等于丙烯的生成速率 b.容器内气体的密度不再发生变化
c.容器内的压强不再发生变化 d.容器内气体平均相对分子质量不再变化
② 内,用
内,用 表示该反应的反应速率为
表示该反应的反应速率为______ mol·L-1·min-1。
③ 的平衡转化率为
的平衡转化率为______ ,该反应的平衡常数
____  (
( 为以分压表示的平衡常数,分压
为以分压表示的平衡常数,分压 总压×物质的量分数,保留2位小数)。
总压×物质的量分数,保留2位小数)。
 )制丙烯(
)制丙烯( )的两种方法如下:
)的两种方法如下:Ⅰ.丙烷催化脱氢法:


Ⅱ.丙烷催化氧化法:

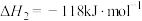
请回答下列问题:
(1)已知

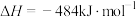 ,由此计算
,由此计算
 。
。(2)
 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 ,加入催化剂发生催化脱氢反应。体系内压强变化如表所示。
,加入催化剂发生催化脱氢反应。体系内压强变化如表所示。| 时间/min | 0 | 1 | 3 | 5 | 7 |
| 压强 /kPa |  |  |  |  |  |
a.丙烷的消耗速率等于丙烯的生成速率 b.容器内气体的密度不再发生变化
c.容器内的压强不再发生变化 d.容器内气体平均相对分子质量不再变化
②
 内,用
内,用 表示该反应的反应速率为
表示该反应的反应速率为③
 的平衡转化率为
的平衡转化率为
 (
( 为以分压表示的平衡常数,分压
为以分压表示的平衡常数,分压 总压×物质的量分数,保留2位小数)。
总压×物质的量分数,保留2位小数)。
您最近一年使用:0次
9 . 用煤炭制得的焦炭在工业上是重要的还原剂和燃料,用于许多物质的例备,如工业上用焦炭与硫酸钠反应制备硫化钠。反应方程式如下:Na2SO4+2C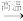 Na2S+CO2↑
Na2S+CO2↑
完成下列填空:
(1)上述反应的元素中,原子半径最小的元素的原子的核外电子排布式为___________ ,其最外层电子有 ___________ 种不同的能量,有 ___________ 种不同的运动状态。
(2)下列可以证明二氧化碳是非极性分子的事实是___________ (填编号)。
a.二氧化碳密度比空气大
b.二氧化碳能溶于水
c.液态二氧化碳在电场中通过不偏向
d.二氧化碳常温常压下为气态
(3)判断C、S两种元素非金属性的强弱,并写出一个能支持你的结论的实验事实___________ ,
(4)工业上利用焦炭与高温水蒸气反应制备水煤气,下面是水煤气反应的方程式:C(s)+H2O(g) CO(g)+H2(g)-Q(Q<0),写出上述反应的平衡常数表达式
CO(g)+H2(g)-Q(Q<0),写出上述反应的平衡常数表达式 ___________ ,增大该反应平衡常数的措施有 ___________ (填编号)
A.升温 B.增加水蒸气的浓度 C.减压 D.增加焦炭的量
(5)在一个2L的容器中进行该反应的实验,若混合气体的密度不变,(填“能”或“不能”)___________ 判断该反应已经达到平衡状态。若初始加入的C为16.8g,10min后为7.2g,则v(H2)=___________ 。
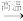 Na2S+CO2↑
Na2S+CO2↑完成下列填空:
(1)上述反应的元素中,原子半径最小的元素的原子的核外电子排布式为
(2)下列可以证明二氧化碳是非极性分子的事实是
a.二氧化碳密度比空气大
b.二氧化碳能溶于水
c.液态二氧化碳在电场中通过不偏向
d.二氧化碳常温常压下为气态
(3)判断C、S两种元素非金属性的强弱,并写出一个能支持你的结论的实验事实
(4)工业上利用焦炭与高温水蒸气反应制备水煤气,下面是水煤气反应的方程式:C(s)+H2O(g)
 CO(g)+H2(g)-Q(Q<0),写出上述反应的平衡常数表达式
CO(g)+H2(g)-Q(Q<0),写出上述反应的平衡常数表达式 A.升温 B.增加水蒸气的浓度 C.减压 D.增加焦炭的量
(5)在一个2L的容器中进行该反应的实验,若混合气体的密度不变,(填“能”或“不能”)
您最近一年使用:0次
名校
解题方法
10 . 亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)⇌2NOCl(g)。
(1)在1L恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:___________ mol·L-1·min-1。
②T2时该反应的平衡常数K=___________ 。
③T2时Cl2的平衡转化率为___________ 。
(2)若按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图B所示:___________ (填“>”“<”或“=”)0。
②在p压强条件下,M点时容器内NO的体积分数为___________ 。
③若反应一直保持在p压强条件下进行,则M点的压强平衡常数Kp=___________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(1)在1L恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:
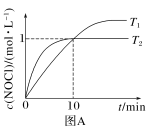
②T2时该反应的平衡常数K=
③T2时Cl2的平衡转化率为
(2)若按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图B所示:
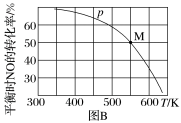
②在p压强条件下,M点时容器内NO的体积分数为
③若反应一直保持在p压强条件下进行,则M点的压强平衡常数Kp=
您最近一年使用:0次



