解题方法
1 . 碳达峰、碳中和是现在需要继续完成的环保任务,CO2的综合利用成为热点研究对象,CO2作为碳源加氢是再生能源的有效方法,CO2加氢可以合成甲醇,0lah 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过CO2加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
反应Ⅰ: CO2 (g)+ H2(g) CO(g) +H2O(g) ΔH1
CO(g) +H2O(g) ΔH1
反应Ⅱ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1
(1)①相关键能如下表,则ΔH1=_______ ,该反应的活化能Ea(正)_______ Ea(逆)(填“大于”“小于”或“等于”)。
②若K1、K2分别表示反应Ⅰ、反应Ⅱ的平衡常数。则CO(g) +2H2(g)  CH3OH(g) 的平衡常数K=
CH3OH(g) 的平衡常数K=_______ (用含K1、K2的代数式表示)。
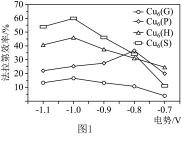
(2)据文献报道,Cu基纳米材料作为高性能催化剂可将CO2电还原为高能量密度的CH3OH,不同催化剂对生成CH3OH的法拉第效率与电极电势的变化如图1所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是________ 。
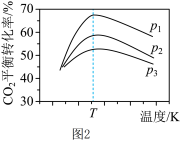
(3)在催化剂作用下,发生上述反应Ⅰ、Ⅱ, 达平衡时CO2的转化率随温度和压强的变化如图2,判断P1、P2、P3的大小关系:_______ ,解释压强一定时,CO2的平衡转化率呈现如图变化的原因:______ 。
(4)某温度下,初始压强为10MPa,向容积为2L的恒容密闭容器中充入2 mol CO2、3 mol H2发生反应Ⅰ、Ⅱ,平衡时CO2的转化率是50%,体系内剩余1 mol H2,反应Ⅱ的Kp=_______ 。
反应Ⅰ: CO2 (g)+ H2(g)
 CO(g) +H2O(g) ΔH1
CO(g) +H2O(g) ΔH1反应Ⅱ: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1(1)①相关键能如下表,则ΔH1=
| 化学键 | H-H | C≡ O | O-H | C=O |
| 键能/ (kJ·mol-1) | 436 | 1071 | 464 | 803 |
 CH3OH(g) 的平衡常数K=
CH3OH(g) 的平衡常数K=(2)据文献报道,Cu基纳米材料作为高性能催化剂可将CO2电还原为高能量密度的CH3OH,不同催化剂对生成CH3OH的法拉第效率与电极电势的变化如图1所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是

(3)在催化剂作用下,发生上述反应Ⅰ、Ⅱ, 达平衡时CO2的转化率随温度和压强的变化如图2,判断P1、P2、P3的大小关系:

(4)某温度下,初始压强为10MPa,向容积为2L的恒容密闭容器中充入2 mol CO2、3 mol H2发生反应Ⅰ、Ⅱ,平衡时CO2的转化率是50%,体系内剩余1 mol H2,反应Ⅱ的Kp=
您最近一年使用:0次
名校
解题方法
2 . 为保护环境,充分利用钴资源,一种以废旧钴酸锂电池材料(正极材料主要含有LiCoO2、铝箔及金属钢壳)回收钴酸锂的工艺流程如下:
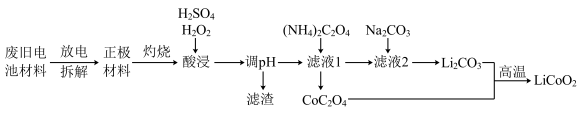
已知一定条件下,部分金属阳离子形成氢氧化物的pH如下表:
请回答下列问题:
(1)废旧钴酸锂电池需经放电、拆解、粉碎预处理。放电方式为电化学放电,可以将废旧电池浸泡在_________ (填标号)中进行放电。粉碎的目的是_________ 。
A. Na2SO4溶液
B.98%的H2SO4溶液
C.酒精
(2)“酸浸”过程中,除加入H2SO4,还要加入H2O2。
①H2O2的作用是_________ (填标号)。
A.做氧化剂
B.做还原剂
C.既做氧化剂又做还原剂
②H2O2促进了LiCoO2在H2SO4中转化为CoSO4,该反应的离子方程式为_________ 。
③相同条件下,“酸浸”时钴的浸出率随温度变化如右图所示,此时温度控制在80°C左右的原因为_________ 。

(3)“调pH”时,溶液应控制的pH范围为_________ ,选用的最佳试剂是_________ (填标号)。
A. H2SO4 B. CoCO3 C.石灰乳 D. NaOH
(4)高温时,CoC2O4和Li2CO3生成LiCoO2的同时放出CO2。此反应的化学方程式为_________ 。

已知一定条件下,部分金属阳离子形成氢氧化物的pH如下表:
| 离子 | Co3+ | Fe3+ | Co2+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 0.3 | 2.7 | 7.2 | 7.6 | 3.6 |
| 完全沉淀的pH | 1.1 | 3.2 | 9.2 | 9.6 | 5.2 |
(1)废旧钴酸锂电池需经放电、拆解、粉碎预处理。放电方式为电化学放电,可以将废旧电池浸泡在
A. Na2SO4溶液
B.98%的H2SO4溶液
C.酒精
(2)“酸浸”过程中,除加入H2SO4,还要加入H2O2。
①H2O2的作用是
A.做氧化剂
B.做还原剂
C.既做氧化剂又做还原剂
②H2O2促进了LiCoO2在H2SO4中转化为CoSO4,该反应的离子方程式为
③相同条件下,“酸浸”时钴的浸出率随温度变化如右图所示,此时温度控制在80°C左右的原因为

(3)“调pH”时,溶液应控制的pH范围为
A. H2SO4 B. CoCO3 C.石灰乳 D. NaOH
(4)高温时,CoC2O4和Li2CO3生成LiCoO2的同时放出CO2。此反应的化学方程式为
您最近一年使用:0次
2023-03-29更新
|
334次组卷
|
2卷引用:宁夏平罗中学2022-2023学年高二下学期期中考试化学试题(重点班)
2022高三·全国·专题练习
真题
名校
3 . 某兴趣小组设计实验探究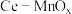 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: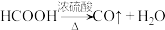

(1)装置A中盛放甲酸的仪器的名称是_______ 。
(2)从B、C、D中选择合适的装置收集 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______ 。
步骤Ⅲ 探究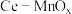 催化空气氧化
催化空气氧化 的效率
的效率
将一定量 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: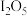 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: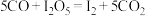 )
)
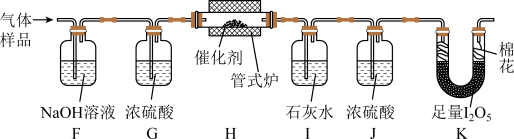
(4)通入 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了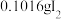 。
。
①能证明 被空气氧化的现象是
被空气氧化的现象是_______ ;
② 被催化氧化的百分率为
被催化氧化的百分率为_______ ;
③若未通入氮气,②的结果将_______ (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______ 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______ 。
 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:步骤Ⅰ 制备

在通风橱中用下图装置制备
 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: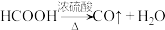

(1)装置A中盛放甲酸的仪器的名称是
(2)从B、C、D中选择合适的装置收集
 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。步骤Ⅱ 检验

将
 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。(3)该反应的化学方程式为
步骤Ⅲ 探究
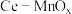 催化空气氧化
催化空气氧化 的效率
的效率将一定量
 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: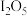 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: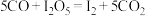 )
)
(4)通入
 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了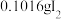 。
。①能证明
 被空气氧化的现象是
被空气氧化的现象是②
 被催化氧化的百分率为
被催化氧化的百分率为③若未通入氮气,②的结果将
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用
(6)步骤Ⅲ装置存在的不足之处是
您最近一年使用:0次
2023-02-20更新
|
6816次组卷
|
15卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学
宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编2022年福建省高考真题化学试题(已下线)2022年福建省高考真题变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(实验探究题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省新泰市第一中学(弘文部)2023-2024学年高三上学期第二次月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷
名校
解题方法
4 . I.氮及其化合物的转化过程如下图所示,其中下图为反应①过程中能量变化的曲线图。
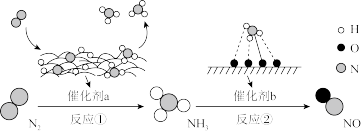
(1)下图中曲线_______ (填字母)是加入催化剂a时的能量变化曲线,该反应破坏生成物全部化学键所需要的总能量_______ (填“大于”或“小于”或“等于”)破坏反应物全部化学键所需要的总能量。
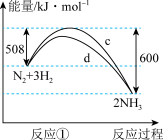
(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为_____ 。
(3)下列说法正确的是_______。
II.某同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
(4)求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率_______ 。(设溶液体积不变)
(5)有同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给予分析:构成的原电池中负极反应式为_______ ;溶液中H+移向_______ 极(填“正“或“负")。
III.某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。
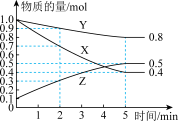
(6)写出该反应的化学方程式_______ 。
(7)在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是_______。
(8)该反应达平衡时,X的转化率为_______ 。

(1)下图中曲线

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为
(3)下列说法正确的是_______。
| A.合成氨在工业生产中常将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.工业合成氨中,为加快化学反应速率,压强和温度越高越好 |
| C.合成氨工业要用合适的催化剂,目的是降低该反应的活化能 |
| D.工业合成氨中反应物不能百分之百转化为生成物 |
II.某同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 190 | 414 | 526 | 570 |
(5)有同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给予分析:构成的原电池中负极反应式为
III.某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。

(6)写出该反应的化学方程式
(7)在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是_______。
| A.X、Y、Z的浓度相等 | B.容器内气体压强保持不变 |
| C.X、Y的反应速率比为3∶1 | D.生成1molY的同时生成2molZ |
您最近一年使用:0次
名校
5 . 某小组对一定条件下的反应2SO2(g)+O2(g) 2SO3(g) ΔH=-197.7 kJ/mol进行研究。
2SO3(g) ΔH=-197.7 kJ/mol进行研究。
(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是_______ (填标号)。
A.v(SO2)=2v(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
E.O2的分压保持不变
F.气体的密度保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
①表中a=_______ ,b=_______ ,甲组实验在该条件下的平衡常数K=_______ 。
②在相同条件下,若将甲组实验按1molSO2、0.5molO2、2molSO3进行投料,则反应开始时v正_______ v逆(填“>”“=”或“<”),平衡时SO3的百分含量与原甲组实验相比_______ (填“变大”“变小”或“不变”)。
③为加快乙组实验的反应速率,下列措施可行的是_______ (填标号)。
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为恒温恒压容器,则b值_______ (填“变大”“变小”或“不变”)。
 2SO3(g) ΔH=-197.7 kJ/mol进行研究。
2SO3(g) ΔH=-197.7 kJ/mol进行研究。(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是
A.v(SO2)=2v(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
E.O2的分压保持不变
F.气体的密度保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
| 实验分组 | 甲组 | 乙组 |
| 反应物 | 2molSO2、1molO2 | 2molSO3 |
| 反应热量 | 放热158.16kJ | 吸热bkJ |
| 反应物的平衡转化率 | a |
②在相同条件下,若将甲组实验按1molSO2、0.5molO2、2molSO3进行投料,则反应开始时v正
③为加快乙组实验的反应速率,下列措施可行的是
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为恒温恒压容器,则b值
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)我校化学社团做了如下探究实验:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验数据如表所示:
①写出该反应的离子方程式:_______ 。
②通过实验A、B可探究_______ (填外部因素)的改变对反应速率的影响,其中V1=_______ ;通过实验_______ (填实验序号)可探究温度变化对化学反应速率的影响。
③利用实验B中数据计算,用KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=_______ 。
④实验中发现:反应一段时间后该反应速率会突然加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______ ,相应的粒子最有可能是_______ 。
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
①表中a=_______ ,b=_______ 。
②能验证温度对化学反应速率影响规律的是实验_______ (填实验编号)。
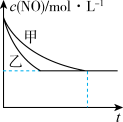
③实验I和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的是曲线_______ (填“甲”或“乙”)。
(1)我校化学社团做了如下探究实验:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验数据如表所示:
| 实验 序号 | 实验温度/K | KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | 溶液颜色褪至无色时所需时间/s | ||
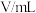 |  | 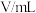 |  | 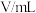 | |||
| A | 293 | 2 | 0.02 | 5 | 0.1 | 3 |  |
| B | 293 | 2 | 0.02 | 3 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 5 |  |
②通过实验A、B可探究
③利用实验B中数据计算,用KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=
④实验中发现:反应一段时间后该反应速率会突然加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO
 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。实验 编号 | t/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2/g |
| I | 280 | 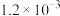 | 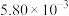 | 82 |
| II | 280 | 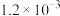 | b | 124 |
| Ⅲ | 350 | a | 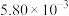 | 82 |
②能验证温度对化学反应速率影响规律的是实验
③实验I和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的是曲线

您最近一年使用:0次
名校
解题方法
7 . 某同学探究外界条件对H2O2分解速率的影响实验所用试剂:0.4mol·L-1H2O2溶液、蒸馏水、MnO2粉末、Fe2O3粉。
(1)实验1、2的目的是其他条件相同时,研究___________ 对H2O2分解速率的影响。
(2)表中a处所用试剂为___________ 。对比实验3、4可得出的结论是___________ 。
(3)实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用10mL0.4mol·L-1H2O2溶液,还应添加的试剂及用量为___________ 。
(4)控制其他条件相同,印刷电路板的金属粉末用0.4mol·L-1H2O2溶液和3.0mol·L-1 H2SO4溶液处理。
①请配平方程式:___________
___________Cu+___________H2O2+___________H+=___________Cu2++___________H2O
②某同学在不同温度下完成该实验,测得铜的平均溶解速率分别为:
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:___________ 。
实验序号 | H2O2浓度(mol·L-1) | v(H2O2溶液)(mL) | 温度 | 催化剂 | 收集112mLO2所需时间(s) |
1 | 0.4 | 20 | 室温 | 无 | 几乎无气体产生 |
2 | 0.4 | 20 | 50℃水浴 | 无 | 296 |
3 | 0.4 | 20 | 室温 | 0.5g a | 45 |
4 | 0.4 | 20 | 室温 | 0.5gMnO2粉末 | 100 |
5 | 0.4 | b | 室温 | a | >45 |
(2)表中a处所用试剂为
(3)实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用10mL0.4mol·L-1H2O2溶液,还应添加的试剂及用量为
(4)控制其他条件相同,印刷电路板的金属粉末用0.4mol·L-1H2O2溶液和3.0mol·L-1 H2SO4溶液处理。
①请配平方程式:
___________Cu+___________H2O2+___________H+=___________Cu2++___________H2O
②某同学在不同温度下完成该实验,测得铜的平均溶解速率分别为:
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率( | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
您最近一年使用:0次
2021-12-02更新
|
184次组卷
|
7卷引用:宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题
宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题北京市丰台区2020-2021学年高一下学期期中联考化学(A卷)试题(已下线)作业03 化学反应速率-2021年高二化学暑假作业(人教版2019)(已下线)2.2 影响化学反应速率的因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.1.2 影响化学反应速率的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)安徽省黄山市屯溪第一中学2022-2023学年高二上学期期中质量检测(选择性考试) 化学试题
名校
8 . T℃时,A气体与C气体反应生成B气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。由以上条件,回答下列问题:
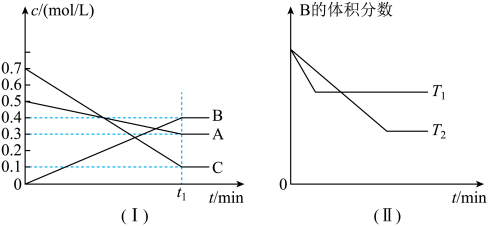
(1)该反应的化学方程式为_______
(2)T1_______ T2(大于,小于,等于),该反应为_______ (填“吸热”或“放热”)反应
(3)该反应的平衡常数的数值为(保留一位小数)_______ ;
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有_______(填字母)
(5)已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g)=CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
求反应②的ΔH2=_______ kJ/mol

(1)该反应的化学方程式为
(2)T1
(3)该反应的平衡常数的数值为(保留一位小数)
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有_______(填字母)
| A.保持其他条件不变,增大压强 | B.保持容器总体积不变,通入少量稀有气体 |
| C.保持其他条件不变,升高温度 | D.保持其他条件不变,降低温度 |
反应①:CO(g)+2H2(g)=CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
求反应②的ΔH2=
您最近一年使用:0次
解题方法
9 . 用软锰矿(主要成分为MnO2,所含杂质为质量分数约8%Fe3O4和约5%Al2O3)和BaS制备高纯MnCO3,同时制得Ba(OH)2,工艺流程如下:
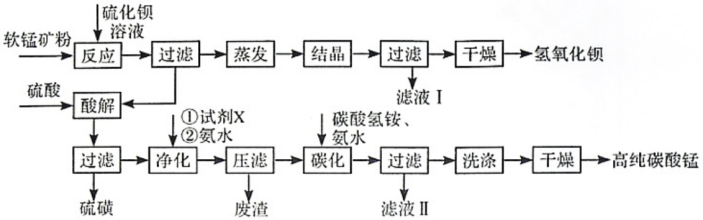
已知:25℃时相关物质的Ksp见下表
回答下列问题:
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为___________ ,能否通过加热的方式加快该反应的速率,___________ (填“能”或“否”)
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是___________ 。
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为___________ 。
(4)净化时需先加入的试剂X为___________ (填化学式) 。再使用氨水调溶液的pH,则pH的理论最小值为___________ (当溶液中某离子浓度小于1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为___________ 。

已知:25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为
(4)净化时需先加入的试剂X为
(5)碳化过程中发生反应的离子方程式为
您最近一年使用:0次
2021-03-14更新
|
445次组卷
|
3卷引用:宁夏石嘴山市2021届高三下学期3月高考质量监测(一模) 化学试题
名校
10 . 某实验小组利用酸性KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。回答下列问题:
(1)上表中V=__ ,若②③组为对比实验,则T__ 25℃(填“>”、“<”或“=”)。
(2)上述反应的化学方程式为__ 。
(3)t1__ t2(填“>”、“<”、“=”),若t3=50秒,则该条件下的反应速率v(KMnO4)=__ mol·L-1·s-1。
(4)有同学做实验时发现,反应开始时溶液褪色慢,但反应一段时间后溶液褪色明显加快。该同学猜测是催化剂加快了化学反应速率,要证实猜测,除选择硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择以下试剂中的__ 。(填字母序号)
A.硫酸钾 B.硫酸锰 C.硫酸 D.氯化锰 E.蒸馏水
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液褪色时间(s) | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | V | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | T | t3 |
(2)上述反应的化学方程式为
(3)t1
(4)有同学做实验时发现,反应开始时溶液褪色慢,但反应一段时间后溶液褪色明显加快。该同学猜测是催化剂加快了化学反应速率,要证实猜测,除选择硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择以下试剂中的
A.硫酸钾 B.硫酸锰 C.硫酸 D.氯化锰 E.蒸馏水
您最近一年使用:0次

 )
)

