名校
解题方法
1 . 周期表中ⅢA族单质及其化合物应用广泛。BF3极易水解,生成HBF4(HBF4在水中完全电离为H+和 )和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铊(TI)位于元素周期表中第6周期,于1861年发现。下列物质性质与用途具有对应关系的是
)和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铊(TI)位于元素周期表中第6周期,于1861年发现。下列物质性质与用途具有对应关系的是
 )和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铊(TI)位于元素周期表中第6周期,于1861年发现。下列物质性质与用途具有对应关系的是
)和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铊(TI)位于元素周期表中第6周期,于1861年发现。下列物质性质与用途具有对应关系的是| A.BF3极易水解,可用作有机反应的催化剂 |
| B.硼酸甲酯具有挥发性,可用作木材防腐剂 |
| C.GaN硬度大,可用作半导体材料 |
| D.Al(OH)3受热分解,可用作阻燃剂 |
您最近半年使用:0次
名校
2 . 下列实验操作及现象正确,且与解释或结论存在对应关系是
| 选项 | 实验操作及现象 | 解释或结论 |
| A | 向双氧水中滴加酸性 溶液,迅速有气泡生成 溶液,迅速有气泡生成 |  对 对 分解具有催化作用 分解具有催化作用 |
| B | 向 溶液中滴入足量氯水和 溶液中滴入足量氯水和 ,振荡、静置、分层;再向上层溶液中加入KSCN溶液,下层溶液呈紫红色,上层溶液变为血红色。 ,振荡、静置、分层;再向上层溶液中加入KSCN溶液,下层溶液呈紫红色,上层溶液变为血红色。 | 证明还原性: |
| C | 向硫酸酸化的食盐溶液中加入KI溶液和几滴淀粉溶液,溶液未变蓝色 | 该食盐不是含碘盐 |
| D | 向 溶液中滴入稀盐酸,出现白色凝胶 溶液中滴入稀盐酸,出现白色凝胶 | 非金属性: |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-05-30更新
|
75次组卷
|
2卷引用:山东省滨州市部分学校2022-2023学年高一下学期5月联考化学试题
名校
解题方法
3 . 图像可以直观地体现出化学变化中各种变化关系,加深对化学知识的理解。下列图像能够正确表示对应关系的是
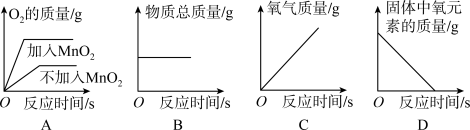

| A.用两份等质量的氯酸钾制取氧气 | B.木炭在盛有氧气的密闭容器中燃烧 |
| C.一定质量的过氧化氢溶液和二氧化锰制取氧气 | D.加热一定质量的高锰酸钾 |
您最近半年使用:0次
解题方法
4 . 氨是人科学技术发史上的一项重大突,目前工业上用氢气和氨气直接合成氨。
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
常温下,大气固氮的倾向_______ 工业固氮(填“大于”或“小于”)
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:_______ ;

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g) 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;

①前2分钟内的平均反应速率v(NH3)=_______ mol·L-1·min-1;
②有关工业固氮的说法正确的是_______ (选填序号) 。
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为_______ ;
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是 _______ (填化学式)
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮N2(g)+3H2(g)  2NH3(g) 2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)
 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;
①前2分钟内的平均反应速率v(NH3)=
②有关工业固氮的说法正确的是
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近半年使用:0次
名校
5 . 如图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
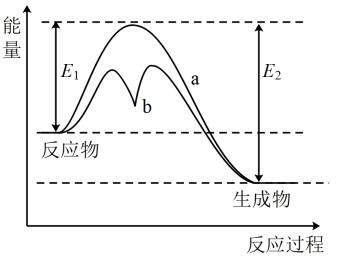

| A.反应为吸热反应 |
| B.a与b相比,a的反应速率更快 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.反应物断键吸收的总能量小于生成物成键释放的总能量 |
您最近半年使用:0次
2022-02-18更新
|
211次组卷
|
2卷引用:广东省广州真光中学2021-2022学年高二上学期12月月考化学试题
名校
解题方法
6 . 下列事实与括号中物质的性质对应关系不正确的是
| A.将鲜花至于装满氯气的集气瓶中褪色(氯气具有漂白性) |
| B.蔗糖遇浓硫酸会变黑膨胀(浓硫酸有强氧化性和脱水性) |
| C.双氧水中加入FeCl3溶液有气体快速放出(Fe3+能催化H2O2分解) |
| D.葡萄糖与银氨溶液共热,有银镜现象(葡萄糖有还原性) |
您最近半年使用:0次
名校
解题方法
7 . H2O2是一种常见试剂,在实验室、工业生产上有广泛用途。H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如下图甲、乙两种实验装置。
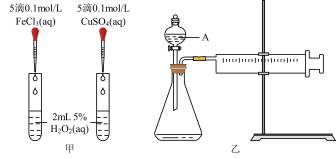
(1)若利用图甲装置,可通过观察___________ 现象,从而定性比较得出结论。
(2)有同学提出将0.1 FeCl3,改为
FeCl3,改为___________ 更为合理,其理由是___________ 。
(3)若利用乙实验可进行定量比较分析,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中还需要用到的实验仪器为___________ 。
(4)请简述如何用“微热法”检查装置乙的气密性良好:组装好实验装置,关闭分液漏斗活塞,___________ 。
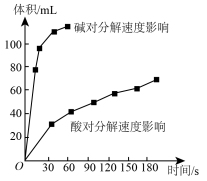
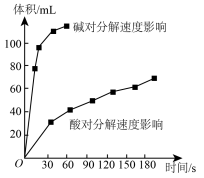
(5)如下图为某小组研究的酸、碱对H2O2分解的影响。该小组提出可以用BaO2固体与H2SO4溶液反应制H2O2,反应的化学方程式为___________ ,支持这一方案的理由是___________ 。
(6)使用催化剂Mn2+催化H2O2分解的反应中,Mn2+改变了___________ (填字母序号)
A.活化分子的浓度 B.反应限度 C.反应焓变
D.反应路径 E.反应活化能 F.活化分子百分数

(1)若利用图甲装置,可通过观察
(2)有同学提出将0.1
 FeCl3,改为
FeCl3,改为(3)若利用乙实验可进行定量比较分析,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中还需要用到的实验仪器为
(4)请简述如何用“微热法”检查装置乙的气密性良好:组装好实验装置,关闭分液漏斗活塞,
(5)如下图为某小组研究的酸、碱对H2O2分解的影响。该小组提出可以用BaO2固体与H2SO4溶液反应制H2O2,反应的化学方程式为

(6)使用催化剂Mn2+催化H2O2分解的反应中,Mn2+改变了
A.活化分子的浓度 B.反应限度 C.反应焓变
D.反应路径 E.反应活化能 F.活化分子百分数
您最近半年使用:0次
解题方法
8 . 高纯硅用途广泛,SiHCl3是制备高纯硅的主要原料,制备SiHCl3主要有以下工艺。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是___________ (填“a”或“b”)。 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。
(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是___________ (填字母)。
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g) 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1
ⅱ.2SiHCl3(g) SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2
ⅲ.SiHCl3(g)+H2(g) Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3
ⅳ.SiCl4(g)+Si(s)+2H2(g) 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4
(3)ΔH4=___________ (写出代数式)。
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。___________ (填序号)。
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=___________ MPa-1(已知压强平衡常数的表达式为各气体物质的平衡分压替代物质的量浓度,气体的分压等于其物质的量分数乘以总压强)。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是
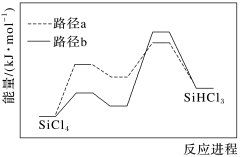
 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g)
 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1ⅱ.2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2ⅲ.SiHCl3(g)+H2(g)
 Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3ⅳ.SiCl4(g)+Si(s)+2H2(g)
 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4(3)ΔH4=
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。
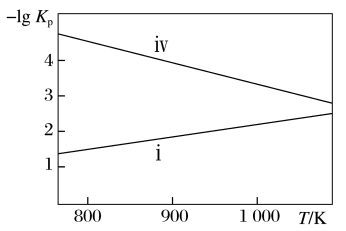
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=
您最近半年使用:0次
9 .  是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。
I. 不稳定、易分解,
不稳定、易分解,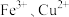 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
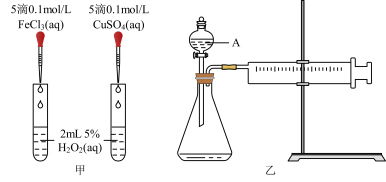
(1)若利用图甲装置,可通过观察___________ 现象,从而定性比较得出结论。
(2)有同学提出将 改为
改为___________  更为合理,其理由是
更为合理,其理由是___________ 。
(3)若利用乙实验可进行定量分析,实验时均以生成 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___________ 。
(4)如图为某小组研究的酸、碱对 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为___________ ,支持这一方案的理由是___________ 。
Ⅱ.实验室用 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:
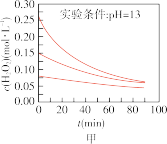
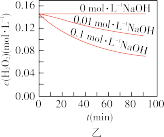

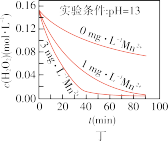
(5)下列说法正确的是:___________(填字母序号)
(6)催化剂 在反应中,改变了
在反应中,改变了___________ (填字母序号)
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
 是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。I.
 不稳定、易分解,
不稳定、易分解,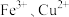 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
(1)若利用图甲装置,可通过观察
(2)有同学提出将
 改为
改为 更为合理,其理由是
更为合理,其理由是(3)若利用乙实验可进行定量分析,实验时均以生成
 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是(4)如图为某小组研究的酸、碱对
 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为
Ⅱ.实验室用
 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:



(5)下列说法正确的是:___________(填字母序号)
A.图甲表明,其他条件相同时, 浓度越小,其分解越慢 浓度越小,其分解越慢 |
B.图乙表明,其他条件相同时,溶液碱性越弱, 分解越快 分解越快 |
C.图丙表明,少量 存在时,溶液碱性越强, 存在时,溶液碱性越强, 分解越快 分解越快 |
D.图丁表明,碱性溶液中, 浓度越大,对 浓度越大,对 分解速率的影响越大 分解速率的影响越大 |
 在反应中,改变了
在反应中,改变了A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
您最近半年使用:0次
解题方法
10 . 放热反应在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为_______ 。
(2)甲烷可以消除氮氧化物污染,发生的反应为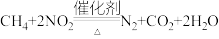 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使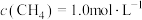 、
、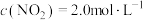 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得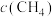 随时间的变化情况如下表:
随时间的变化情况如下表:
①实验1中,在10~20min内,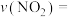
_______ ,40min时v(正)_______ v(逆)(填:“大于”、“小于”、“等于”)。
②0~20min内,实验2比实验1反应速率快的原因可能是_______ 。
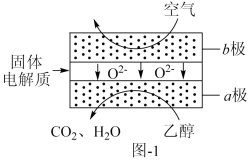
(3)乙醇应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为_______ 。
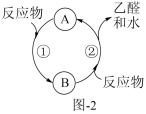
(4)乙醇在Cu作催化剂时与氧气反应的关系如图2,反应②的化学方程式:_______ 。
(5)硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。 高温分解不可能生成
高温分解不可能生成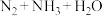 。理由是
。理由是_______ 。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为
(2)甲烷可以消除氮氧化物污染,发生的反应为
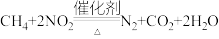 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使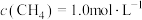 、
、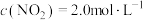 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得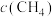 随时间的变化情况如下表:
随时间的变化情况如下表:| 实验 序号 | 时间/min 浓度 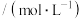 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
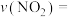
②0~20min内,实验2比实验1反应速率快的原因可能是
(3)乙醇应用于燃料电池,该电池采用可传导
 的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
(4)乙醇在Cu作催化剂时与氧气反应的关系如图2,反应②的化学方程式:

(5)硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。
 高温分解不可能生成
高温分解不可能生成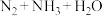 。理由是
。理由是
您最近半年使用:0次



