名校
1 . 科学研究发现负载在Cu-SSZ-13分子筛表面的Cu2+有两种存在形式,其结构如图1所示,其催化NH3还原NO的机理如图2所示。下列说法错误的是
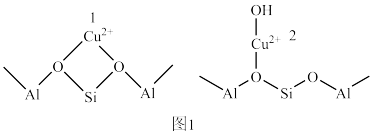
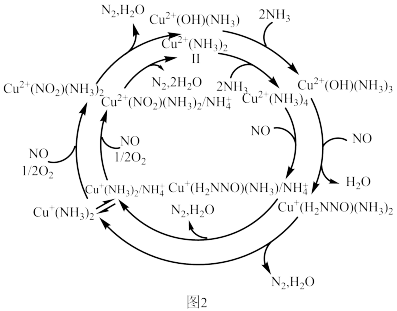
| A.图1中,1号Cu2+与O原子形成的配位键中,O提供孤电子对 |
| B.图2中,在Cu2+表面进行NH3还原NO的反应路径有2种,但可以相互转化 |
C.NH3还原NO的总化学方程式为4NH3+4N0+O2 4N2+6H2O 4N2+6H2O |
| D.该反应机理中涉及氧化还原反应,且Cu+形成配合物的配位数均相同 |
您最近一年使用:0次
解题方法
2 . 由下列实验操作及现象,能推出相应结论的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液 | 有气泡产生 | 说明乙酸有剩余 |
| B | 将镁条点燃,迅速伸入集满CO2的集气瓶中 | 集气瓶中产生大量白烟,并有黑色颗粒产生 | CO2具有氧化性 |
| C | 向双氧水中滴加酸性KMnO4溶液 | 迅速有大量气泡生成 | KMnO4对H2O2分解具有催化作用 |
| D | 向某甲酸样品中先加入足量NaOH溶液,再做银镜反应实验 | 出现银镜 | 该甲酸样品中混有甲醛 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 硫酸盐(含 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: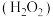 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。
① 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生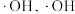 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:
反应Ⅰ: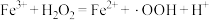 (慢反应);
(慢反应);
反应Ⅱ: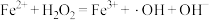 (快反应).
(快反应).
下列说法正确的是________ (填选项字母)。
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气, 氧化
氧化 的反应速率加快
的反应速率加快
D.与 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高
②研究表明 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:
Ⅰ.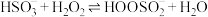 ;
;
Ⅱ.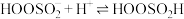 ;
;
Ⅲ.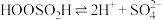 。
。
由此可判断,该条件下的 值为
值为__________ (填“ ”“
”“ ”或“
”或“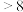 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:____________ 。
(2) 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
Ⅰ.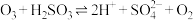 ;
;
Ⅱ. ;
;
Ⅲ.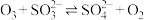 。
。
在含硫微粒总的物质的量为 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得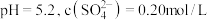 ,则
,则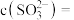
____________ (保留两位有效数字,请写出计算过程)。
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示: 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠________________ 形成;写出 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:____________________ 。
②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是________________ 。
 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: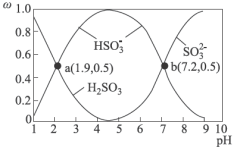
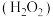 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。①
 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生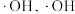 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:反应Ⅰ:
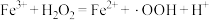 (慢反应);
(慢反应);反应Ⅱ:
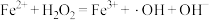 (快反应).
(快反应).下列说法正确的是
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气,
 氧化
氧化 的反应速率加快
的反应速率加快D.与
 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高②研究表明
 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:Ⅰ.
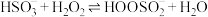 ;
;Ⅱ.
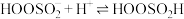 ;
;Ⅲ.
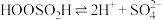 。
。由此可判断,该条件下的
 值为
值为 ”“
”“ ”或“
”或“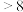 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:(2)
 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:Ⅰ.
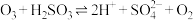 ;
;Ⅱ.
 ;
;Ⅲ.
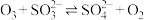 。
。在含硫微粒总的物质的量为
 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得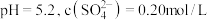 ,则
,则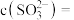
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示:
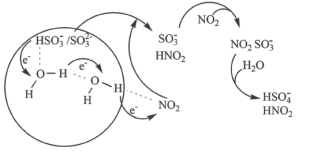
 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是
您最近一年使用:0次
解题方法
4 . 工业上一种钒基催化剂催化NH3还原NO的反应过程如图所示。下列说法错误的是
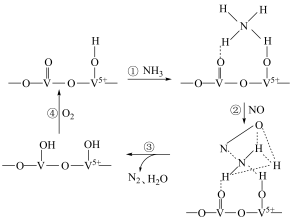
| A.已知反应①速率最快,所以反应①活化能最小 |
B. 为该反应的催化剂 为该反应的催化剂 |
| C.反应③既有极性键的形成,又有非极性键的形成 |
D.总反应方程式为 |
您最近一年使用:0次
5 . 为实现实验目的,选用的玻璃仪器及试剂不合理的是
选项 | 实验目的 | 玻璃仪器 | 试剂 |
A | 探究金属离子对反应速率的影响 | 试管、量筒、胶头滴管 | 双氧水、 |
B | 验证纤维素水解 | 试管、玻璃棒、胶头滴管、酒精灯 | 蒸馏水、浓硫酸、 |
C | 验证乙醇发生消去反应 | 酒精灯、温度计、圆底烧瓶、试管、导管、量筒 | 乙醇、浓硫酸、 |
D | 检验菠菜中含有铁元素 | 试管、烧杯、胶头滴管、玻璃棒 | 蒸馏水、稀硝酸、 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法-“炼石胆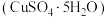 取精华法”。借助现代仪器分析,该制备过程中
取精华法”。借助现代仪器分析,该制备过程中 分解的TG曲线(热重)及DSC曲线如下图所示,DSC图中,吸热效应呈现向下凸起的峰(热焓增加),放热效应反之,则700℃左右有二个吸热峰,此时分解生成的氧化物有
分解的TG曲线(热重)及DSC曲线如下图所示,DSC图中,吸热效应呈现向下凸起的峰(热焓增加),放热效应反之,则700℃左右有二个吸热峰,此时分解生成的氧化物有___________ 种。875℃左右的吸热峰表示化学反应的方程式为___________ 。
①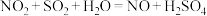 (慢反应) ②
(慢反应) ②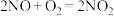 (快反应)
(快反应)
(ⅰ)上述过程中 的作用为
的作用为___________ 。其中反应___________ (填“①”或“②”)是该反应的决速步。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是___________ (答出两点即可)。
(3)接触法制硫酸的关键反应为 的催化氧化:
的催化氧化:
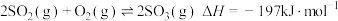
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如图所示,下列说法不正确的是___________ 。
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同α下的最大速率,选择最佳生产温度
(ⅱ)设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为b,用含p和b的代数式表示上述催化氧化反应的
的平衡转化率为b,用含p和b的代数式表示上述催化氧化反应的
___________ (用平衡分压代替平衡浓度计算)。
(4)二氧化硫一空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。___________ ;
(ⅱ)相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为___________ 。
(1)我国古籍记载了硫酸的制备方法-“炼石胆
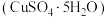 取精华法”。借助现代仪器分析,该制备过程中
取精华法”。借助现代仪器分析,该制备过程中 分解的TG曲线(热重)及DSC曲线如下图所示,DSC图中,吸热效应呈现向下凸起的峰(热焓增加),放热效应反之,则700℃左右有二个吸热峰,此时分解生成的氧化物有
分解的TG曲线(热重)及DSC曲线如下图所示,DSC图中,吸热效应呈现向下凸起的峰(热焓增加),放热效应反之,则700℃左右有二个吸热峰,此时分解生成的氧化物有
①
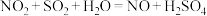 (慢反应) ②
(慢反应) ②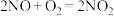 (快反应)
(快反应)(ⅰ)上述过程中
 的作用为
的作用为(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是
(3)接触法制硫酸的关键反应为
 的催化氧化:
的催化氧化: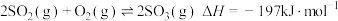
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如图所示,下列说法不正确的是

b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同α下的最大速率,选择最佳生产温度
(ⅱ)设
 的平衡分压为p,
的平衡分压为p, 的平衡转化率为b,用含p和b的代数式表示上述催化氧化反应的
的平衡转化率为b,用含p和b的代数式表示上述催化氧化反应的
(4)二氧化硫一空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。

(ⅱ)相同条件下,放电过程中消耗的
 和
和 的体积比为
的体积比为
您最近一年使用:0次
2024-05-14更新
|
42次组卷
|
2卷引用:2024届新疆高三下学期5月第三次适应性检测理综试卷-高中化学
解题方法
7 . 一种催化还原NO的机理如图所示,下列说法正确的是
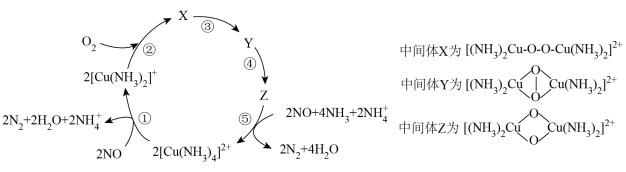

| A.中间体X和Z中O和Cu的化合价均不变 |
B.使用催化剂 ,可以提高NO的反应速率和平衡转化率 ,可以提高NO的反应速率和平衡转化率 |
| C.过程①中既有极性键的断裂,也有极性键的形成 |
D.该催化还原过程的总反应方程式为 |
您最近一年使用:0次
2024-05-14更新
|
49次组卷
|
2卷引用:2024届新疆高三下学期5月第三次适应性检测理综试卷-高中化学
名校
8 . 基于非金属原子嵌入石墨烯三嗪基 中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“*”标注,下列说法中正确的
中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“*”标注,下列说法中正确的
 中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“*”标注,下列说法中正确的
中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“*”标注,下列说法中正确的
| A.整个反应历程中只有极性键的断裂和生成 | B.反应决速步的活化能为1.07eV |
| C.物种吸附在催化剂表面的过程为吸热过程 | D.整个反应历程中共有4个基元反应 |
您最近一年使用:0次
9 . 实验小组探究双氧水与KI的反应,实验方案如下表。
下列说法不正确 的是
| 序号 | ① | ② | ③ |
| 实验装置及操作 |
|
|
|
| 实验现象 | 溶液无明显变化 | 溶液立即变为黄色,产生大量无色气体;溶液温度升高;最终溶液仍为黄色 | 溶液立即变为棕黄色,产生少量无色气体;溶液颜色逐渐加深,温度无明显变化;最终有紫黑色沉淀析出 |
下列说法
| A.KI对H2O2的分解有催化作用 |
| B.①为了排除稀硫酸对实验的干扰 |
| C.对比②和③,②中的现象可能是因为H2O2分解的速率大于H2O2氧化KI的速率 |
| D.实验②③中的温度差异说明,H2O2氧化KI的反应放热 |
您最近一年使用:0次
解题方法
10 . 高纯硅用途广泛,SiHCl3是制备高纯硅的主要原料,制备SiHCl3主要有以下工艺。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是___________ (填“a”或“b”)。 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。
(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是___________ (填字母)。
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g) 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1
ⅱ.2SiHCl3(g) SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2
ⅲ.SiHCl3(g)+H2(g) Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3
ⅳ.SiCl4(g)+Si(s)+2H2(g) 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4
(3)ΔH4=___________ (写出代数式)。
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。___________ (填序号)。
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=___________ MPa-1(已知压强平衡常数的表达式为各气体物质的平衡分压替代物质的量浓度,气体的分压等于其物质的量分数乘以总压强)。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是
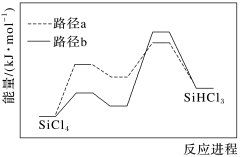
 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g)
 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1ⅱ.2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2ⅲ.SiHCl3(g)+H2(g)
 Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3ⅳ.SiCl4(g)+Si(s)+2H2(g)
 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4(3)ΔH4=
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。
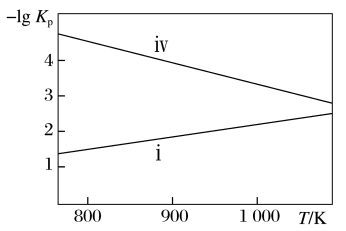
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=
您最近一年使用:0次

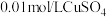 溶液、
溶液、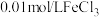 溶液
溶液 溶液、
溶液、 溶液
溶液 溶液
溶液