解题方法
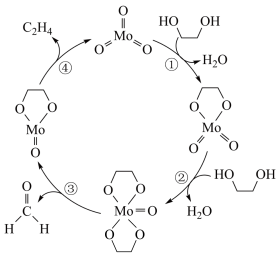
1 . 在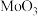 作用下,
作用下,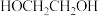 发生反应的历程如图所示。下列说法正确的是
发生反应的历程如图所示。下列说法正确的是
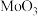 作用下,
作用下,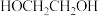 发生反应的历程如图所示。下列说法正确的是
发生反应的历程如图所示。下列说法正确的是
A. 能提高 能提高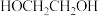 的平衡转化率 的平衡转化率 |
B.该反应历程中 、 、 键均发生断裂 键均发生断裂 |
C.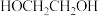 滴入过量酸性高锰酸钾溶液中生成 滴入过量酸性高锰酸钾溶液中生成 |
D.若将原料换为 ,则生成物为乙醛和丙烯 ,则生成物为乙醛和丙烯 |
您最近半年使用:0次
解题方法
2 . 在V2O5催化下,SO2(g)氧化为SO3(g)的热化学方程式为

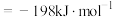 ,研究表明,该反应分两步进行,历程如下:第一步:
,研究表明,该反应分两步进行,历程如下:第一步: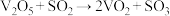 (快),第二步:
(快),第二步: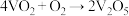 (慢)。下列说法错误的是
(慢)。下列说法错误的是


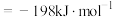 ,研究表明,该反应分两步进行,历程如下:第一步:
,研究表明,该反应分两步进行,历程如下:第一步: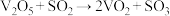 (快),第二步:
(快),第二步: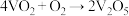 (慢)。下列说法错误的是
(慢)。下列说法错误的是| A.V2O5参与了化学反应 |
| B.总反应中逆反应的活化能比正反应的活化能大 |
| C.第一步的逆反应速率小于第二步的正反应速率 |
| D.提高第二步的反应速率,可提高整个反应的反应速率 |
您最近半年使用:0次
名校
解题方法
3 . 氮的化合物研究是环境科学的热点课题之一。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:
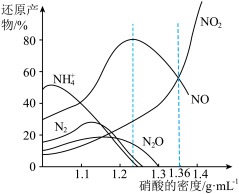
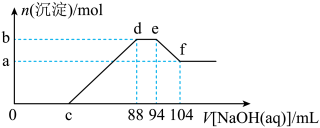
(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)________________ 。
A.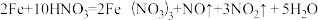
B.
C.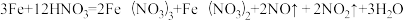
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:
①c点对应NaOH溶液的体积为________________ mL;
②ef段发生反应的离子方程式为________________ 。
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数________________ 。
②H2O2与HNO2反应的化学方程式为________________ 。
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是________________ 。
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为________________ 。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式________________ 。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:

(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)
A.
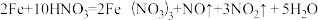
B.

C.
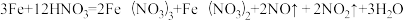
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:

①c点对应NaOH溶液的体积为
②ef段发生反应的离子方程式为
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数
②H2O2与HNO2反应的化学方程式为
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式
您最近半年使用:0次
名校
解题方法
4 . 为使CO2的利用更具价值,某研究小组设计了如下三种减碳方式。请按要求回答下列问题。
(1)设想1:用太阳能将CO2转化成O2和C(s,石墨烯)如图所示:

①热分解系统中能量转化形式为___________ 。
②在重整系统中的还原剂为:___________ 。
(2)设想2:CO2和CH4反应转化为CH3COOH,其催化反应历程示意图如下(E1与E2的单位为kJ):
①该催化总反应为___________ 。
②Ⅰ→Ⅲ反应的
___________ kJ/mol。
(3)设想3:CO2与H2在催化剂作用下制取乙烯:在2L密闭容器中分别投入2mol CO2,6mol H2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)  ;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。

①该反应的
___________ 0(填“>”“<”或“不能确定”)。
②200℃,5min达平衡,v(C2H4)=___________ ;CO2的平衡转化率为___________ ;该反应平衡常数的值为___________ 。
③其他条件不变,将反应器容积压缩为原来的一半,达新平衡时比原平衡C2H4浓度将___________ (填“增大”“减小”或“不变),判断理由是 ___________ 。
(1)设想1:用太阳能将CO2转化成O2和C(s,石墨烯)如图所示:

①热分解系统中能量转化形式为
②在重整系统中的还原剂为:
(2)设想2:CO2和CH4反应转化为CH3COOH,其催化反应历程示意图如下(E1与E2的单位为kJ):

①该催化总反应为
②Ⅰ→Ⅲ反应的

(3)设想3:CO2与H2在催化剂作用下制取乙烯:在2L密闭容器中分别投入2mol CO2,6mol H2,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)  ;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
①该反应的

②200℃,5min达平衡,v(C2H4)=
③其他条件不变,将反应器容积压缩为原来的一半,达新平衡时比原平衡C2H4浓度将
您最近半年使用:0次
解题方法
5 . 某反应的反应机理、能量与反应进程的关系如下图所示,下列说法正确的是
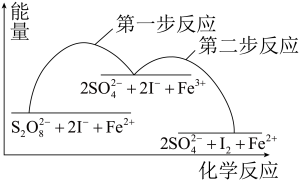

A. 是该反应的催化剂 是该反应的催化剂 | B.该反应焓变 <0可知,该反应可自发进行 <0可知,该反应可自发进行 |
C.加入催化剂后,反应的 变小 变小 | D.第一步反应的活化能比第二步反应的小 |
您最近半年使用:0次
名校
解题方法
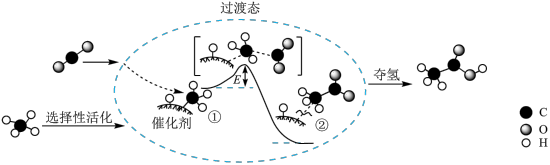
6 . CO和H2O吸附在Aun(n=10、13、20)团簇上得到活化态,反应机理如图所示:

已知:A、B、C、D、E、F、G、I为实验步骤。下列相关说法正确的是

已知:A、B、C、D、E、F、G、I为实验步骤。下列相关说法正确的是
| A.CO与H2O在Aun团簇的催化作用下直接反应 |
| B.步骤Db1与步骤Db2的产物均可生成CO2和H2 |
| C.ABCDa1EI生成CO2与ABCFDb2I生成CO2机理相同 |
D.Da2的反应是 |
您最近半年使用:0次
名校
7 . 钒系催化剂催化脱硝部分机理如图所示,则有关该过程的叙述
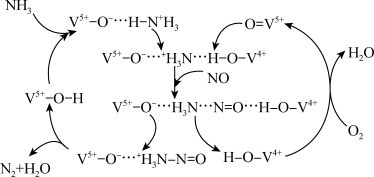
| A.V在流程中的化合价变化为+5→+4→+5 |
| B.V5+-O-···H-N+H3为该反应的一个中间体 |
| C.该反应的整体反应为:6NH3 + 5NO + 2O2 = 4N2 + 9H2O |
| D.反应过程中涉及极性共价键的断裂与形成和非极性共价键的断裂与形成 |
您最近半年使用:0次
名校
解题方法
8 . HCHO(g)与O2在催化剂羟基磷灰石(简写为HAP)表面催化生成CO2(g)和H2O(g)的历程示意图如下。下列说法错误的是
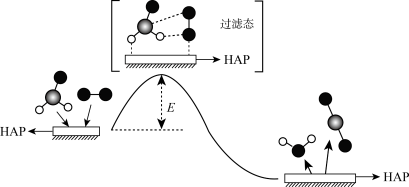

| A.CO2分子的分子空间构型为直线形 |
| B.羟基磷灰石(HAP)的作用是加快反应速率 |
| C.HCHO和H2O分子的VSEPR模型都是四面体形 |
| D.该反应过程既有极性共价键的断裂,也有非极性共价键的断裂 |
您最近半年使用:0次
名校
9 . 锂-氧电池(LOB)由于其超高的理论能量密度而被认为是最有前途的储能器件之一、最近,北京大学&清华大学课题组报道了以Pt1Pd为催化剂的LOB,其工作原理如图所示(Pt1Pd为单原子合金催化剂,单原子Pt精确分散在超薄P六方纳米板上)。
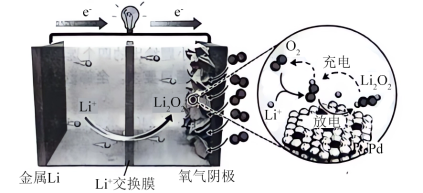
已知:理论能量密度是指在特定条件下,单位体积或表面积内储存的能量大小。
下列叙述正确的是

已知:理论能量密度是指在特定条件下,单位体积或表面积内储存的能量大小。
下列叙述正确的是
| A.放电时“氧气阴极”发生氧化反应 |
| B.LOB理论能量密度高是因为锂是最活泼金属 |
| C.充电时,金属Li电极电势高于另一电极 |
| D.Pt1Pd促进O2/Li2O2氧化还原对的活化,降低反应的活化能 |
您最近半年使用:0次
名校
解题方法
10 . 合成氨原料气高纯氢可以由天然气、水蒸气催化重整制取,所涉及的主要反应如下:
已知:反应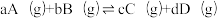 的物质的量分数平衡常数
的物质的量分数平衡常数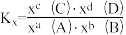 ,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
CH4(g)的相对能量为_____ kJ·mol-l。
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.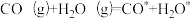
Ⅱ._____ 。
Ⅲ.
Ⅳ.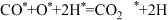
V.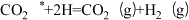
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值(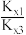 )
)_____ (填“增大”“减小”或“不变”),其原因为_____ 。
(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为_____ 。
②T℃时,反应i的平衡常数Kx1=_____ (列出表达式,无需化简)。
③若将容器的体积压缩为1L,甲烷的平衡转化率_____ (填“增大”“减小”或“不变”,下同),反应ⅲ的逆反应速率_____ 。
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是_____ (填字母)。
A.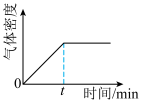 B.
B.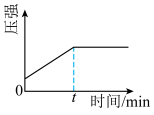 C.
C.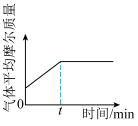 D.
D.
| 相关反应 | △H | 物质的量分数平衡常数 | |
| 反应i | 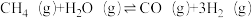 |  | Kx1 |
| 反应ⅱ | 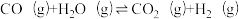 |  | Kx2 |
| 反应iii | 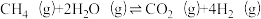 | 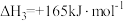 | Kx3 |
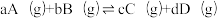 的物质的量分数平衡常数
的物质的量分数平衡常数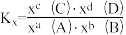 ,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
| 物质 | CO(g) | H2O(g) | H2(g) |
| 相对能量/(kJ·mol-1) | -110.5 | -241.8 | 0 |
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.
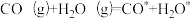
Ⅱ.
Ⅲ.

Ⅳ.
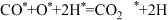
V.
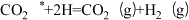
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值(
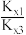 )
)(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为
②T℃时,反应i的平衡常数Kx1=
③若将容器的体积压缩为1L,甲烷的平衡转化率
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是
A.
 B.
B. C.
C. D.
D.
您最近半年使用:0次



