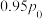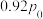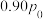解题方法
1 . 2023 年杭州亚运会主火炬创新使用了绿色“零碳甲醇”作为燃料,这不仅在亚运史上是第一次,在全球大型体育赛事上也是首次实现了废碳的再生利用。“零碳甲醇”是符合“碳中和”属性的绿色能源。
请回答下列问题:
(1)工业上主要利用以下反应合成甲醇: CO2(g)+3H2(g) CH3OH(g)+H2O(g)。已知在一定条件下该反应的
CH3OH(g)+H2O(g)。已知在一定条件下该反应的 = -akJ⋅mol-1,ΔS=-bJ⋅mol-1⋅K-1(a>0,b >0),假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围
= -akJ⋅mol-1,ΔS=-bJ⋅mol-1⋅K-1(a>0,b >0),假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围 ___________ K(用含a、b的代数式表示)。
(2)目前有多种用于工业捕集CO2的方法,主要分为吸收(物理吸收、化学吸收、生物吸收)、吸附、深冷分离和膜分离等,也有将不同捕集方法相结合的方法。一种模拟脱除工业尾气中CO2的示意图如图所示: 后,
后, 则该溶液的pOH=
则该溶液的pOH=___________ (该温度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11 Kw=1×10-a,用含a的代数式表示)。
(3)CO2合成甲醇的工艺主要分为两类,一类称为直接法:CO2直接加H2合成甲醇;一类称为间接法:CO2和H2通过逆水煤气反应,先合成CO后,CO和H2再合成甲醇。
I.CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) ΔH1=-48.9kJ⋅mol-1
CH3OH(g)+H2O(g) ΔH1=-48.9kJ⋅mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2= +41.1 kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.1 kJ·mol-1
Ⅲ.CO(g)+2H2(g) 3CH3OH(g) ΔH3=-90kJ⋅mol-1
3CH3OH(g) ΔH3=-90kJ⋅mol-1
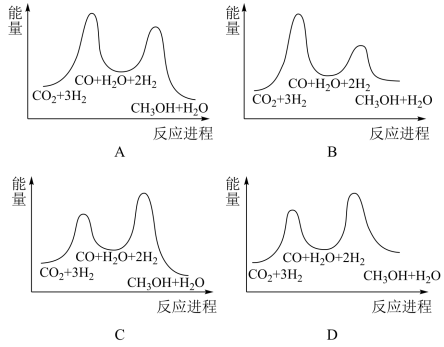
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是___________ (填字母)。___________ 。
③工业生产中测定体系的压强具有实际意义。一定温度下,仅利用反应Ⅰ直接合成甲醇,将体积分数为a% CO2、3a% H2 的进料气(含杂质气体),以 Cu/Zn/Al/Zr纳米纤维为催化剂,控制压强为50 bar(1 bar=100 kPa)发生反应I,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时, p(H2) =___________ bar,反应I的平衡常数Kp= ___________ bar-2(Kp为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示)。
(4)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是___________ ,理由是___________ 。
请回答下列问题:
(1)工业上主要利用以下反应合成甲醇: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。已知在一定条件下该反应的
CH3OH(g)+H2O(g)。已知在一定条件下该反应的 = -akJ⋅mol-1,ΔS=-bJ⋅mol-1⋅K-1(a>0,b >0),假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围
= -akJ⋅mol-1,ΔS=-bJ⋅mol-1⋅K-1(a>0,b >0),假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围 (2)目前有多种用于工业捕集CO2的方法,主要分为吸收(物理吸收、化学吸收、生物吸收)、吸附、深冷分离和膜分离等,也有将不同捕集方法相结合的方法。一种模拟脱除工业尾气中CO2的示意图如图所示:
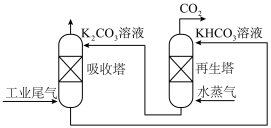
 后,
后, 则该溶液的pOH=
则该溶液的pOH=(3)CO2合成甲醇的工艺主要分为两类,一类称为直接法:CO2直接加H2合成甲醇;一类称为间接法:CO2和H2通过逆水煤气反应,先合成CO后,CO和H2再合成甲醇。
I.CO2 (g)+3H2 (g)
 CH3OH(g)+H2O(g) ΔH1=-48.9kJ⋅mol-1
CH3OH(g)+H2O(g) ΔH1=-48.9kJ⋅mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2= +41.1 kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.1 kJ·mol-1Ⅲ.CO(g)+2H2(g)
 3CH3OH(g) ΔH3=-90kJ⋅mol-1
3CH3OH(g) ΔH3=-90kJ⋅mol-1①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是
③工业生产中测定体系的压强具有实际意义。一定温度下,仅利用反应Ⅰ直接合成甲醇,将体积分数为a% CO2、3a% H2 的进料气(含杂质气体),以 Cu/Zn/Al/Zr纳米纤维为催化剂,控制压强为50 bar(1 bar=100 kPa)发生反应I,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时, p(H2) =
(4)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是
您最近一年使用:0次
2024-04-02更新
|
156次组卷
|
2卷引用:安徽省部分学校2023-2024学年高三下学期3月联考化学试题
名校
解题方法
2 . N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某Ru(Ⅱ)催化剂用[L-Ru-NH3]+表示|能高效电催化氧化NH3合成N2H4,其反应机理如图所示(图中L为原子团)。下列说法错误的是
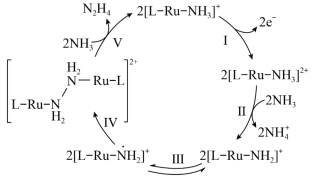
| A.[L-Ru-NH3]2+中Ru的化合价为+3 |
| B.反应Ⅳ中有非极性键的断裂与形成 |
| C.电催化氧化NH3合成N2H4发生在电解池阳极区 |
| D.N2H4与NH3中 N 原子的 VSEPR 模型均为四面体形 |
您最近一年使用:0次
2024-04-02更新
|
522次组卷
|
5卷引用:安徽省部分学校2023-2024学年高三下学期3月联考化学试题
安徽省部分学校2023-2024学年高三下学期3月联考化学试题安徽省示范高中皖北协作区2024届高三联考化学试题江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷 (已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题
名校
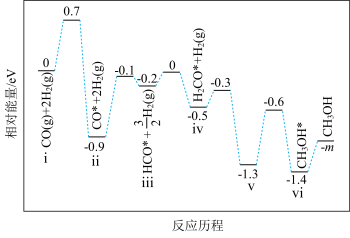
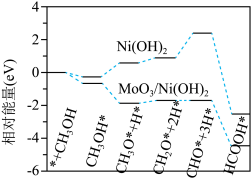
3 . 镍基材料作为甲醇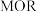 反应催化剂已被广泛研究。近日,广东省科学院测试分析研究所提出
反应催化剂已被广泛研究。近日,广东省科学院测试分析研究所提出 和
和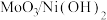 均能催化甲醇
均能催化甲醇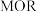 反应,其反应历程的片段如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
反应,其反应历程的片段如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
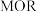 反应催化剂已被广泛研究。近日,广东省科学院测试分析研究所提出
反应催化剂已被广泛研究。近日,广东省科学院测试分析研究所提出 和
和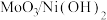 均能催化甲醇
均能催化甲醇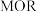 反应,其反应历程的片段如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
反应,其反应历程的片段如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
A.文献中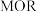 反应指的是还原反应 反应指的是还原反应 |
B.吸附甲醇的效果: 劣于 劣于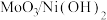 |
C. 催化下,消耗 催化下,消耗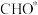 的步骤为决速步 的步骤为决速步 |
D.上述历程中碳原子的杂化类型由 转化为 转化为 |
您最近一年使用:0次
4 . 甲醇直接脱氢制无水甲醛是具有工业化前景的新工艺。回答下列问题:
(1)在标准压强(100kPa)、298K下,一些物质的热力学数据如下表,标准摩尔生成焓是指由稳定的单质合成1mol该物质的反应焓变;
甲醇脱氢制甲醛的反应方程式为:

___________ ,该反应高温能自发进行的原因是___________ 。
(2)已知Arrhenius经验公式为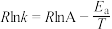 (
( 为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
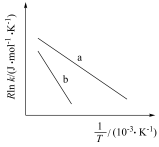
①升高温度,速率常数k___________ (填“增大”“减小”或“不变”);
②催化剂Ⅱ作用下,实验数据如图中b线所示,则催化效果:催化剂Ⅰ___________ 催化剂Ⅱ(填“>”成“<”)。
(3)催化剂1作用下,恒容密闭容器中充入一定量的 发生反应
发生反应 ,达到平衡时,容器总压、
,达到平衡时,容器总压、 的体积分数随温度的变化曲线如图所示。
的体积分数随温度的变化曲线如图所示。
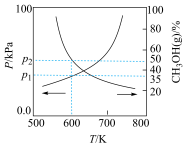
①随着温度的升高,压强不断增大的原因是___________ 。
②600K达到平衡时,
___________ kPa(用含“p”的式子表示,下同), 的转化率为
的转化率为___________ ,
___________ 。
(1)在标准压强(100kPa)、298K下,一些物质的热力学数据如下表,标准摩尔生成焓是指由稳定的单质合成1mol该物质的反应焓变;
| 物质 |  | HCHO |  |
标准摩尔生成焓(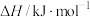 ) ) | 0 | -115.8 | -201 |
熵(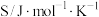 ) ) | 130.7 | 218.7 | 239.9 |


(2)已知Arrhenius经验公式为
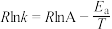 (
( 为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
①升高温度,速率常数k
②催化剂Ⅱ作用下,实验数据如图中b线所示,则催化效果:催化剂Ⅰ
(3)催化剂1作用下,恒容密闭容器中充入一定量的
 发生反应
发生反应 ,达到平衡时,容器总压、
,达到平衡时,容器总压、 的体积分数随温度的变化曲线如图所示。
的体积分数随温度的变化曲线如图所示。
①随着温度的升高,压强不断增大的原因是
②600K达到平衡时,

 的转化率为
的转化率为
您最近一年使用:0次
解题方法
5 . 在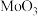 作用下,
作用下,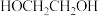 发生反应的历程如图所示。下列说法正确的是
发生反应的历程如图所示。下列说法正确的是
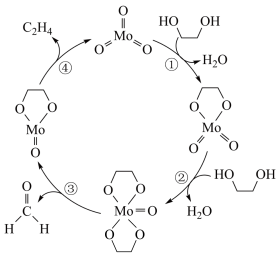
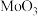 作用下,
作用下,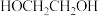 发生反应的历程如图所示。下列说法正确的是
发生反应的历程如图所示。下列说法正确的是
A.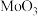 能提高 能提高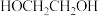 的平衡转化率 的平衡转化率 |
B.该反应历程中 、 、 键均发生断裂 键均发生断裂 |
C.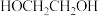 滴入过量酸性高锰酸钾溶液中生成 滴入过量酸性高锰酸钾溶液中生成 |
D.若将原料换为 ,则生成物为乙醛和丙烯 ,则生成物为乙醛和丙烯 |
您最近一年使用:0次
解题方法
6 . 在V2O5催化下,SO2(g)氧化为SO3(g)的热化学方程式为

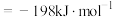 ,研究表明,该反应分两步进行,历程如下:第一步:
,研究表明,该反应分两步进行,历程如下:第一步: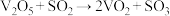 (快),第二步:
(快),第二步: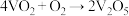 (慢)。下列说法错误的是
(慢)。下列说法错误的是


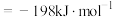 ,研究表明,该反应分两步进行,历程如下:第一步:
,研究表明,该反应分两步进行,历程如下:第一步: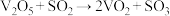 (快),第二步:
(快),第二步: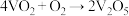 (慢)。下列说法错误的是
(慢)。下列说法错误的是| A.V2O5参与了化学反应 |
| B.总反应中逆反应的活化能比正反应的活化能大 |
| C.第一步的逆反应速率小于第二步的正反应速率 |
| D.提高第二步的反应速率,可提高整个反应的反应速率 |
您最近一年使用:0次
名校
解题方法
7 . 氮的化合物研究是环境科学的热点课题之一。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:
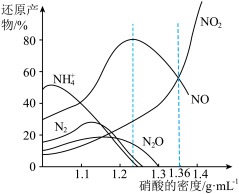
(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)________________ 。
A.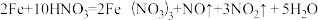
B.
C.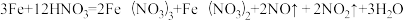
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:
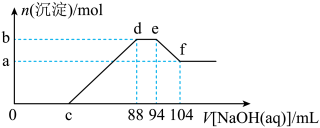
①c点对应NaOH溶液的体积为________________ mL;
②ef段发生反应的离子方程式为________________ 。
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数________________ 。
②H2O2与HNO2反应的化学方程式为________________ 。
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是________________ 。
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为________________ 。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式________________ 。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:

(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)
A.
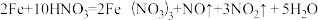
B.

C.
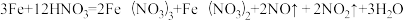
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:

①c点对应NaOH溶液的体积为
②ef段发生反应的离子方程式为
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数
②H2O2与HNO2反应的化学方程式为
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
8 . 我国科学家成功利用光伏发电,将电解水获得的 与
与 反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:
反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:
(1) 人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。 的
的
__________ (用含 、
、 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)有学者结合实验和计算机模拟结果,得出 的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为
的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为__________ ;TS3对应的步骤适合在__________ (填“高温”或“低温”)条件下进行。 和
和 ,发生反应
,发生反应
 ,在催化剂作用下单位时间内
,在催化剂作用下单位时间内 的转化率与温度、催化剂的关系如图所示。
的转化率与温度、催化剂的关系如图所示。 的生成速率
的生成速率__________ (填“>”“<”或“=”,下同) 的消耗速率;催化效率:Cat2
的消耗速率;催化效率:Cat2__________ Cat1。
②b点之后 的转化率降低,可能的原因是
的转化率降低,可能的原因是__________ 。
(4)已知 催化加氢的主要反应如下:
催化加氢的主要反应如下:
反应Ⅰ.
反应Ⅱ.
①230℃时,将 和
和 按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。
按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。
平衡时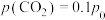 ,则该温度下反应Ⅰ的化学平衡常数
,则该温度下反应Ⅰ的化学平衡常数
__________  (用含
(用含 的代数式表示)。
的代数式表示)。
②二氧化碳催化加氢合成甲醇反应往往伴随副反应Ⅱ。一定温度和压强条件下,为了提高反应速率和甲醇选择性,应当__________ 。
 与
与 反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:
反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:(1)
 人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。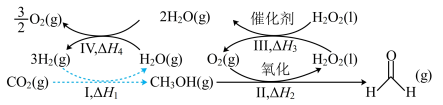
 的
的
 、
、 、
、 、
、 的代数式表示)。
的代数式表示)。(2)有学者结合实验和计算机模拟结果,得出
 的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为
的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为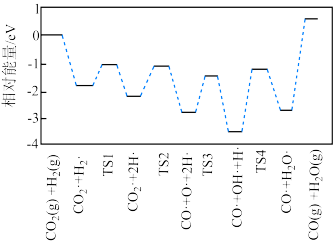
 和
和 ,发生反应
,发生反应
 ,在催化剂作用下单位时间内
,在催化剂作用下单位时间内 的转化率与温度、催化剂的关系如图所示。
的转化率与温度、催化剂的关系如图所示。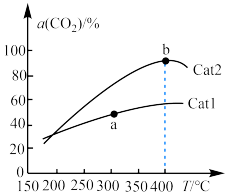
 的生成速率
的生成速率 的消耗速率;催化效率:Cat2
的消耗速率;催化效率:Cat2②b点之后
 的转化率降低,可能的原因是
的转化率降低,可能的原因是(4)已知
 催化加氢的主要反应如下:
催化加氢的主要反应如下:反应Ⅰ.

反应Ⅱ.

①230℃时,将
 和
和 按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。
按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。时间/min | 0 | 20 | 40 | 60 | 80 |
压强/MPa |
|
|
|
|
|
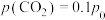 ,则该温度下反应Ⅰ的化学平衡常数
,则该温度下反应Ⅰ的化学平衡常数
 (用含
(用含 的代数式表示)。
的代数式表示)。②二氧化碳催化加氢合成甲醇反应往往伴随副反应Ⅱ。一定温度和压强条件下,为了提高反应速率和甲醇选择性,应当
您最近一年使用:0次
2024-03-30更新
|
385次组卷
|
5卷引用:江西省部分地区2023-2024学年高三下学期3月月考化学试题
名校
解题方法
9 . 为使CO2的利用更具价值,某研究小组设计了如下三种减碳方式。请按要求回答下列问题。
(1)设想1:用太阳能将CO2转化成O2和C(s,石墨烯)如图所示:

①热分解系统中能量转化形式为___________ 。
②在重整系统中的还原剂为:___________ 。
(2)设想2:CO2和CH4反应转化为CH3COOH,其催化反应历程示意图如下(E1与E2的单位为kJ):
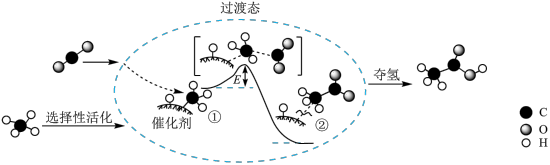
①该催化总反应为___________ 。
②Ⅰ→Ⅲ反应的
___________ kJ/mol。
(3)设想3:CO2与H2在催化剂作用下制取乙烯:在2L密闭容器中分别投入2mol CO2,6mol H2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)  ;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。

①该反应的
___________ 0(填“>”“<”或“不能确定”)。
②200℃,5min达平衡,v(C2H4)=___________ ;CO2的平衡转化率为___________ ;该反应平衡常数的值为___________ 。
③其他条件不变,将反应器容积压缩为原来的一半,达新平衡时比原平衡C2H4浓度将___________ (填“增大”“减小”或“不变),判断理由是 ___________ 。
(1)设想1:用太阳能将CO2转化成O2和C(s,石墨烯)如图所示:

①热分解系统中能量转化形式为
②在重整系统中的还原剂为:
(2)设想2:CO2和CH4反应转化为CH3COOH,其催化反应历程示意图如下(E1与E2的单位为kJ):

①该催化总反应为
②Ⅰ→Ⅲ反应的

(3)设想3:CO2与H2在催化剂作用下制取乙烯:在2L密闭容器中分别投入2mol CO2,6mol H2,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)  ;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
①该反应的

②200℃,5min达平衡,v(C2H4)=
③其他条件不变,将反应器容积压缩为原来的一半,达新平衡时比原平衡C2H4浓度将
您最近一年使用:0次
解题方法
10 . 某反应的反应机理、能量与反应进程的关系如下图所示,下列说法正确的是
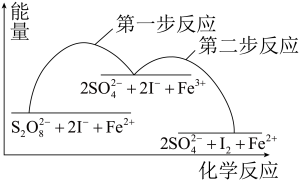

A. 是该反应的催化剂 是该反应的催化剂 | B.该反应焓变 <0可知,该反应可自发进行 <0可知,该反应可自发进行 |
C.加入催化剂后,反应的 变小 变小 | D.第一步反应的活化能比第二步反应的小 |
您最近一年使用:0次