名校
解题方法
1 . CO和H2O吸附在Aun(n=10、13、20)团簇上得到活化态,反应机理如图所示:

已知:A、B、C、D、E、F、G、I为实验步骤。下列相关说法正确的是

已知:A、B、C、D、E、F、G、I为实验步骤。下列相关说法正确的是
| A.CO与H2O在Aun团簇的催化作用下直接反应 |
| B.步骤Db1与步骤Db2的产物均可生成CO2和H2 |
| C.ABCDa1EI生成CO2与ABCFDb2I生成CO2机理相同 |
D.Da2的反应是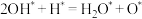 |
您最近一年使用:0次
名校
2 . 钒系催化剂催化脱硝部分机理如图所示,则有关该过程的叙述
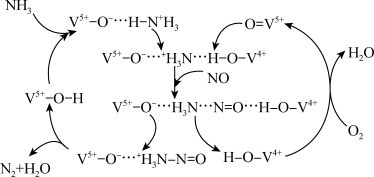
| A.V在流程中的化合价变化为+5→+4→+5 |
| B.V5+-O-···H-N+H3为该反应的一个中间体 |
| C.该反应的整体反应为:6NH3 + 5NO + 2O2 = 4N2 + 9H2O |
| D.反应过程中涉及极性共价键的断裂与形成和非极性共价键的断裂与形成 |
您最近一年使用:0次
名校
解题方法
3 . HCHO(g)与O2在催化剂羟基磷灰石(简写为HAP)表面催化生成CO2(g)和H2O(g)的历程示意图如下。下列说法错误的是
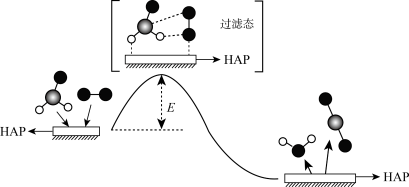

| A.CO2分子的分子空间构型为直线形 |
| B.羟基磷灰石(HAP)的作用是加快反应速率 |
| C.HCHO和H2O分子的VSEPR模型都是四面体形 |
| D.该反应过程既有极性共价键的断裂,也有非极性共价键的断裂 |
您最近一年使用:0次
名校
4 . 锂-氧电池(LOB)由于其超高的理论能量密度而被认为是最有前途的储能器件之一、最近,北京大学&清华大学课题组报道了以Pt1Pd为催化剂的LOB,其工作原理如图所示(Pt1Pd为单原子合金催化剂,单原子Pt精确分散在超薄P六方纳米板上)。
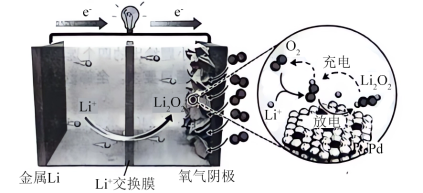
已知:理论能量密度是指在特定条件下,单位体积或表面积内储存的能量大小。
下列叙述正确的是

已知:理论能量密度是指在特定条件下,单位体积或表面积内储存的能量大小。
下列叙述正确的是
| A.放电时“氧气阴极”发生氧化反应 |
| B.LOB理论能量密度高是因为锂是最活泼金属 |
| C.充电时,金属Li电极电势高于另一电极 |
| D.Pt1Pd促进O2/Li2O2氧化还原对的活化,降低反应的活化能 |
您最近一年使用:0次
名校
解题方法
5 . 合成氨原料气高纯氢可以由天然气、水蒸气催化重整制取,所涉及的主要反应如下:
已知:反应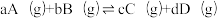 的物质的量分数平衡常数
的物质的量分数平衡常数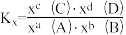 ,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
CH4(g)的相对能量为_____ kJ·mol-l。
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.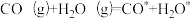
Ⅱ._____ 。
Ⅲ.
Ⅳ.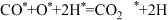
V.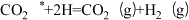
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值(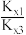 )
)_____ (填“增大”“减小”或“不变”),其原因为_____ 。
(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为_____ 。
②T℃时,反应i的平衡常数Kx1=_____ (列出表达式,无需化简)。
③若将容器的体积压缩为1L,甲烷的平衡转化率_____ (填“增大”“减小”或“不变”,下同),反应ⅲ的逆反应速率_____ 。
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是_____ (填字母)。
A.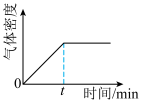 B.
B.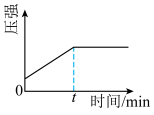 C.
C.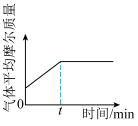 D.
D.
| 相关反应 | △H | 物质的量分数平衡常数 | |
| 反应i | 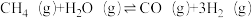 |  | Kx1 |
| 反应ⅱ | 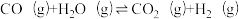 |  | Kx2 |
| 反应iii | 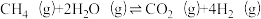 | 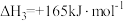 | Kx3 |
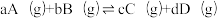 的物质的量分数平衡常数
的物质的量分数平衡常数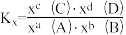 ,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
| 物质 | CO(g) | H2O(g) | H2(g) |
| 相对能量/(kJ·mol-1) | -110.5 | -241.8 | 0 |
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.
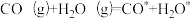
Ⅱ.
Ⅲ.

Ⅳ.
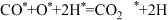
V.
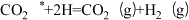
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值(
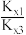 )
)(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为
②T℃时,反应i的平衡常数Kx1=
③若将容器的体积压缩为1L,甲烷的平衡转化率
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解题方法
6 . 下列实验操作及现象、得出的结论及解释,均正确的是
选项 | 实验操作及现象 | 结论及解释 |
A | 常温下,用胶头滴管将待测NaClO溶液滴在pH试纸上,与标准比色卡对照, | NaClO溶液显碱性 |
B | 在KSCN与 的混合液中再加入少量KCl固体,溶液颜色加深 的混合液中再加入少量KCl固体,溶液颜色加深 | 增大 浓度,平衡正向移动 浓度,平衡正向移动 |
C | 在相同条件下,向一支试管中加入2 mL 5% 溶液,向另一支试管中加入2 mL 5% 溶液,向另一支试管中加入2 mL 5% 溶液和1 mL 溶液和1 mL 溶液,可观察到后者产生气泡速率更快 溶液,可观察到后者产生气泡速率更快 |  可加快 可加快 分解速率 分解速率 |
D | 在室温下,用pH计分别测定 的 的 溶液、 溶液、 的 的 溶液的pH,前者大于后者 溶液的pH,前者大于后者 | 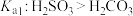 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-26更新
|
38次组卷
|
2卷引用:山东省枣庄薛城实验中学等校2023-2023学年高二上学期12月大联考化学试题
7 . 氯化亚铜催化甲醇氧化羰基化合成碳酸二甲酯的反应机理如图所示,下列说法不正确的是
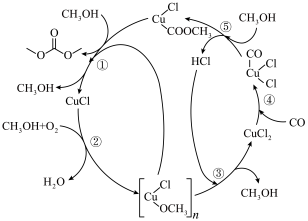

A.总反应4CH3OH+O2+2CO 2 CH3OCOOCH3+2H2O 2 CH3OCOOCH3+2H2O |
| B.含铜的微粒中有4种是反应的中间产物 |
C.反应⑤的化学方程式为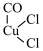 +CH3OH→ +CH3OH→  +HCl +HCl |
| D.氯化亚铜参与了反应的循环,增大了反应的速率和提高了甲醇的转化率 |
您最近一年使用:0次
解题方法
8 . 利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比
2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
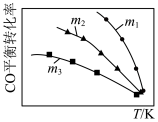
 2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比
2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.若m=2,反应达平衡时,NO的转化率为40%,则N2的体积分数为15.4% |
B.该反应的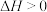 |
C.投料比: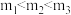 |
| D.汽车排气管中的催化剂可提高NO的平衡转化率 |
您最近一年使用:0次
解题方法
9 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为: 。
。
回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)___________ 温(填“高”或“低”,下同)有利于提高反应速率,___________ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用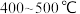 。
。
(3)传统催化剂用的是铁触媒,合成氨反应在 催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,
催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,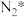 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 )判断上述反应机理中,速率控制步骤(即速率最慢步骤)为
)判断上述反应机理中,速率控制步骤(即速率最慢步骤)为___________ (填步骤前的标号),理由是___________ 。
(i)
(ii)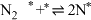
(iii)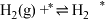
(iv)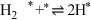
(v)
……
(…)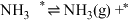
(4)针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用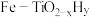 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为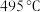 时,
时, 的温度为
的温度为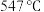 ,而
,而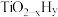 的温度为
的温度为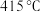 )。
)。

下列说法正确的是___________ 。
a.氨气在“冷 ”表面生成,有利于提高氨的平衡产率
”表面生成,有利于提高氨的平衡产率
b. 在“热
在“热 ”表面断裂,有利于提高合成氨反应速率
”表面断裂,有利于提高合成氨反应速率
c.“热 ”高于体系温度,有利于提高氨的平衡产率
”高于体系温度,有利于提高氨的平衡产率
d.“冷 ”低于体系温度,有利于提高合成氨反应速率
”低于体系温度,有利于提高合成氨反应速率
(5)方案二: 复合催化剂。
复合催化剂。
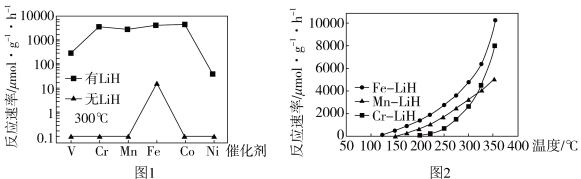
下列说法正确的是___________ 。
a. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(6)某合成氨速率方程为: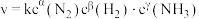 ,根据表中数据,
,根据表中数据,
___________ ;
在合成氨过程中,需要不断分离出氨的原因为___________ 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
 。
。回答下列问题:
(1)合成氨反应在常温下
(2)
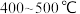 。
。(3)传统催化剂用的是铁触媒,合成氨反应在
 催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,
催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,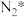 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 )判断上述反应机理中,速率控制步骤(即速率最慢步骤)为
)判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(i)

(ii)
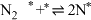
(iii)
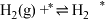
(iv)
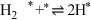
(v)

……
(…)
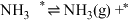
(4)针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用
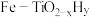 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为 时,
时, 的温度为
的温度为 ,而
,而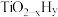 的温度为
的温度为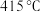 )。
)。
下列说法正确的是
a.氨气在“冷
 ”表面生成,有利于提高氨的平衡产率
”表面生成,有利于提高氨的平衡产率b.
 在“热
在“热 ”表面断裂,有利于提高合成氨反应速率
”表面断裂,有利于提高合成氨反应速率c.“热
 ”高于体系温度,有利于提高氨的平衡产率
”高于体系温度,有利于提高氨的平衡产率d.“冷
 ”低于体系温度,有利于提高合成氨反应速率
”低于体系温度,有利于提高合成氨反应速率(5)方案二:
 复合催化剂。
复合催化剂。
下列说法正确的是
a.
 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(6)某合成氨速率方程为:
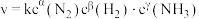 ,根据表中数据,
,根据表中数据,
| 实验 | 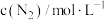 | 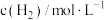 | 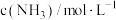 |  |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
您最近一年使用:0次
解题方法
10 . 下列实验中,操作、现象及结论都正确,且有因果关系的是
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 溶液pH变大 | 稀释后, |
B | 取两支试管,分别加入2mL5%的双氧水,试管1中加入 | 试管1产生气泡快 | 加入 |
C | 向含有ZnS和 | 生成黑色沉淀 |
|
D | 用pH试纸分别测定同浓度 | 测得NaClO溶液pH大 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 溶液由
溶液由 ,测溶液pH
,测溶液pH 的水解程度增大
的水解程度增大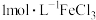 溶液2滴,试管2中加入
溶液2滴,试管2中加入
 时,双氧水分解反应的活化能较小
时,双氧水分解反应的活化能较小 的悬浊液中滴加
的悬浊液中滴加 溶液
溶液
 和NaClO溶液的pH
和NaClO溶液的pH 水解程度大于
水解程度大于


