2024高三·全国·专题练习
1 . 硫与硫的氧化物在转化过程中的能量变化如图所示:
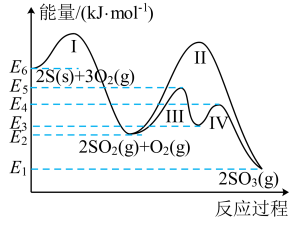
下列说法正确的是

下列说法正确的是
| A.图中的Ⅰ、Ⅱ、Ⅲ、Ⅳ中属于放热反应 |
B.S(s)的燃烧热的热化学方程式为:S(s)+O2(g)=SO2(g) ΔH=-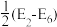 kJ/mol kJ/mol |
| C.过程Ⅱ与过程Ⅲ、Ⅳ相比,后者使用了催化剂 |
| D.相同条件下,1molSO3(g)的能量低于1molSO2(g) |
您最近半年使用:0次
2023高三·全国·专题练习
2 . 近日,中国科学院化学物理研究所李灿院士团队揭示催化剂(Co3O4)上催化水氧化产氧历程如图所示(注明: s、ms、μs表示秒、毫秒、微秒)。下列叙述错误的是

| A.第(1)步反应为总反应的控速反应 |
| B.Co原子价电子排布式为3d74s2,位于周期表中第四周期第Ⅷ族 |
| C.从总反应看,每生成标况22.4LO2必转移3mol 电子 |
| D.该反应过程中三步都断裂了极性键 |
您最近半年使用:0次
23-24高三上·重庆渝北·阶段练习
名校
解题方法
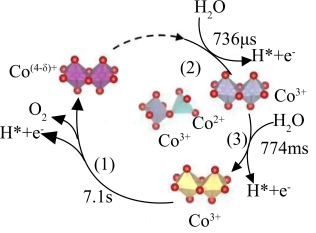
3 . 甲酸常被用于橡胶、医药等工业,一定条件下可分解生成CO和H2O。在无催化剂和有催化剂的条件下,能量与反应历程的关系分别如图1、图2所示。下列说法错误的是

| A.途径一和途径二中均涉及了极性键的断裂和生成 |
| B.ΔH1<ΔH2<0 |
| C.途径二使用了H+作为催化剂 |
D.途径二反应的快慢由生成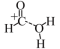 的速率决定 的速率决定 |
您最近半年使用:0次
2024-01-03更新
|
191次组卷
|
5卷引用:选择题11-14
(已下线)选择题11-14重庆市渝北中学校2023-2024学年高三上学期11月月考质量监测化学试题宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题宁夏银川市西夏区育才中学2023-2024学年高三上学期1月期末化学试题(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
23-24高三上·浙江·阶段练习
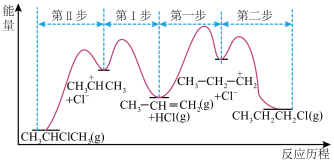
4 . 一定条件下,丙烯与 反应生成
反应生成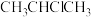 和
和 的反应历程如图所示。下列说法不正确的是
的反应历程如图所示。下列说法不正确的是
 反应生成
反应生成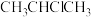 和
和 的反应历程如图所示。下列说法不正确的是
的反应历程如图所示。下列说法不正确的是
A.合成 的反应中,第一步为反应的决速步 的反应中,第一步为反应的决速步 |
B.其他条件不变,适当升高温度可以提高加成产物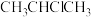 的比例 的比例 |
C.根据该反应推测,丙烯与 加成的主要产物为2-溴丙烷 加成的主要产物为2-溴丙烷 |
D.反应的主要产物为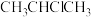 ,是由于活性中间体 ,是由于活性中间体 比 比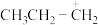 更稳定,所需活化能更低 更稳定,所需活化能更低 |
您最近半年使用:0次
23-24高三上·江西南昌·期中
名校
解题方法
5 . CO2催化加氢制CH4的反应为: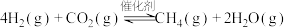 。催化剂上反应过程示意如图1所示。其他条件不变时,10min时CO2的转化率和CH4的选择性(CO2转化为甲烷的量/CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
。催化剂上反应过程示意如图1所示。其他条件不变时,10min时CO2的转化率和CH4的选择性(CO2转化为甲烷的量/CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
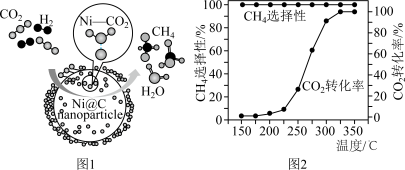
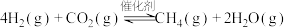 。催化剂上反应过程示意如图1所示。其他条件不变时,10min时CO2的转化率和CH4的选择性(CO2转化为甲烷的量/CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
。催化剂上反应过程示意如图1所示。其他条件不变时,10min时CO2的转化率和CH4的选择性(CO2转化为甲烷的量/CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
A.催化剂改变了 中O—C—O键的键角 中O—C—O键的键角 |
| B.150℃到350℃时,基本没有发生副反应 |
C. 催化加氢制 催化加氢制 是一个吸热反应 是一个吸热反应 |
D.使用催化剂不能改变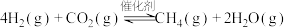 反应的△H 反应的△H |
您最近半年使用:0次
2023-12-26更新
|
290次组卷
|
3卷引用:题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
(已下线)题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)江西省南昌市2023-2024学年高三上学期11月期中三校联考化学试题江西省宜春市宜丰中学2023-2024学年高二上学期1月月考化学试题
21-22高三上·江苏·阶段练习
名校
解题方法
6 . 二氧化硫的污染治理是化学研究的重要课题。
(1)石灰石-石膏法是一种常见的“钙基固硫”方法。其中,石灰石的溶解率与脱硫效果有着密切的关系。
可将催化条件下CaCO3吸收SO2宏观反应分为三步:
i.CaCO3由固相溶解进入液相,溶解速率为RA;
ii.SO2由气相扩散进入液相,扩散速率为RB;
iii.在催化剂作用下,溶解的SO2和Ca2+发生化学反应,且反应在液相中进行,反应速率为RC。温度变化对总反应速率的影响如图所示。___________ (填“RA”、“RB”或“Rc”)控制。
②45~55℃(催化剂活性不变)曲线呈下降趋势的原因:一是二氧化硫溶解度随温度升高而降低;二是___________ 。
(2)利用MnO2与SO2反应既可消除污染又可以制备MnSO4,将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c( )随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(
)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c( )的变化产生明显差异的原因是:
)的变化产生明显差异的原因是:_______ 。 与NO2反应的离子方程式为
与NO2反应的离子方程式为___________ 。
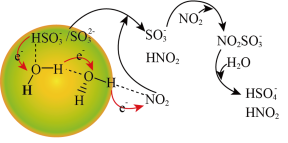
②请描述水催化促进硫酸盐形成的化学机制:通过“水分子桥”,处于纳米液滴中的 或
或 可以将电子快速转移给周围的气相NO2分子,
可以将电子快速转移给周围的气相NO2分子,___________ 。
(1)石灰石-石膏法是一种常见的“钙基固硫”方法。其中,石灰石的溶解率与脱硫效果有着密切的关系。
可将催化条件下CaCO3吸收SO2宏观反应分为三步:
i.CaCO3由固相溶解进入液相,溶解速率为RA;
ii.SO2由气相扩散进入液相,扩散速率为RB;
iii.在催化剂作用下,溶解的SO2和Ca2+发生化学反应,且反应在液相中进行,反应速率为RC。温度变化对总反应速率的影响如图所示。
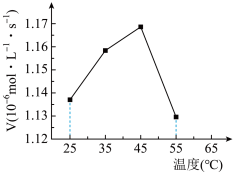
②45~55℃(催化剂活性不变)曲线呈下降趋势的原因:一是二氧化硫溶解度随温度升高而降低;二是
(2)利用MnO2与SO2反应既可消除污染又可以制备MnSO4,将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c(
 )随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(
)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c( )的变化产生明显差异的原因是:
)的变化产生明显差异的原因是: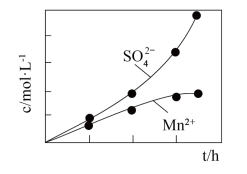
 与NO2反应的离子方程式为
与NO2反应的离子方程式为②请描述水催化促进硫酸盐形成的化学机制:通过“水分子桥”,处于纳米液滴中的
 或
或 可以将电子快速转移给周围的气相NO2分子,
可以将电子快速转移给周围的气相NO2分子,
您最近半年使用:0次
2023-12-25更新
|
271次组卷
|
5卷引用:通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)江苏省南师附中、天一中学、海安中学、海门中学四校2021-2022学年高三12月联考化学试题江苏省丹阳高级中学2023届高三上学期第一次阶段考试化学试题江苏省建湖高级中学2023-2024学年高三上学期暑期学情检测(一)化学试题江苏省如皋中学2023-2024学年高三上学期阶段考试(二) 化学试题
23-24高三上·安徽·阶段练习
解题方法
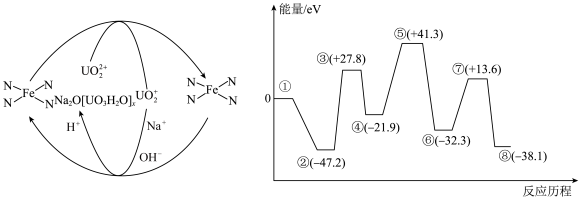
7 . 从海水中提取铀,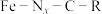 作催化剂,其反应机理、能量与反应历程的关系如图所示。
作催化剂,其反应机理、能量与反应历程的关系如图所示。
下列说法正确的是
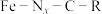 作催化剂,其反应机理、能量与反应历程的关系如图所示。
作催化剂,其反应机理、能量与反应历程的关系如图所示。
下列说法正确的是
| A.该反应机理中Fe元素化合价未发生改变 | B. 浓度过大或过小均导致反应速率降低 浓度过大或过小均导致反应速率降低 |
| C.总反应速率的决速步骤为④→⑤ | D.升高温度,可以增大反应速率和平衡转化率 |
您最近半年使用:0次
2023高三·全国·专题练习
8 . 绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措。回答下列问题:
(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下(K1、K2分别为反应I、Ⅱ的化学平衡常数):
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1 K1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1 K2
重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH3=_________ ,平衡常数K3=_________ 。(用含K1、K2的计算式表示)
(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2⇌2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。
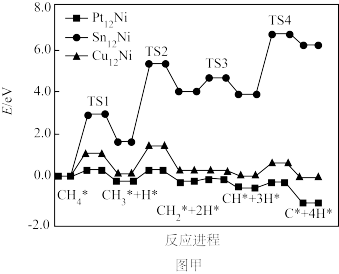
①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由小到大的关系为___________ 。
②甲烷逐步脱氢过程中,决定速率快慢的反应步骤是:___________ (用化学方程式表示)。
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2⇌2CO+2H2,同时发生副反应b:CO2+H2⇌CO+H2O,T℃时,在恒压容器中,通入2molCH4和2molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=___________ (用含P和P0的计算式表示,已知分压=总压×物质的量分数)。
(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂,CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为___________ ;650℃条件下,1000s后,氢气的体积分数快速下降的原因是___________ 。

(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下(K1、K2分别为反应I、Ⅱ的化学平衡常数):
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1 K1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1 K2
重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH3=
(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2⇌2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。

①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由小到大的关系为
②甲烷逐步脱氢过程中,决定速率快慢的反应步骤是:
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2⇌2CO+2H2,同时发生副反应b:CO2+H2⇌CO+H2O,T℃时,在恒压容器中,通入2molCH4和2molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂,CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为

您最近半年使用:0次
2023高三·全国·专题练习
9 . 甲苯(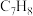 )和二甲苯(
)和二甲苯(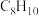 )是重要的化工原料。利用苯(
)是重要的化工原料。利用苯(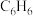 )和甲醇(
)和甲醇( )在催化剂作用下反应得到
)在催化剂作用下反应得到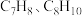 和副产物三甲苯(
和副产物三甲苯(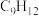 ),发生的主要反应如下:
),发生的主要反应如下:
Ⅰ.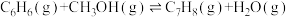
Ⅱ.
Ⅲ.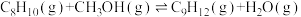
(1)500℃、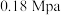 条件下,反应达到平衡时,结果如图所示。
条件下,反应达到平衡时,结果如图所示。

①由图分析,随着投料比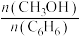 增加,
增加, 的平衡转化率
的平衡转化率___________ 。平衡时 的值
的值___________ (填“增大”、“减小”或“不变”)。
②投料比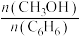 为1.0时,
为1.0时, 的平衡转化率为50%,产物中
的平衡转化率为50%,产物中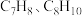 和
和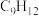 物质的量之比为6:3:1,
物质的量之比为6:3:1, 的平衡转化率为
的平衡转化率为___________ ,反应Ⅰ的平衡常数
___________ 。
(2)我国学者结合实验与计算机模拟结果,研究了反应Ⅰ在固体酸(HB)催化剂表面进行的反应历程如图所示,其中吸附在固体酸(HB)表面的物种用*标注。

①反应Ⅰ的
______ 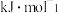 。
。
②吸附 的焓变
的焓变______ 吸附 的焓变(填“>”或“<”)。
的焓变(填“>”或“<”)。
③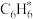 在催化剂表面转化为
在催化剂表面转化为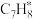 的反应方程式为
的反应方程式为______ 。
④在固体酸(HB)催化作用下,测得反应Ⅰ的速率方程为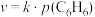 (
(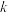 为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是
为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是______ (填标号)。
A.升高温度,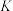 和
和 均增大 B.增大
均增大 B.增大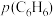 ,
,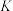 不变,
不变, 增大
增大
C.降低温度,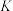 和
和 均增大 D.增大
均增大 D.增大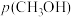 ,
,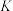 不变,
不变, 增大
增大
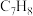 )和二甲苯(
)和二甲苯(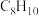 )是重要的化工原料。利用苯(
)是重要的化工原料。利用苯(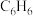 )和甲醇(
)和甲醇( )在催化剂作用下反应得到
)在催化剂作用下反应得到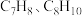 和副产物三甲苯(
和副产物三甲苯(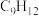 ),发生的主要反应如下:
),发生的主要反应如下:Ⅰ.
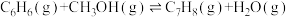
Ⅱ.

Ⅲ.
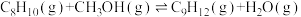
(1)500℃、
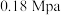 条件下,反应达到平衡时,结果如图所示。
条件下,反应达到平衡时,结果如图所示。
①由图分析,随着投料比
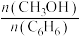 增加,
增加, 的平衡转化率
的平衡转化率 的值
的值②投料比
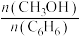 为1.0时,
为1.0时, 的平衡转化率为50%,产物中
的平衡转化率为50%,产物中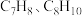 和
和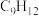 物质的量之比为6:3:1,
物质的量之比为6:3:1, 的平衡转化率为
的平衡转化率为
(2)我国学者结合实验与计算机模拟结果,研究了反应Ⅰ在固体酸(HB)催化剂表面进行的反应历程如图所示,其中吸附在固体酸(HB)表面的物种用*标注。

①反应Ⅰ的

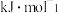 。
。②吸附
 的焓变
的焓变 的焓变(填“>”或“<”)。
的焓变(填“>”或“<”)。③
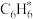 在催化剂表面转化为
在催化剂表面转化为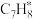 的反应方程式为
的反应方程式为④在固体酸(HB)催化作用下,测得反应Ⅰ的速率方程为
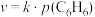 (
(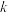 为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是
为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是A.升高温度,
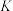 和
和 均增大 B.增大
均增大 B.增大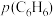 ,
,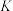 不变,
不变, 增大
增大C.降低温度,
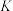 和
和 均增大 D.增大
均增大 D.增大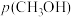 ,
,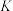 不变,
不变, 增大
增大
您最近半年使用:0次
2023高三·全国·专题练习
10 . 下列关于化学反应的调控措施说法不正确 的是________ 。
A.硫酸工业中,为使黄铁矿充分燃烧,可将矿石粉碎
B.硝酸工业中,氨的氧化使用催化剂是为了增大反应速率,提高生产效率
C.合成氨工业中,为提高氮气和氢气的利用率,采用循环操作
D.对于合成氨的反应,调控反应条件至最好,也不能使一种反应物的转化率达到100%
E.工业上增加炼铁高炉的高度可以有效降低尾气中CO的含量
F.合成氨工业中,从生产实际条件考虑,可盲目增大反应压强
G.合成氨工业中,为提高氮气和氢气的利用率,采用循环操作
A.硫酸工业中,为使黄铁矿充分燃烧,可将矿石粉碎
B.硝酸工业中,氨的氧化使用催化剂是为了增大反应速率,提高生产效率
C.合成氨工业中,为提高氮气和氢气的利用率,采用循环操作
D.对于合成氨的反应,调控反应条件至最好,也不能使一种反应物的转化率达到100%
E.工业上增加炼铁高炉的高度可以有效降低尾气中CO的含量
F.合成氨工业中,从生产实际条件考虑,可盲目增大反应压强
G.合成氨工业中,为提高氮气和氢气的利用率,采用循环操作
您最近半年使用:0次



