解题方法
1 . 某温度下反应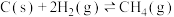 的
的 ,当各气体物质的量浓度分别为
,当各气体物质的量浓度分别为 mol·L
mol·L 、
、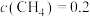 mol·L
mol·L 时,上述反应
时,上述反应
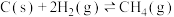 的
的 ,当各气体物质的量浓度分别为
,当各气体物质的量浓度分别为 mol·L
mol·L 、
、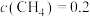 mol·L
mol·L 时,上述反应
时,上述反应| A.缺条件,无法判断 | B.逆向进行 |
| C.达到平衡状态 | D.正向进行 |
您最近一年使用:0次
2 . 乙烯是合成多种塑料的单体。我国科学家开发的特殊催化剂用 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。
主反应: 放热反应
放热反应
(1)在容积为2L的恒容密闭容器中充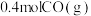 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内 的平均反应速率为
的平均反应速率为___________ 。
(2)在一定温度下,向恒容密闭容器中充入 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是___________ (填编号)。
A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高 平衡转化率的措施是
平衡转化率的措施是___________ (任填一条)。
(3)下列事实中,不能用勒夏特列原理解释的是_______。
(4)下图表示反应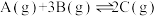 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。主反应:
 放热反应
放热反应(1)在容积为2L的恒容密闭容器中充
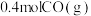 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内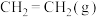 的平均反应速率为
的平均反应速率为(2)在一定温度下,向恒容密闭容器中充入
 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高
 平衡转化率的措施是
平衡转化率的措施是(3)下列事实中,不能用勒夏特列原理解释的是_______。
A.反应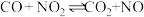 (放热反应),升高温度平衡向逆反应方向移动 (放热反应),升高温度平衡向逆反应方向移动 |
B.采用高压有利于合成氨反应: |
C.使用催化剂有利于合成氨反应: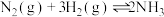 |
D.氯水中有下列平衡: ,当加入 ,当加入 溶液后溶液颜色变浅 溶液后溶液颜色变浅 |
(4)下图表示反应
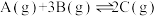 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。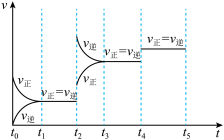
A. | B. | C. | D. |
您最近一年使用:0次
3 . 已知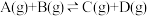 反应的平衡常数和温度的关系如下:
反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式
___________ ,
___________ 0(填“<”、“>”或“=”);
(2)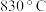 时,向一个
时,向一个 的密闭容器中充入
的密闭容器中充入 的A和
的A和 的B,若反应初始
的B,若反应初始 内A的平均反应速率
内A的平均反应速率 ,则
,则 时
时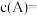
___________  ,C的物质的量为
,C的物质的量为___________  ;若反应一段时间后达到平衡,则A的转化率为
;若反应一段时间后达到平衡,则A的转化率为___________ ;如果这时向该密闭容器中再充入 氩气,平衡时A的转化率为
氩气,平衡时A的转化率为___________ 。
(3)判断该反应是否达到平衡的依据为___________ (填字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.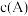 不随时间改变 d.单位时间里生成C和D的物质的量相等
不随时间改变 d.单位时间里生成C和D的物质的量相等
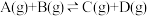 反应的平衡常数和温度的关系如下:
反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式


(2)
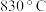 时,向一个
时,向一个 的密闭容器中充入
的密闭容器中充入 的A和
的A和 的B,若反应初始
的B,若反应初始 内A的平均反应速率
内A的平均反应速率 ,则
,则 时
时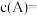
 ,C的物质的量为
,C的物质的量为 ;若反应一段时间后达到平衡,则A的转化率为
;若反应一段时间后达到平衡,则A的转化率为 氩气,平衡时A的转化率为
氩气,平衡时A的转化率为(3)判断该反应是否达到平衡的依据为
a.压强不随时间改变 b.气体的密度不随时间改变
c.
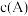 不随时间改变 d.单位时间里生成C和D的物质的量相等
不随时间改变 d.单位时间里生成C和D的物质的量相等
您最近一年使用:0次
解题方法
4 . 羰基硫( )可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将
)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将 和
和 混合加热并达到平衡:
混合加热并达到平衡: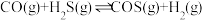
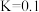 。反应前
。反应前 的物质的量为
的物质的量为 ,平衡后
,平衡后 物质的量为
物质的量为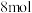 ,下列说法正确的是
,下列说法正确的是
 )可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将
)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将 和
和 混合加热并达到平衡:
混合加热并达到平衡: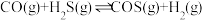
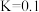 。反应前
。反应前 的物质的量为
的物质的量为 ,平衡后
,平衡后 物质的量为
物质的量为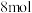 ,下列说法正确的是
,下列说法正确的是A.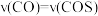 时,说明反应已达到化学平衡状态 时,说明反应已达到化学平衡状态 |
B.通入 后,正反应速率逐渐增大 后,正反应速率逐渐增大 |
C.反应前 物质的量为 物质的量为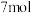 |
D. 的平衡转化率为 的平衡转化率为 |
您最近一年使用:0次
5 . 一定温度下,反应 在恒容的密闭容器中进行。下列情况不能说明反应达到平衡状态的是
在恒容的密闭容器中进行。下列情况不能说明反应达到平衡状态的是
 在恒容的密闭容器中进行。下列情况不能说明反应达到平衡状态的是
在恒容的密闭容器中进行。下列情况不能说明反应达到平衡状态的是A. 的物质的量不随时间而变化 的物质的量不随时间而变化 | B.气体的压强不随时间而变化 |
| C.CO的体积分数不随时间而变化 | D.气体的平均相对分子质量不随时间而变化 |
您最近一年使用:0次
2024-04-21更新
|
522次组卷
|
2卷引用:河南省新未来联考2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
6 . 反应 己经达到平衡状态时,下列关系成立的是
己经达到平衡状态时,下列关系成立的是
 己经达到平衡状态时,下列关系成立的是
己经达到平衡状态时,下列关系成立的是A. | B.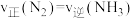 |
C. | D.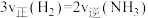 |
您最近一年使用:0次
2024-04-20更新
|
444次组卷
|
2卷引用:天津市第二十一中学2023-2024学年高一下学期第一次月考化学试卷
7 . Ⅰ.甲醇是一种理想的储氢载体,我国科学家研发的全球首套太阳能燃料合成项目被称为“液态阳光”计划,可利用太阳能电解水产生H2,再将CO2与H2转化为甲醇,以实现碳中和。
(1)下列关于甲醇(CH3OH)的说法中,正确的是___________
Ⅱ.已知,CO2生产甲醇过程主要发生以下反应:
反应Ⅰ.CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1
CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1
反应Ⅱ.CO2(g) + H2(g) CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1
CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1
反应Ⅲ.CO(g) + 2H2(g) CH3OH(g) ∆H3
CH3OH(g) ∆H3
(2)反应Ⅲ中,①活化能E(正)___________ E (逆) (填“>”、“<”或“=”);
②该反应在___________ 条件下能自发进行;
A.在高温条件下自发进行 B.在低温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(3)反应III中,CO的平衡转化率与温度的关系如图所示:___________ 。T1时,由D点到B点过程中,正、逆反应速率之间的关系:v正 ___________ v逆。(填“>”、“<”或“=”)
②向某恒温恒压密闭 容器中充入1mol CO(g)和2mol H2(g),下列能说明反应III达到平衡的是___________ ;
A.容器内混合气体的密度不再改变
B.容器内混合气体的平均相对分子质量不再改变
C.两种反应物转化率的比值不再改变
D.v正(CO)=2 v逆(H2)
③在2L恒容密闭 容器中充入2mol CO和4mol H2,在p2和T1条件下经10min达到平衡状态。在该条件下,v(H2)=___________ mol·L−1·min−1。
(4)在CO2加氢合成甲醇的体系中,①下列说法不正确的是___________ ;
A.若在绝热恒容 容器,反应I的平衡常数K保持不变,说明反应I、II都已达平衡
B.若气体的平均相对分子质量不变,说明反应I、II都已达平衡
C.体系达平衡后,若压缩体积,反应I平衡正向移动,反应II平衡不移动
D.选用合适的催化剂可以提高甲醇在单位时间内的产量
②已知:CH3OH的选择性=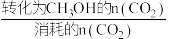 ×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是
×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是___________ ,并说明其原因
A.高温高压 B.高温低压 C.低温低压 D.低温高压
原因:___________
(5)我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式___________ 。
(1)下列关于甲醇(CH3OH)的说法中,正确的是___________
| A.甲醇在一定条件下可被氧化生成CO2 | B.甲醇储氢符合“相似相溶”原理 |
C.甲醇官能团的电子式: | D.甲醇分子是含有极性键的非极性分子 |
Ⅱ.已知,CO2生产甲醇过程主要发生以下反应:
反应Ⅰ.CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1
CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1 反应Ⅱ.CO2(g) + H2(g)
 CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1
CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1反应Ⅲ.CO(g) + 2H2(g)
 CH3OH(g) ∆H3
CH3OH(g) ∆H3(2)反应Ⅲ中,①活化能E(正)
②该反应在
A.在高温条件下自发进行 B.在低温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(3)反应III中,CO的平衡转化率与温度的关系如图所示:
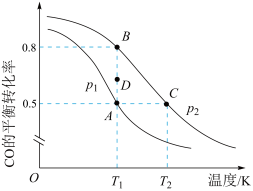
②向某
A.容器内混合气体的密度不再改变
B.容器内混合气体的平均相对分子质量不再改变
C.两种反应物转化率的比值不再改变
D.v正(CO)=2 v逆(H2)
③在2L
(4)在CO2加氢合成甲醇的体系中,①下列说法不正确的是
A.若在
B.若气体的平均相对分子质量不变,说明反应I、II都已达平衡
C.体系达平衡后,若压缩体积,反应I平衡正向移动,反应II平衡不移动
D.选用合适的催化剂可以提高甲醇在单位时间内的产量
②已知:CH3OH的选择性=
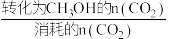 ×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是
×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是A.高温高压 B.高温低压 C.低温低压 D.低温高压
原因:
(5)我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式
您最近一年使用:0次
名校
8 . 不同温度下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生如下反应:
,发生如下反应: 相同时间内测得
相同时间内测得 的转化率随温度变化如图所示:
的转化率随温度变化如图所示: 时
时 点
点
_____  。
。
A. B.
B.  C.
C. 
(2) 时反应经过
时反应经过 达到平衡,此时
达到平衡,此时 的转化率为
的转化率为 ,计算
,计算 内
内 的平均反应速率为
的平均反应速率为_____ ,该温度时反应的平衡常数为_____ 。
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生如下反应:
,发生如下反应: 相同时间内测得
相同时间内测得 的转化率随温度变化如图所示:
的转化率随温度变化如图所示: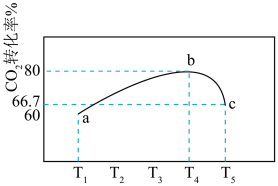
 时
时 点
点
 。
。A.
 B.
B.  C.
C. 
(2)
 时反应经过
时反应经过 达到平衡,此时
达到平衡,此时 的转化率为
的转化率为 ,计算
,计算 内
内 的平均反应速率为
的平均反应速率为
您最近一年使用:0次
名校
9 . 雾霾天气多次肆虐我国中东部地区,汽车尾气(含NO、NO2)和燃堞尾气(含SO2)是造成空气污染的原因之一。汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。_______ 。
(2)若反应中转移lmol电子,标况下消耗NO气体的体积_______ 。
(3)该反应的△H_______ 0(填“>”或“<”),△S____ 0(填“>”或“<”),是______ (填“高温自发”、“低温自发”或“不自发”)反应。
(4)在T1温度下,0~2s内的平均反应速率v(N2)=________ 。
(5)M点、N点的化学平衡常数:KM_______ KN(填“>”或“<”或“=”)
(6)能说明该反应达化学平衡状态的是_______ (不定项)。
(7)当催化剂质量一定时,若增大催化剂的表面积,则CO转化率_____ (填“增大”,“减少”或“不变”),并说明v正和v逆如何变化_____ ?
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。
(2)若反应中转移lmol电子,标况下消耗NO气体的体积
(3)该反应的△H
(4)在T1温度下,0~2s内的平均反应速率v(N2)=
(5)M点、N点的化学平衡常数:KM
(6)能说明该反应达化学平衡状态的是
| A.容器内气体的密度不再变化 | B.v正(CO2)=v逆(CO) |
| C.密闭容器内的压强不再变化 | D.K保持不变 |
(7)当催化剂质量一定时,若增大催化剂的表面积,则CO转化率
您最近一年使用:0次
名校
解题方法
10 . 尿素[CO(NH2)2]是一种重要的氮肥。工业上以CO2和NH3为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g) H2NCOONH4(s)(氨基甲酸铵) △H1=-272kJ•mol-1
H2NCOONH4(s)(氨基甲酸铵) △H1=-272kJ•mol-1
反应II:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) △H2=+138kJ•mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ•mol-1
总反应III:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3
CO(NH2)2(s)+H2O(g) △H3
(1)反应I的熵变△S______ 0(填“>”“=”或“<”),反应III的△H3=______ 。
(2)下列关于尿素合成的说法正确的是______ 。
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为2L的密闭容器中,在T℃下分解:CO(NH2)2(s) 2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。
2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。______ 。
(4)T℃时,该反应的化学平衡常数K的值为_______ 。
(5)在0—t1时间内该化学反应速率v(NH3)=______ 。
(6)若其他条件不变,t2时将容器体积压缩到1L,t3时达到新的平衡。请在图中画出t2~t4时间内c(CO2)随时间t变化的曲线______ 。
反应I:2NH3(g)+CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) △H1=-272kJ•mol-1
H2NCOONH4(s)(氨基甲酸铵) △H1=-272kJ•mol-1反应II:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) △H2=+138kJ•mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ•mol-1总反应III:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H3
CO(NH2)2(s)+H2O(g) △H3(1)反应I的熵变△S
(2)下列关于尿素合成的说法正确的是
| A.及时分离出尿素可促使反应II向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
D.保持压强不变,降低氨碳比[ ]可提高反应I中NH3的平衡转化率 ]可提高反应I中NH3的平衡转化率 |
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为2L的密闭容器中,在T℃下分解:CO(NH2)2(s)
 2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。
2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。
| A.混合气体的平均摩尔质量不变 | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
(4)T℃时,该反应的化学平衡常数K的值为
(5)在0—t1时间内该化学反应速率v(NH3)=
(6)若其他条件不变,t2时将容器体积压缩到1L,t3时达到新的平衡。请在图中画出t2~t4时间内c(CO2)随时间t变化的曲线
您最近一年使用:0次



