名校
1 . 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后呈红色,再将混合液分为5份,分别进行如下实验:
下列说法不正确的是
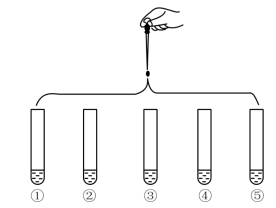 | 实验①:滴加四滴水,振荡 |
| 实验②:滴加四滴饱和的FeCl3溶液,振荡 | |
| 实验③:滴加四滴1 mol·L-1KCl溶液,振荡 | |
| 实验④:滴加四滴1 mol·L-1KSCN溶液,振荡 | |
| 实验⑤:滴加四滴1 mol·L-1NaOH 溶液,振荡 |
| A.对比实验①和②,为了证明增大反应物浓度,平衡正向移动 |
| B.对比实验①和③,为了证明增大生成物浓度,平衡逆向移动 |
| C.对比实验①和④,为了证明增大反应物浓度,平衡正向移动 |
| D.对比实验①和⑤,为了证明减小反应物浓度,平衡逆向移动 |
您最近一年使用:0次
2021-10-13更新
|
215次组卷
|
11卷引用:上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题
上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题【区级联考】北京市海淀区2019届高三上学期期中考试化学试题山西省太原市山西大学附属中学2019-2020学年高二上学期12月月考化学试题河北省石家庄市第二中学2019-2020高一下期末考试化学模拟试题(三)江苏省2021届高三上学期新高考质量检测模拟考试化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二上学期12月月考化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题(已下线)题型118 化学平衡移动的影响因素作业(十一) 温度、浓度对化学平衡的影响
名校
解题方法
2 . 下列实验中,能达到相应实验目的的是
| A | B | C | D |
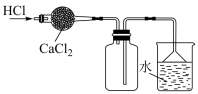 | 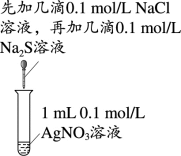 | 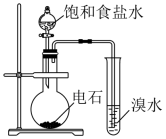 | 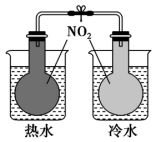 |
| 收集HCl | 证明氯化银溶解度大于硫化银 | 证明乙炔可使溴水褪色 | 验证温度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-10-23更新
|
265次组卷
|
4卷引用:上海市控江中学2022-2023学年高三上学期期中考试化学试题
上海市控江中学2022-2023学年高三上学期期中考试化学试题上海市复旦大学附属中学2021届高三上学期第一次教学质量检测化学试题(已下线)专题3.4.2 沉淀溶解平衡的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)上海行知中学2022-2023学年高三上学期第一次月考化学试题
2014·上海杨浦·三模
解题方法
3 . 以下是处于研究阶段的“人工固氮”的新方法。N2在催化剂表面与水发生反应:2N2(g)+6H2O(l) 4NH3(g)+3O2(g)-1530.4kJ
4NH3(g)+3O2(g)-1530.4kJ
完成下列填空:
(1)该反应平衡常数的表达式K=___ 。在答题纸的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注___ 。
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时___ 。
a.平衡常数K增大 b.H2O的浓度减小
c.容器内的压强增大 d.v逆(O2)减小
(3)部分实验数据见下表(条件:2L容器、催化剂、光、N21mol、水3mol、反应时间3h):
第四组容器中3小时内以NH3表示的平均反应速率是___ 。第四组容器内NH3生成量最小的可能原因是___ 。
(4)若用该反应进行工业生产,请选择适宜的条件___ 。
(5)氨水是实验室最常用的弱碱。
①向滴有少量酚酞试液的稀氨水,加入少量的NH4Cl晶体,可观察到___ ,则证明—水合氨是弱电解质。
②向盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是___ 。
a.c(C1-)=c(NH4+)>c(H+)=c(OH-)
b.c(C1-)>c(NH4+)=c(OH-)>c(H+)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+)
d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
 4NH3(g)+3O2(g)-1530.4kJ
4NH3(g)+3O2(g)-1530.4kJ完成下列填空:
(1)该反应平衡常数的表达式K=
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时
a.平衡常数K增大 b.H2O的浓度减小
c.容器内的压强增大 d.v逆(O2)减小
(3)部分实验数据见下表(条件:2L容器、催化剂、光、N21mol、水3mol、反应时间3h):
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
(4)若用该反应进行工业生产,请选择适宜的条件
(5)氨水是实验室最常用的弱碱。
①向滴有少量酚酞试液的稀氨水,加入少量的NH4Cl晶体,可观察到
②向盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是
a.c(C1-)=c(NH4+)>c(H+)=c(OH-)
b.c(C1-)>c(NH4+)=c(OH-)>c(H+)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+)
d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
您最近一年使用:0次
名校
4 . 在温度保持不变的情况下,将一定量的NO2充入注射器中后封口。图乙是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小且整个操作过程物质均为气态)。(已知:2NO2(g) N2O4(g) △H<0)
N2O4(g) △H<0)

(1)对注射器的移动轨迹判断正确的是____ 。
(2)判断下面的说法是否正确?
①d点:v正<v逆____ 。
②c点与a点相比,c(NO2)增大,c(N2О4)减小____ 。
③若注射器隔热,没有能量损失,会导致反应温度发生变化,则b、c两点的平衡常数Kb<Kc____ 。
④若在注射器中对反应 进行完全相同的操作,最后能得到相同的透光率变化趋势图象
进行完全相同的操作,最后能得到相同的透光率变化趋势图象____ 。
(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,容器中NO2物质的量的变化曲线如图。其他条件不变,请画出上述NO2在80℃时的物质的量的变化曲线____ 。

工业中利用新型催化剂M催化氨气与NO反应生成N2,从而去除NO的影响:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H=-2070kJ/mol。
5N2(g)+6H2O(g) △H=-2070kJ/mol。
相同时间内,NO的去除率随反应温度的变化曲线如图所示。

(4)在50~150℃范围内随着温度的升高,NO的去除率上升的原因可能是(任写一点):____ 。
(5)为该反应选择较合适的反应温度区间,从理论上说明理由:_____ 。
利用高效催化剂处理汽车尾气中的NO的反应为:2NO(g)+2CO(g) N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
(6)该反应在低温下能自发进行,则该反应的△H____ 0(填“>”“<”或“=”)。
 N2O4(g) △H<0)
N2O4(g) △H<0)
(1)对注射器的移动轨迹判断正确的是
| A.N→M→N | B.N→M→P | C.N→P→N | D.N→P→M |
①d点:v正<v逆
②c点与a点相比,c(NO2)增大,c(N2О4)减小
③若注射器隔热,没有能量损失,会导致反应温度发生变化,则b、c两点的平衡常数Kb<Kc
④若在注射器中对反应
 进行完全相同的操作,最后能得到相同的透光率变化趋势图象
进行完全相同的操作,最后能得到相同的透光率变化趋势图象(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,容器中NO2物质的量的变化曲线如图。其他条件不变,请画出上述NO2在80℃时的物质的量的变化曲线

工业中利用新型催化剂M催化氨气与NO反应生成N2,从而去除NO的影响:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H=-2070kJ/mol。
5N2(g)+6H2O(g) △H=-2070kJ/mol。相同时间内,NO的去除率随反应温度的变化曲线如图所示。

(4)在50~150℃范围内随着温度的升高,NO的去除率上升的原因可能是(任写一点):
(5)为该反应选择较合适的反应温度区间,从理论上说明理由:
利用高效催化剂处理汽车尾气中的NO的反应为:2NO(g)+2CO(g)
 N2(g)+2CO2(g)。
N2(g)+2CO2(g)。(6)该反应在低温下能自发进行,则该反应的△H
您最近一年使用:0次
名校
5 . 某可逆反应达到化学平衡,当条件改变后平衡向正反应方向移动。下列说法中正确的是
| A.使用了合适的催化剂 | B.反应物的浓度一定降低 |
| C.正反应速率一定增大 | D.达到新的平衡前正反应速率一定大于逆反应速率 |
您最近一年使用:0次
名校
6 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为:CO2(g)+3H2(g)⇌CH3OH(g) + H2O (g)
(1)该反应平衡常数的表达式K=_______ ;
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
(3)在5L密闭容器中充入1mol CO2和3mol H2,测得一定时间内混合气体中CH3OH的体积分数φ(CH3OH)与温度的关系如图所示。
①若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率ʋ=_______ 。
②该反应是_______ 反应(选填“吸热”或“放热”);其它条件相同时,CH3OH在a点的正反应速率_______ CH3OH在b点的正反应速率(选填“>”、“<”或“=”);解释温度低于T时,φ(CH3OH)随温度升高而逐渐增加的原因_______ 。
(1)该反应平衡常数的表达式K=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
| A.增大H2的浓度,平衡向右移动 |
| B.移去部分CH3OH,正反应速率增大 |
| C.降低反应温度,正、逆反应速率都减小 |
| D.加入催化剂,可提高CO2的平衡转化率 |
(3)在5L密闭容器中充入1mol CO2和3mol H2,测得一定时间内混合气体中CH3OH的体积分数φ(CH3OH)与温度的关系如图所示。

①若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率ʋ=
②该反应是
您最近一年使用:0次
名校
7 . CO2可与H2生成CH4:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。
(1)我国科研人员提出了以Ni/Al2O3为催化剂,上述反应的历程如图所示:

下列说法错误的是_______。
(2)在恒温(T>100℃)恒容装置中进行该反应,能判断反应已达平衡状态的是_______。
(3)将1mol CO2和4mol H2置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度升高而_______ (填“增大”或“减小”)。判断依据是_______ 。

(4)下列措施有利于提高反应中CO2的平衡转化率的是_______。
(1)我国科研人员提出了以Ni/Al2O3为催化剂,上述反应的历程如图所示:

下列说法错误的是_______。
| A.使用催化剂可有效提高反应物的平衡转化率 |
| B.该历程中每生成1mol CH4,转移8NA个电子 |
| C.在反应历程中,H-H键与C=O键断裂吸收能量 |
| D.在反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能 |
(2)在恒温(T>100℃)恒容装置中进行该反应,能判断反应已达平衡状态的是_______。
| A.混合气体密度不再改变 | B.混合气体压强不再改变 |
| C.混合气体平均摩尔质量不再改变 | D.n (CO2): n(H2) =1:4 |
(3)将1mol CO2和4mol H2置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度升高而

(4)下列措施有利于提高反应中CO2的平衡转化率的是_______。
| A.使用催化剂 | B.加压 | C.升高温度 | D.增大初始投料比n(CO2)/n(H2) |
您最近一年使用:0次
8 . 广泛使用的消毒剂
Ⅰ.消毒剂可用于餐饮、衣物、环境消毒等,是生产生活中常用物品。常见的“84”消毒液、O3等都有较强的杀菌效果,可杀灭很多常见病毒。
(1)“84”消毒液的主要成分为NaClO,该消毒液___________。(双选)
(2)化学电池应用广泛,某电池企业通过回收废旧电池生产消毒液。
①如图Cu-Zn原电池中,导线中电子流向___________ 片(填 “Zn”或“Cu”)。Cu片上发生___________ 反应(填 “氧化”或“还原”)。
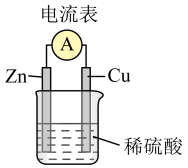
②若将铜片换成铁片,电流方向___________ 改变(填 “会”或“不会”)。
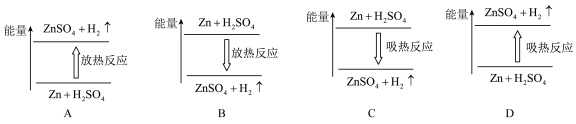
(3)若断开电路,则该反应中能量变化示意图正确的是___________ 。
Ⅱ.O3是一种清洁消毒剂,常温常压下在水溶液中发生的反应如下:2O3 3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
(4)30°C、pH=5.0时,O3的平均反应速率为___________ 。
(5)若反应达平衡后降温,则平衡向___________ 移动,正反应速率___________ (填“增大”“减小”或“不变”)。
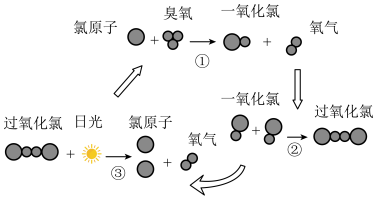
(6)大气中臭氧层能吸收和阻挡大部分紫外线进入地球。但氯原子能破坏臭氧层,其破坏过程如图所示,下列说法错误的是___________
(7)一些含硫物质也能做消毒剂。硫位于元素周期表中第___________ 周期,第___________ 族。用一个化学事实比较Cl和S的非金属性强弱___________ 。
Ⅰ.消毒剂可用于餐饮、衣物、环境消毒等,是生产生活中常用物品。常见的“84”消毒液、O3等都有较强的杀菌效果,可杀灭很多常见病毒。
(1)“84”消毒液的主要成分为NaClO,该消毒液___________。(双选)
| A.电离方程式:NaClO=Na+ + Cl- + O2- |
| B.和稀盐酸反应的产物无漂白性 |
| C.属于强电解质 |
| D.具有强氧化性 |
①如图Cu-Zn原电池中,导线中电子流向

②若将铜片换成铁片,电流方向
(3)若断开电路,则该反应中能量变化示意图正确的是

Ⅱ.O3是一种清洁消毒剂,常温常压下在水溶液中发生的反应如下:2O3
 3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。| pH t/min T/℃ | 3.0 | 4.0 | 5.0 |
| 20 | 301 | 231 | 169 |
| 30 | 158 | 108 | 54 |
| 50 | 35 | 26 | 15 |
(5)若反应达平衡后降温,则平衡向
(6)大气中臭氧层能吸收和阻挡大部分紫外线进入地球。但氯原子能破坏臭氧层,其破坏过程如图所示,下列说法错误的是___________

| A.反应中Cl作催化剂 |
| B.过氧化氯的分子式为:Cl2O2 |
| C.过氧化氯的结构式为:O-Cl-Cl-O |
| D.该过程中能量转化形式只有一种 |
您最近一年使用:0次
10-11高三上·上海杨浦·期末
9 . t℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: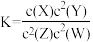 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
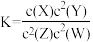 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是| A.升高温度,平衡常数K一定增大 |
| B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应 |
| C.增大压强,W(g)质量分数增加 |
| D.增大X(g)浓度,平衡向正反应方向移动 |
您最近一年使用:0次
10 . 恒压时,SO2和O2在起始浓度c(SO2)=c(O2)=2.0×10-2mol/L时发生反应:2SO2(g)+O2(g)⇌2SO3(g),测得不同温度下SO2的平衡转化率见图。有关说法正确的是


| A.若a点使用了催化剂,则b点未使用催化剂 |
| B.该反应吸热 |
| C.若将起始n(SO2)和n(O2)变为原来的一半,图象发生改变 |
D.T1℃时,平衡常数 |
您最近一年使用:0次
2020-12-29更新
|
388次组卷
|
7卷引用:上海市控江中学2022-2023学年高三上学期期中考试化学试题



