1 . 萃取剂P204对钒(V)有强萃取力,萃取平衡: 。常温下,溶液中的
。常温下,溶液中的 随时间的变化如图所示。下列叙述正确的是
随时间的变化如图所示。下列叙述正确的是

 。常温下,溶液中的
。常温下,溶液中的 随时间的变化如图所示。下列叙述正确的是
随时间的变化如图所示。下列叙述正确的是
A. min时,萃取反应已停止 min时,萃取反应已停止 |
B. min时,正反应速率大于逆反应速率 min时,正反应速率大于逆反应速率 |
C. min时,若增大 min时,若增大 ,平衡向左移动,平衡常数减小 ,平衡向左移动,平衡常数减小 |
D. min内平均速率 min内平均速率 |
您最近一年使用:0次
2024-04-01更新
|
184次组卷
|
2卷引用:贵州省安顺市部分学校2024届高三下学期二模考试化学试题
名校
2 . 下列对关系图像或实验装置(如图)的分析正确的是
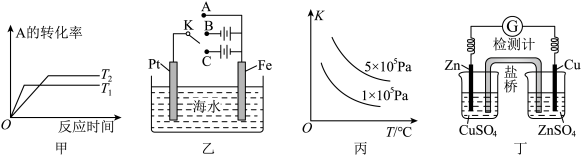
A.对于反应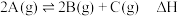 ,由图甲可知,温度 ,由图甲可知,温度 , , |
| B.利用图乙所示装置,为减缓铁的腐蚀,开关K应置于C处 |
C.图丙可表示反应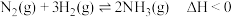 的平衡常数K随温度、压强变化的曲线 的平衡常数K随温度、压强变化的曲线 |
D.利用图丁所示装置,可实现原电池反应: |
您最近一年使用:0次
2024-03-28更新
|
410次组卷
|
2卷引用:贵州省贵阳市第一中学2023-2024学年高三下学期一模考试化学试题
解题方法
3 . 煤制天然气的过程中涉及到煤气化反应和水气变换反应.
煤气化反应Ⅰ: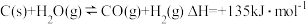
水气变换反应Ⅱ:
回答下列问题:
(1)
__________ .
(2)图一表示不同温度条件下,反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系.
①判断 和
和 由大到小的关系为
由大到小的关系为___________ ;
②若经反应Ⅰ发生后的汽气比为0.8,所得混合气体经反应Ⅱ后,得到CO与H2的物质的量之比为 ,则反应Ⅱ应选择的温度是
,则反应Ⅱ应选择的温度是__________ (填“ ”、“
”、“ ”或“
”或“ ”).
”).

(3)为了进一步探究反应条件对反应Ⅱ的影响,某活动小组设计了三个实验,实验曲线如图二所示:

①请依据图二的实验曲线补充完整表格中的实验条件:X=________ ℃,Y=________  .
.
②实验丙从开始至 末,平均反应速率
末,平均反应速率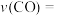
___________ .
③达平衡时CO的转化率:实验乙______ 实验丙(填“大于”、“小于”或“等于”).
④ 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数 .若往某刚性容器中投入
.若往某刚性容器中投入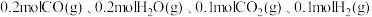 ,列简式计算井说明该反应进行的方向
,列简式计算井说明该反应进行的方向______ .
煤气化反应Ⅰ:
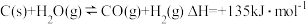
水气变换反应Ⅱ:

回答下列问题:
(1)

(2)图一表示不同温度条件下,反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系.
①判断
 和
和 由大到小的关系为
由大到小的关系为②若经反应Ⅰ发生后的汽气比为0.8,所得混合气体经反应Ⅱ后,得到CO与H2的物质的量之比为
 ,则反应Ⅱ应选择的温度是
,则反应Ⅱ应选择的温度是 ”、“
”、“ ”或“
”或“ ”).
”).
(3)为了进一步探究反应条件对反应Ⅱ的影响,某活动小组设计了三个实验,实验曲线如图二所示:
| 编号 | 温度 | 压强 | c始 | c始 |
| 甲 | 530℃ |  |  |  |
| 乙 | X | Y |  |  |
| 丙 | 630℃ |  |  |  |

①请依据图二的实验曲线补充完整表格中的实验条件:X=
 .
.②实验丙从开始至
 末,平均反应速率
末,平均反应速率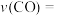
③达平衡时CO的转化率:实验乙
④
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数 .若往某刚性容器中投入
.若往某刚性容器中投入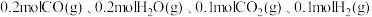 ,列简式计算井说明该反应进行的方向
,列简式计算井说明该反应进行的方向
您最近一年使用:0次
4 . 利用 和
和 合成烃、烃的衍生物等是综合利用
合成烃、烃的衍生物等是综合利用 的热点研究领域。
的热点研究领域。
(1)已知:反应I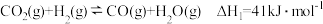
反应II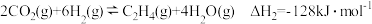
对于反应: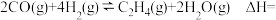
___ 。写出两种提高该反应平衡转化率的方法____ 。
(2)已知反应 。向恒容密闭容器中充入
。向恒容密闭容器中充入 和
和 ,在不同催化剂条件下发生反应,测得相同时间
,在不同催化剂条件下发生反应,测得相同时间 的转化率随温度的变化曲线如下图(忽略温度对催化剂活性的影响):
的转化率随温度的变化曲线如下图(忽略温度对催化剂活性的影响):
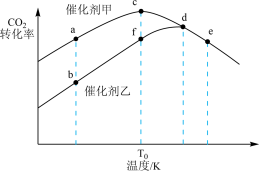
①该反应反应物的总能量___________ 生成物的总能量(填“高于”或“低于”)。
②反应在 下达平衡时,催化剂甲作用下的转化率
下达平衡时,催化剂甲作用下的转化率___________ 催化剂乙作用下的转化率(填“大于”、“等于”或“小于”)。
③一定温度下,下列叙述一定能说明该反应达到平衡状态的是___________ 。
A.容器内混合气体的密度不再变化 B.容器内的压强不再变化
C.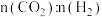 不再变化 D.
不再变化 D.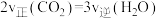
(3)反应II在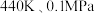 条件下进行。原料初始组成
条件下进行。原料初始组成 ,平衡时
,平衡时 和
和 物质的量相等,且
物质的量相等,且 的分压为
的分压为 ,平衡时
,平衡时 的转化率是
的转化率是___________ ,该温度时反应的平衡常数
___________  (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
 和
和 合成烃、烃的衍生物等是综合利用
合成烃、烃的衍生物等是综合利用 的热点研究领域。
的热点研究领域。(1)已知:反应I
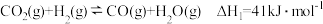
反应II
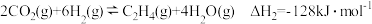
对于反应:
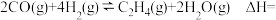
(2)已知反应
 。向恒容密闭容器中充入
。向恒容密闭容器中充入 和
和 ,在不同催化剂条件下发生反应,测得相同时间
,在不同催化剂条件下发生反应,测得相同时间 的转化率随温度的变化曲线如下图(忽略温度对催化剂活性的影响):
的转化率随温度的变化曲线如下图(忽略温度对催化剂活性的影响):
①该反应反应物的总能量
②反应在
 下达平衡时,催化剂甲作用下的转化率
下达平衡时,催化剂甲作用下的转化率③一定温度下,下列叙述一定能说明该反应达到平衡状态的是
A.容器内混合气体的密度不再变化 B.容器内的压强不再变化
C.
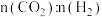 不再变化 D.
不再变化 D.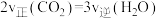
(3)反应II在
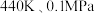 条件下进行。原料初始组成
条件下进行。原料初始组成 ,平衡时
,平衡时 和
和 物质的量相等,且
物质的量相等,且 的分压为
的分压为 ,平衡时
,平衡时 的转化率是
的转化率是
 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
解题方法
5 . 二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:
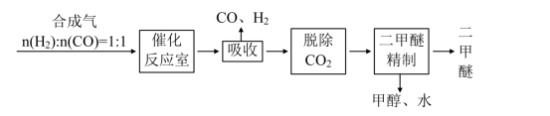
催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g) CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+ O2(g)
O2(g) CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________ 反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH= _____________ 。该反应的平衡常数表达式为:_______ ;在830℃时K=1.0,则在催化反应室中该反应的K______ 1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有__________ 。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。

a电极是________ 极,其电极反应方程式为_________________ 。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③(1)甲烷氧化可制得合成气,反应如下:CH4(g)+
 O2(g)
O2(g) CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是(2)催化反应室中总反应3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH= (3)上述反应中,可以循环使用的物质有
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。

a电极是
您最近一年使用:0次
2019-04-19更新
|
268次组卷
|
2卷引用:【全国百强校】贵州省南白中学、遵义县一中2018-2019学年高二下学期第一次联考化学试题
名校
6 . 某可逆反应正向反应过程中能量变化如图,下列说法正确的是
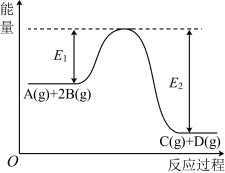

| A.该反应为吸热反应 |
| B.加入催化剂,反应速率增大,E1减小,E2减小,反应热不变 |
| C.增大压强,平衡正向移动,K增大 |
| D.当反应υ正(B)∶υ正(D)=2∶1时,到达平衡状态 |
您最近一年使用:0次
2019-04-19更新
|
433次组卷
|
2卷引用:【全国百强校】贵州省南白中学、遵义县一中2018-2019学年高二下学期第一次联考化学试题
7 . 含氮化合物在化学工业中有着重要的应用,回答下列问题:
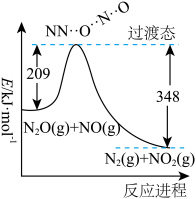
(1)由N2O和NO反应生成N2和NO2的能量变化(表示生成1molN2的能量变化)如图所示,该反应的热化学方程式为______________________ 。
(2)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=___________ ;若有1mol硝酸铵完全分解,则转移电子的数目为___________ (设NA为阿伏伽德罗常数的值)。
(3)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
①该反应在60~90s与90~120s内的平均反应速率分别约为___________ ,___________ ;比较两者大小可得出的结论是______________________ 。
②计算T℃时该反应的平衡常数为______________________ 。
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为______________________ (写出一条即可)。
(1)由N2O和NO反应生成N2和NO2的能量变化(表示生成1molN2的能量变化)如图所示,该反应的热化学方程式为

(2)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=
(3)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH-
 O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。| t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
| a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
②计算T℃时该反应的平衡常数为
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为
您最近一年使用:0次
名校
8 . 氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g) 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g) 2NO(g) △H=
2NO(g) △H=_________ kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g) 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
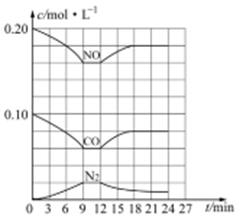
①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________ mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________ (只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________ 移动(填“正向”、“逆向”或“不”)。
(1) 已知:N2(g)+2O2(g)
 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol2NO2(g)
 O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol则N2(g)+O2(g)
 2NO(g) △H=
2NO(g) △H=(2) 若反应N2(g)+O2(g)
 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
①该反应能自发进行的条件为
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=
③第12min时改变的反应条件为
④反应在第24min时的平衡常数K=
您最近一年使用:0次
2018-05-09更新
|
1141次组卷
|
3卷引用:【全国市级联考】贵州省安顺市2018届高三适应性监测考试(三)理综化学试题
名校
解题方法
9 . 热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =_______ (用含△H1、△H2、△H3的代数式表示)。
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:
①该反应的逆反应为______ (填“吸热”或“放热”)反应;实验2的平衡常数K=________ 。
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______ (用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是______ (填序号)。
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
a.点②所示溶液中的电荷守恒式为________________________ 。
b.点③所示溶液中所有离子的浓度由大到小的顺序为___________________ 。
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=________ mol/L。
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)
 H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①该反应的逆反应为
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
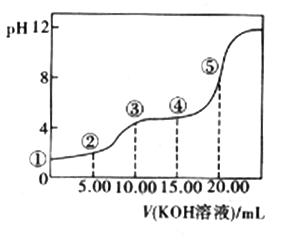
a.点②所示溶液中的电荷守恒式为
b.点③所示溶液中所有离子的浓度由大到小的顺序为
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=
您最近一年使用:0次
解题方法
10 . 煤的气化是高效、清洁的利用煤炭的重要途径之一。
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法。已知:
① C(s)+ O2 (g) = CO2 (g) ΔH =" -393.5" kJ·mol-1
② CO(g) + O2 (g) = CO2 (g) ΔH =" -283.0" kJ·mol-1
O2 (g) = CO2 (g) ΔH =" -283.0" kJ·mol-1
③ H2(g) + O2 (g) = H2O (g) ΔH =" -241.8" kJ·mol-1
O2 (g) = H2O (g) ΔH =" -241.8" kJ·mol-1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是 ,该反应的化学平衡常数K随温度的升高将 (填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g) + H2O(g) CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
① 起始时,甲容器中反应向 (填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为 。

②右图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的所有可能的条件是 。
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸钠,工作时负极反应式为 ,若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下) L。
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法。已知:
① C(s)+ O2 (g) = CO2 (g) ΔH =" -393.5" kJ·mol-1
② CO(g) +
 O2 (g) = CO2 (g) ΔH =" -283.0" kJ·mol-1
O2 (g) = CO2 (g) ΔH =" -283.0" kJ·mol-1③ H2(g) +
 O2 (g) = H2O (g) ΔH =" -241.8" kJ·mol-1
O2 (g) = H2O (g) ΔH =" -241.8" kJ·mol-1则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是 ,该反应的化学平衡常数K随温度的升高将 (填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g) + H2O(g)
 CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。| H2O | CO | CO2 | H2 | |
| 甲 n/ mol | 0.10 | 0.30 | 0.10 | 0.50 |
| 乙 n/ mol | 0.20 | 0.20 | 0 | 0 |
① 起始时,甲容器中反应向 (填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为 。

②右图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的所有可能的条件是 。
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸钠,工作时负极反应式为 ,若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下) L。
您最近一年使用:0次



