解题方法
1 . 药物Labetalol适用于治疗轻度至重度高血压和心绞痛,化合物G是合成它的前体,其合成路线如图:
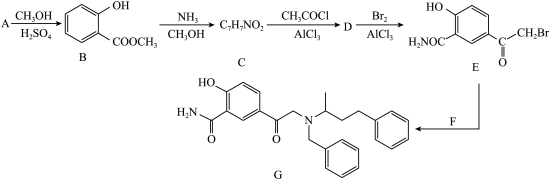
已知:苯胺( )与甲基吡啶(
)与甲基吡啶(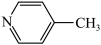 )互为同分异构体,吡啶(
)互为同分异构体,吡啶(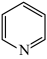 )是类似于苯的芳香化合物。回答下列问题:
)是类似于苯的芳香化合物。回答下列问题:
(1)A的化学名称为_______ 。
(2)在A→B的转化中,加入过量CH3OH的作用除作溶剂外还有_______ 。
(3)B中所含官能团的名称为_______ 。
(4)C→D的反应方程式为_______ 。
(5)由B生成C的反应类型为_______ 。
(6)F的结构简式为_______ 。
(7)C有多种同分异构体,其中满足以下条件的结构简式为______ 、______ 。
①含有六元芳香环
②能与NaHCO3溶液反应
③核磁共振氢谱的峰面积之比为2∶2∶2∶1

已知:苯胺(
 )与甲基吡啶(
)与甲基吡啶( )互为同分异构体,吡啶(
)互为同分异构体,吡啶( )是类似于苯的芳香化合物。回答下列问题:
)是类似于苯的芳香化合物。回答下列问题:(1)A的化学名称为
(2)在A→B的转化中,加入过量CH3OH的作用除作溶剂外还有
(3)B中所含官能团的名称为
(4)C→D的反应方程式为
(5)由B生成C的反应类型为
(6)F的结构简式为
(7)C有多种同分异构体,其中满足以下条件的结构简式为
①含有六元芳香环
②能与NaHCO3溶液反应
③核磁共振氢谱的峰面积之比为2∶2∶2∶1
您最近一年使用:0次
名校
2 . 我国科学家实现了喹啉并内酯的高选择性制备。合成路线如下图。

已知:
i. R―Br+R'CHO

ii. ROH+R'Br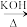 ROR'
ROR'
iii.碳碳双键直接与羟基相连不稳定
(1)试剂a为_______ ;B中官能团的电子式为_______ 。
(2)B(苯胺)具有碱性,B转化为C的反应中,使B过量可以提高ClCH2COOC2H5的平衡转化率,其原因是_______ (写出一条即可)。
(3)C→D的化学方程式为_______ 。
(4)H的结构简式为_______ ;H→I的反应类型为_______ 。
(5)K是F的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有_______ 种(不考虑立体异构)。
(6)D和I转化成J的反应过程中还生成水,理论上该过程中消耗的 与生成的J的物质的量之比为
与生成的J的物质的量之比为_______ 。

已知:
i. R―Br+R'CHO


ii. ROH+R'Br
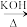 ROR'
ROR'iii.碳碳双键直接与羟基相连不稳定
(1)试剂a为
(2)B(苯胺)具有碱性,B转化为C的反应中,使B过量可以提高ClCH2COOC2H5的平衡转化率,其原因是
(3)C→D的化学方程式为
(4)H的结构简式为
(5)K是F的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有
(6)D和I转化成J的反应过程中还生成水,理论上该过程中消耗的
 与生成的J的物质的量之比为
与生成的J的物质的量之比为
您最近一年使用:0次
3 . I:运用化学反应原理知识研究如何利用CO、SO2等污染物有非常重要的意义。
(1)用CO可以合成甲醇。
已知: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H1
CO(g)+1/2O2(g)=CO2(g) △H2
H2(g)+1/2O2(g)=H2O(l) △H3
请写出由CO和H2形成CH3OH的热化学方程式___________________________________________
(2)—定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:
CO(g) +2H2(g) CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:

①下列说法正确的是__________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体平均相对分子质量恒定,反应达到平衡状态
C.若v(CO)=v(CH3OH)时,反应达到平衡状态
D.反应中,催化剂使平衡向正反应方向移动
②该反应的△H________ 0,p2_______________ p1(填“大于”“小于”或“等于”)。
③100℃时,该反应的化学平衡常数K=__________ .

II:甲醇是一种燃料,也可以作为燃料电池的原料
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置,则电池正极的电极反应式:______ ,该电池工作时,溶液中的OH-向______ 极移动,该电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为_______________________________________ ;
(1)用CO可以合成甲醇。
已知: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H1
CO(g)+1/2O2(g)=CO2(g) △H2
H2(g)+1/2O2(g)=H2O(l) △H3
请写出由CO和H2形成CH3OH的热化学方程式
(2)—定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:
CO(g) +2H2(g)
 CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
①下列说法正确的是
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体平均相对分子质量恒定,反应达到平衡状态
C.若v(CO)=v(CH3OH)时,反应达到平衡状态
D.反应中,催化剂使平衡向正反应方向移动
②该反应的△H
③100℃时,该反应的化学平衡常数K=

II:甲醇是一种燃料,也可以作为燃料电池的原料
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置,则电池正极的电极反应式:
您最近一年使用:0次
4 . 乙二醇常用作溶剂、防冻液和合成聚酯的原料。工业上有多种方法可以制备乙二醇。
(1)环氧乙烷( )直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式
)直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式__________ 。
生成的乙二醇可以继续与环氧乙烷发生副反应生成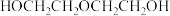 。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。
。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。
(2)碳酸乙烯酯合成法:
①反应温度为140℃,催化剂用量为2%,反应2h时,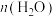 /n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
/n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
根据表中数据分析,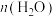 /n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是
/n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是__________ 、__________ 。(写出两条)
②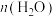 /n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是
/n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是__________ 。 、
、 、NO、
、NO、 等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。
等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。__________ 。
②已知乙二醇的沸点为197.3℃,甲醇的沸点为64.8℃,二者互溶。分离乙二醇和甲醇的实验操作为__________ ,解释二者互溶的原因__________ 。
(4)乙烯催化氧化一步法:有研究者发现, 能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下,
能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下, 的转化率与利用率如下表所示。
的转化率与利用率如下表所示。
解释60℃后 利用率变化的原因
利用率变化的原因__________ 。
(1)环氧乙烷(
 )直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式
)直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式生成的乙二醇可以继续与环氧乙烷发生副反应生成
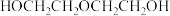 。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。
。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。(2)碳酸乙烯酯合成法:
第一步: (碳酸乙烯酯)
(碳酸乙烯酯) 
第二步: (碳酸乙烯酯)
(碳酸乙烯酯)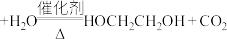
①反应温度为140℃,催化剂用量为2%,反应2h时,
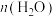 /n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
/n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
| 1.5 | 2.0 | 2.5 | 3.0 |
乙二醇含量/% | 23.2 | 96.8 | 94.4 | 90.4 |
| 0.8 | 3.2 | 5.6 | 9.6 |
碳酸乙烯酯含量/% | 72.2 | 0 | 0 | 0 |
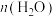 /n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是
/n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是②
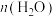 /n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是
/n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是
 、
、 、NO、
、NO、 等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。
等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。
②已知乙二醇的沸点为197.3℃,甲醇的沸点为64.8℃,二者互溶。分离乙二醇和甲醇的实验操作为
(4)乙烯催化氧化一步法:有研究者发现,
 能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下,
能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下, 的转化率与利用率如下表所示。
的转化率与利用率如下表所示。温度(℃) | 50 | 60 | 80 |
| 84.9 | 98.4 | 99.8 |
| 67.2 | 67.8 | 55.5 |
 利用率变化的原因
利用率变化的原因
您最近一年使用:0次
名校
解题方法
5 . 以 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一,反应原理为:
资源化利用的方式之一,反应原理为:
反应Ⅰ: 。
。
已知: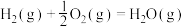
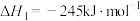
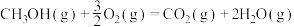
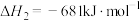
回答下列问题:
(1)计算上述合成甲醇反应的焓变
__________  。合成过程中借助高分子选择性吸水膜可有效提高
。合成过程中借助高分子选择性吸水膜可有效提高 平衡利用率,其原因是
平衡利用率,其原因是__________ 。
(2)关于反应Ⅰ的说法,正确的是__________ 。
A.有利于减少碳排放,实现碳中和
B.降低温度可提高 含量,工业生产时应控制温度越低越好
含量,工业生产时应控制温度越低越好
C.当气体密度保持不变时,反应一定达到平衡状态
(3)在恒压密闭容器中通入 和
和 的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:__________ ℃。
②随着温度升高,反应速率加快,甲醇的时空收率增大。继续升高温度,甲醇的时空收率反而降低的原因可能是__________ 。
③220℃时,氢气的平均反应速率为__________ 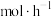 。
。
(4) 催化加氢制甲醇过程中,存在竞争的副反应主要是:
催化加氢制甲醇过程中,存在竞争的副反应主要是:

在恒温、压强为p的反应条件中, 和
和 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
__________ 。(列出计算式即可,用平衡分压代替平衡浓度,分压=总压×物质的量分数,甲醇的选择性 %)
%)
 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一,反应原理为:
资源化利用的方式之一,反应原理为:反应Ⅰ:
 。
。已知:
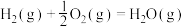
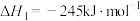
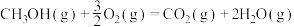
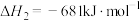
回答下列问题:
(1)计算上述合成甲醇反应的焓变

 。合成过程中借助高分子选择性吸水膜可有效提高
。合成过程中借助高分子选择性吸水膜可有效提高 平衡利用率,其原因是
平衡利用率,其原因是(2)关于反应Ⅰ的说法,正确的是
A.有利于减少碳排放,实现碳中和
B.降低温度可提高
 含量,工业生产时应控制温度越低越好
含量,工业生产时应控制温度越低越好C.当气体密度保持不变时,反应一定达到平衡状态
(3)在恒压密闭容器中通入
 和
和 的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
②随着温度升高,反应速率加快,甲醇的时空收率增大。继续升高温度,甲醇的时空收率反而降低的原因可能是
③220℃时,氢气的平均反应速率为
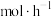 。
。(4)
 催化加氢制甲醇过程中,存在竞争的副反应主要是:
催化加氢制甲醇过程中,存在竞争的副反应主要是:

在恒温、压强为p的反应条件中,
 和
和 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
 %)
%)
您最近一年使用:0次
解题方法
6 . 合成气(CO+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品。
(1)煤化工中生产合成气的反应为:C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.5kJ·mol-1
CO(g)+H2(g) ΔH=+131.5kJ·mol-1
①判断该反应的自发性条件___________ ;
②在恒温恒容下,同时放入C(s)、H2O(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H2O(g) CO(g)+H2(g)已达到平衡的是
CO(g)+H2(g)已达到平衡的是___________ 。
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH—O键断裂的同时有1molH—H键断裂
D.混合气体的平均相对分子质量保持不变
(2)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g) 2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
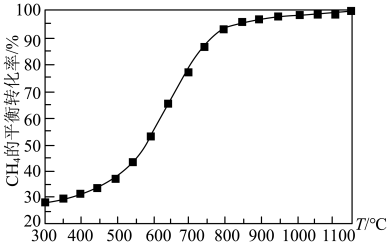
①请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线________ 。
②现有实验测得反应2CH4(g)+O2(g) 2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
最佳碳氧比[n(CH4)/n(O2)]为___________ 。
(1)煤化工中生产合成气的反应为:C(s)+H2O(g)
 CO(g)+H2(g) ΔH=+131.5kJ·mol-1
CO(g)+H2(g) ΔH=+131.5kJ·mol-1①判断该反应的自发性条件
②在恒温恒容下,同时放入C(s)、H2O(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H2O(g)
 CO(g)+H2(g)已达到平衡的是
CO(g)+H2(g)已达到平衡的是A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH—O键断裂的同时有1molH—H键断裂
D.混合气体的平均相对分子质量保持不变
(2)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g)
 2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
①请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线
②现有实验测得反应2CH4(g)+O2(g)
 2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)| 碳氧比[n(CH4)/n(O2)] | 1︰0.25 | 1︰0.5 | 1︰1 | 1︰1.25 |
| CH4转化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2选择性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |
您最近一年使用:0次
名校
解题方法
7 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.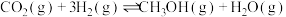
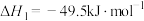
Ⅱ.

Ⅲ.

回答下列问题:
(1)
___________ kJ⋅mol-1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为___________ mol/L(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________ 。
(3)不同压强下,按照 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
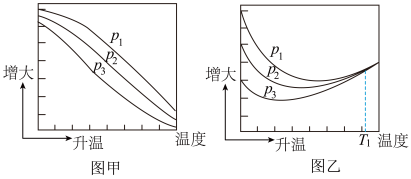
已知: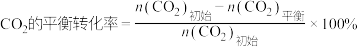
CH3OH的平衡产率=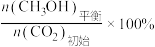
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
(5)甲醇燃料电池中甲醇在___________ (填“正”或“负”)极发生反应,酸性条件下其正极的电极反应式为___________ 。
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为___________ 。
Ⅰ.
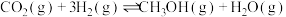
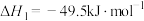
Ⅱ.


Ⅲ.


回答下列问题:
(1)

(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中
 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为(3)不同压强下,按照
 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:
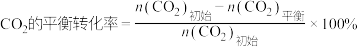
CH3OH的平衡产率=
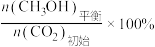
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
(5)甲醇燃料电池中甲醇在
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为
您最近一年使用:0次
2024-03-16更新
|
237次组卷
|
2卷引用:山西省晋城市第一中学校2023-2024学年高三下学期开学考试理综化学试题
解题方法
8 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以 和
和 为原料合成尿素
为原料合成尿素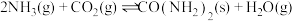
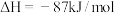 。
。
(1)有利于提高 平衡转化率的措施是___________(填序号)。
平衡转化率的措施是___________(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图所示:
第一步: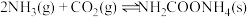

第二步: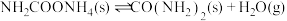


___________  。
。
②决定该反应速率是___________ 反应(填“第一步”或“第二步”),理由是___________ 。
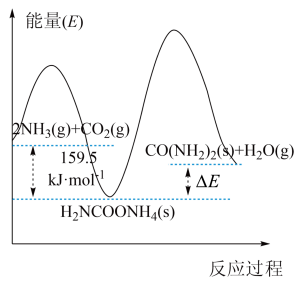
Ⅱ.以和催化重整制备合成气: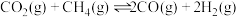 。
。
(3)在密闭容器中通入物质的量均为 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应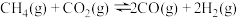 ,
, 的平衡转化率随温度、压强的变化关系如图所示。
的平衡转化率随温度、压强的变化关系如图所示。___________ (填序号)。
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率: D.同时断裂
D.同时断裂 键和
键和 键
键
②由图可知,压强
___________  (填“>”“<”或“=”,下同);
(填“>”“<”或“=”,下同); 点速率
点速率
___________ 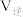 。
。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则
,则 点对应温度下的
点对应温度下的
___________ (用含 的代数式表示)。
的代数式表示)。
Ⅲ.电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:___________ 。
I.以
 和
和 为原料合成尿素
为原料合成尿素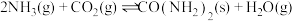
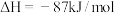 。
。(1)有利于提高
 平衡转化率的措施是___________(填序号)。
平衡转化率的措施是___________(填序号)。| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图所示:
第一步:
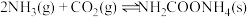

第二步:
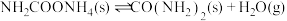


 。
。②决定该反应速率是
Ⅱ.以和催化重整制备合成气:
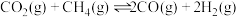 。
。(3)在密闭容器中通入物质的量均为
 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应 ,
, 的平衡转化率随温度、压强的变化关系如图所示。
的平衡转化率随温度、压强的变化关系如图所示。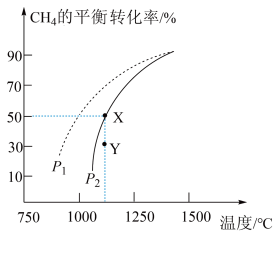
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率:
 D.同时断裂
D.同时断裂 键和
键和 键
键②由图可知,压强

 (填“>”“<”或“=”,下同);
(填“>”“<”或“=”,下同); 点速率
点速率
 。
。③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,则
,则 点对应温度下的
点对应温度下的
 的代数式表示)。
的代数式表示)。Ⅲ.电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:
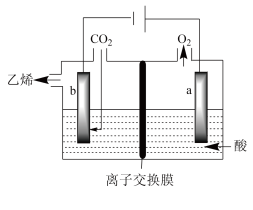
您最近一年使用:0次
解题方法
9 . 丙烯(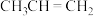 )是重要的有机合成单体,常用丙烷(
)是重要的有机合成单体,常用丙烷( )为原料合成。回答下列问题:
)为原料合成。回答下列问题:
(1)加热条件下,以 和丙烷为原料合成丙烯的反应为
和丙烷为原料合成丙烯的反应为 。
。
①上述反应过程中,能量的变化形式为___________ 。
②其他条件不变,增大压强,丙烷的平衡转化率___________ (填“增大”“减小”或“不变”,下同);升高温度,混合气体的平均摩尔质量___________ 。
(2)在高效催化剂作用下,丙烷脱氢生成丙烯的反应如下: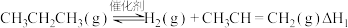 。
。
①已知断裂或形成1mol共价键需要吸收或放出的能量数据如下表所示:
则
___________ 。若该反应的活化能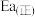 为
为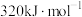 ,则该反应逆反应的活化能
,则该反应逆反应的活化能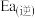 为
为___________  。
。
②其他条件不变时,在不同催化剂(M、N、P)作用下,反应进行相同时间后,丙烷的转化率随反应温度的变化如图所示。500℃时,三种催化剂(M、N、P)的催化活性由高到低的顺序为___________ ;b点丙烷的转化率高于a点的原因是___________ 。

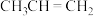 )是重要的有机合成单体,常用丙烷(
)是重要的有机合成单体,常用丙烷( )为原料合成。回答下列问题:
)为原料合成。回答下列问题:(1)加热条件下,以
 和丙烷为原料合成丙烯的反应为
和丙烷为原料合成丙烯的反应为 。
。①上述反应过程中,能量的变化形式为
②其他条件不变,增大压强,丙烷的平衡转化率
(2)在高效催化剂作用下,丙烷脱氢生成丙烯的反应如下:
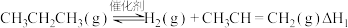 。
。①已知断裂或形成1mol共价键需要吸收或放出的能量数据如下表所示:
| 共价键 |  |  |  |  |
能量( ) ) | 345 | 412 | 615 | 436 |

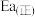 为
为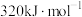 ,则该反应逆反应的活化能
,则该反应逆反应的活化能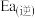 为
为 。
。②其他条件不变时,在不同催化剂(M、N、P)作用下,反应进行相同时间后,丙烷的转化率随反应温度的变化如图所示。500℃时,三种催化剂(M、N、P)的催化活性由高到低的顺序为

您最近一年使用:0次
10 . 研究 的综合利用对促进“低碳经济”的发展有重要意义。
的综合利用对促进“低碳经济”的发展有重要意义。
Ⅰ.人类活动排放过量的 会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取
会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取 。
。
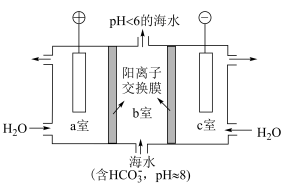
(1)c室发生的电极反应式为________ 。
(2)a室产生的______ 透过离子交换膜进入b室,与b室中的 发生反应,离子方程式为
发生反应,离子方程式为________ 。
Ⅱ. 与
与 合成二甲醚
合成二甲醚 是一种
是一种 转化的方法,其过程中主要发生下列反应:
转化的方法,其过程中主要发生下列反应:
反应①:
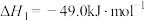
反应②:
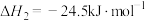
反应③:
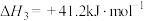
(3)写出 与
与 一步合成二甲醚(反应④)的热化学方程式:
一步合成二甲醚(反应④)的热化学方程式:________ 。
(4)有利于提高反应④平衡转化率的条件是_________(填字母)。
(5)在恒压、 和
和 起始物质的量之比为1:3的条件下,
起始物质的量之比为1:3的条件下, 平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。

 的选择性
的选择性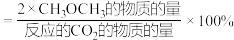 。
。
关于合成二甲醚工艺的理解,下列说法正确的是___________(填字母)。
(6)一定温度下,向容积为2L的恒容密闭容器中充入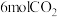 和
和 ,仅发生反应Ⅰ:
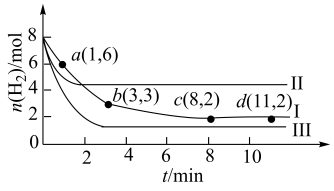
,仅发生反应Ⅰ:
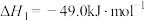 ,测得
,测得 随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
 的综合利用对促进“低碳经济”的发展有重要意义。
的综合利用对促进“低碳经济”的发展有重要意义。Ⅰ.人类活动排放过量的
 会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取
会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取 。
。
(1)c室发生的电极反应式为
(2)a室产生的
 发生反应,离子方程式为
发生反应,离子方程式为Ⅱ.
 与
与 合成二甲醚
合成二甲醚 是一种
是一种 转化的方法,其过程中主要发生下列反应:
转化的方法,其过程中主要发生下列反应:反应①:

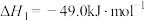
反应②:

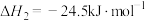
反应③:

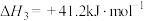
(3)写出
 与
与 一步合成二甲醚(反应④)的热化学方程式:
一步合成二甲醚(反应④)的热化学方程式:(4)有利于提高反应④平衡转化率的条件是_________(填字母)。
| A.高温高压 | B.低温低压 | C.高温低压 | D.低温高压 |
(5)在恒压、
 和
和 起始物质的量之比为1:3的条件下,
起始物质的量之比为1:3的条件下, 平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
 的选择性
的选择性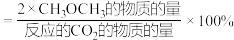 。
。关于合成二甲醚工艺的理解,下列说法正确的是___________(填字母)。
A.反应④在A点和B点时的化学平衡常数: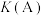 小于 小于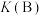 |
B.当温度、压强一定时,在原料气( 和 和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率 的比例不变)中添加少量惰性气体,有利于提高平衡转化率 |
| C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低 |
| D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键 |
(6)一定温度下,向容积为2L的恒容密闭容器中充入
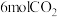 和
和 ,仅发生反应Ⅰ:
,仅发生反应Ⅰ:
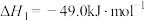 ,测得
,测得 随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
A.该反应在0~8min内 的平均反应速率是 的平均反应速率是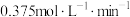 |
| B.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
C.保持温度不变,若起始时向上述容器中充入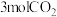 和 和 ,则平衡时 ,则平衡时 的体积分数等于20% 的体积分数等于20% |
D.保持温度不变,若起始时向上述容器中充入 、 、 、 、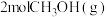 和 和 ,则此时反应向正反应方向进行。 ,则此时反应向正反应方向进行。 |
您最近一年使用:0次

 含量/%
含量/%

