21-22高二·浙江·期中
解题方法
1 . CH3COOH是食醋的主要成分,用化学反应原理可以研究其性质。
(1)气态CH3COOH中存在平衡2CH3COOH (CH3COOH)2 △H<0, 若要准确测定CH3COOH的相对分子质量,应选用的条件是___________。
(CH3COOH)2 △H<0, 若要准确测定CH3COOH的相对分子质量,应选用的条件是___________。
(2)用滴定法可以测定食醋中醋酸的含量,用酸式滴定管取10.00mL这种市售食醋,置于已知烧杯中称得其质量为12.50g,再稀释至100mL,滴定时每次取20.00 mL于锥形瓶中,选用的标准溶液是0.1125 mol/LNaOH溶液滴定至终点,平均每次消耗NaOH溶液20.00mL。
①该实验中的指示剂应选择___________ (填“酚酞”、“甲基橙”或“石蕊”),滴定终点的现象为___________ 。
②该食醋中CH3COOH的质量分数为___________ (CH3COOH的相对分子质量为60,结果保留三位有效数字)。
③滴定过程中下列操作会导致测定的CH3COOH的质量分数偏小的是(其它操作均正确)___________ 。
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分无气泡,在滴定终点读数时发现气泡
C.达到滴定终点时,俯视溶液凹液面最低点读数
D.滴定过程中,部分NaOH溶液滴到锥形瓶外
(1)气态CH3COOH中存在平衡2CH3COOH
 (CH3COOH)2 △H<0, 若要准确测定CH3COOH的相对分子质量,应选用的条件是___________。
(CH3COOH)2 △H<0, 若要准确测定CH3COOH的相对分子质量,应选用的条件是___________。| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
①该实验中的指示剂应选择
②该食醋中CH3COOH的质量分数为
③滴定过程中下列操作会导致测定的CH3COOH的质量分数偏小的是(其它操作均正确)
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分无气泡,在滴定终点读数时发现气泡
C.达到滴定终点时,俯视溶液凹液面最低点读数
D.滴定过程中,部分NaOH溶液滴到锥形瓶外
您最近一年使用:0次
2 . 回答下列问题:
(1)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为___ 反应(填“吸热”或“放热“),且m+n___ p(填“>”“=”或“<”)。
②减压使容器体积增大时,A的质量分数___ 。(填“增大”、“减小”或“不变”,下同),平均相对分子质量___ 。
③若加入B(维持体积不变),则A的转化率___ ;B的百分含量___ 。
④若升高温度,则平衡时B、C的浓度之比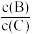 将
将___ 。
⑤若加入催化剂,平衡时气体混合物的总物质的量___ 。
Ⅱ.在一个体积为2L的密闭容器中,高温下发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。

(2)反应在1min时第一次达到平衡状态,固体的质量增加了3.2g。用CO2的浓度变化表示的反应速率v(CO2)=___ 。
(3)反应进行至2min时,若只改变温度,曲线发生的变化如图所示,3min时再次达到平衡,则ΔH__ 0(填“>”“<”或“=”)。
(4)5min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是___ (填写编号)。
A.v(正)先增大后减小 B.v(正)先减小后增大
C.v(逆)先增大后减小 D.v(逆)先减小后增大
表示n(CO2)变化的曲线是___ (填写图中曲线的字母编号)。
(5)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:___ 。
(1)现有反应:mA(g)+nB(g)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:①该反应的逆反应为
②减压使容器体积增大时,A的质量分数
③若加入B(维持体积不变),则A的转化率
④若升高温度,则平衡时B、C的浓度之比
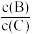 将
将⑤若加入催化剂,平衡时气体混合物的总物质的量
Ⅱ.在一个体积为2L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)
 FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
(2)反应在1min时第一次达到平衡状态,固体的质量增加了3.2g。用CO2的浓度变化表示的反应速率v(CO2)=
(3)反应进行至2min时,若只改变温度,曲线发生的变化如图所示,3min时再次达到平衡,则ΔH
(4)5min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是
A.v(正)先增大后减小 B.v(正)先减小后增大
C.v(逆)先增大后减小 D.v(逆)先减小后增大
表示n(CO2)变化的曲线是
(5)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:
您最近一年使用:0次
名校
解题方法
3 . 工业上利用锌焙砂(主要成分为 ,含有少量
,含有少量 、
、 、
、 等)生产高纯
等)生产高纯 的流程示意图如下。
的流程示意图如下。 溶液和氨水“浸出”锌焙砂。
溶液和氨水“浸出”锌焙砂。
①“浸出”前,锌焙砂预先粉碎的目的是_____ 。
②通过“浸出”步骤,锌焙砂中的 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为_____ 。
(2)“浸出”时 转化为
转化为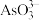 。“除砷”步骤①中用
。“除砷”步骤①中用 作氧化剂。
作氧化剂。
i.指出 中
中 与
与 的化合价:
的化合价:_____ 。
ii.步骤①的离子方程式为_____ 。
(3)“除重金属”时加入 溶液。滤渣Ⅱ中含有的主要物质是
溶液。滤渣Ⅱ中含有的主要物质是_____ 和 。
。
(4)“蒸氨”时会出现白色固体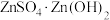 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:_____ 。
(5)“沉锌”步骤①中加入足量 溶液将白色固体转化为
溶液将白色固体转化为 的离子方程式为
的离子方程式为_____ 。
(6)“煅烧”步骤中,不同温度下, 分解的失重曲线和产品
分解的失重曲线和产品 的比表面积变化情况如图甲、图乙所示。
的比表面积变化情况如图甲、图乙所示。
已知:i.固体失重质量分数=
ii.比表面积指单位质量固体所具有的总面积;比表面积越大,产品 的活性越高。
的活性越高。 ,300min后固体失重质量分数为33.3%,则
,300min后固体失重质量分数为33.3%,则 的分解率为
的分解率为_____ %(保留到小数点后一位)。
②根据图1和图2,获得高产率( 分解率
分解率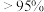 )、高活性(
)、高活性( 比表面积
比表面积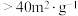 )产品
)产品 的最佳条件是
的最佳条件是_____ (填字母序号)。
a.恒温280℃,60~120min
b.恒温300℃,240~300min
c.恒温350℃,240~300min
d.恒温550℃,60~120min
(7)该流程中可循环利用的物质有_____ 。
 ,含有少量
,含有少量 、
、 、
、 等)生产高纯
等)生产高纯 的流程示意图如下。
的流程示意图如下。
已知: 结构如图所示
结构如图所示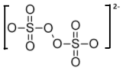
 溶液和氨水“浸出”锌焙砂。
溶液和氨水“浸出”锌焙砂。①“浸出”前,锌焙砂预先粉碎的目的是
②通过“浸出”步骤,锌焙砂中的
 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(2)“浸出”时
 转化为
转化为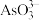 。“除砷”步骤①中用
。“除砷”步骤①中用 作氧化剂。
作氧化剂。i.指出
 中
中 与
与 的化合价:
的化合价:ii.步骤①的离子方程式为
(3)“除重金属”时加入
 溶液。滤渣Ⅱ中含有的主要物质是
溶液。滤渣Ⅱ中含有的主要物质是 。
。(4)“蒸氨”时会出现白色固体
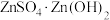 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)“沉锌”步骤①中加入足量
 溶液将白色固体转化为
溶液将白色固体转化为 的离子方程式为
的离子方程式为(6)“煅烧”步骤中,不同温度下,
 分解的失重曲线和产品
分解的失重曲线和产品 的比表面积变化情况如图甲、图乙所示。
的比表面积变化情况如图甲、图乙所示。已知:i.固体失重质量分数=

ii.比表面积指单位质量固体所具有的总面积;比表面积越大,产品
 的活性越高。
的活性越高。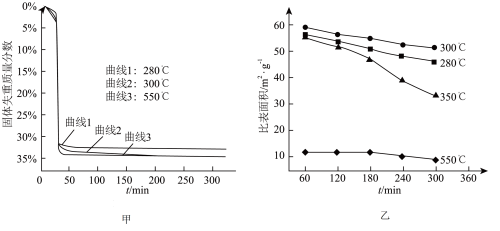
 ,300min后固体失重质量分数为33.3%,则
,300min后固体失重质量分数为33.3%,则 的分解率为
的分解率为②根据图1和图2,获得高产率(
 分解率
分解率 )、高活性(
)、高活性( 比表面积
比表面积 )产品
)产品 的最佳条件是
的最佳条件是a.恒温280℃,60~120min
b.恒温300℃,240~300min
c.恒温350℃,240~300min
d.恒温550℃,60~120min
(7)该流程中可循环利用的物质有
您最近一年使用:0次
4 . 某小组同学探究铜和浓硝酸的反应,进行如下实验:
实验1:分别取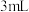 浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如下:
浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如下:
(1)写出铜和浓硝酸反应的离子反应方程式:_______ 。
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜质量分数较高,溶液呈绿色;
猜想2: 溶解在硝酸铜溶液中,溶液呈绿色。
溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1是否合理,并说明理由:_____ 。
(3)取⑤中溶液,_____ (填操作和现象),证实猜想2成立。
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
结合物质性质和上述实验现象,下列推测合理的是_______(填字母序号)。
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸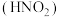 ”可能是实验①中溶液显绿色的主要原因
”可能是实验①中溶液显绿色的主要原因
ii. 在溶液中存在:
在溶液中存在:
反应1: (慢)
(慢)
反应2: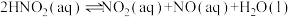 (快)
(快)
结合信息及反应原理解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因_______ 。
(6)小组同学为确认亚硝酸参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
实验中加入的固体物质是_______ (填化学式),加入 后溶液迅速变蓝可能的原因是化学方程式表示):
后溶液迅速变蓝可能的原因是化学方程式表示):  ,
,_______ ,_______ 。
实验1:分别取
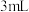 浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如下:
浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如下:| 编号 | ① | ② | ③ | ④ | ⑤ |
| 铜粉质量 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
| 溶液颜色 | 绿色 | 草绿色 | 蓝绿色偏绿 | 蓝绿色偏蓝 | 蓝色 |
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜质量分数较高,溶液呈绿色;
猜想2:
 溶解在硝酸铜溶液中,溶液呈绿色。
溶解在硝酸铜溶液中,溶液呈绿色。依据实验1中的现象,判断猜想1是否合理,并说明理由:
(3)取⑤中溶液,
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
| 通入气体 | 氮气 | 空气 |
| 现象 | 液面上方出现明显的红棕色气体,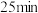 后溶液变为蓝色 后溶液变为蓝色 | 液面上方出现明显的红棕色气体,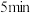 后溶液变为蓝 后溶液变为蓝 |
A.(1)中溶液通入 时, 时, 被缓慢氧化为 被缓慢氧化为 |
| B.(1)中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化 |
C.空气中的 溶于水显酸性,促进了溶液变蓝色 溶于水显酸性,促进了溶液变蓝色 |
| D.加热溶液①后,能观察到溶液变蓝的现象 |
i.“可溶性铜盐中溶解亚硝酸
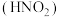 ”可能是实验①中溶液显绿色的主要原因
”可能是实验①中溶液显绿色的主要原因ii.
 在溶液中存在:
在溶液中存在:反应1:
 (慢)
(慢)反应2:
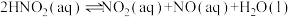 (快)
(快)结合信息及反应原理解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因
(6)小组同学为确认亚硝酸参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
| 加入物质 | _______固体 | 3滴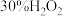 溶液 溶液 | 3滴水 |
| 现象 | 溶液绿色变深 | 溶液迅速变为蓝色 | 溶液颜色几乎不变 |
 后溶液迅速变蓝可能的原因是化学方程式表示):
后溶液迅速变蓝可能的原因是化学方程式表示):  ,
,
您最近一年使用:0次
5 . 氯化亚铜( )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下: 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。
(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是___________ 。
(2)步骤2是溶解过程,溶解时反应的离子方程式___________ 。
(3)步骤3为主反应, 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。___________ ;
②比较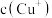 相对大小:A点
相对大小:A点___________ C点(填“>”、“<”或“=”);
③提高C点状态混合物中 沉淀率的措施是
沉淀率的措施是___________ ;
(4)步骤4进行的实验操作是___________ ;
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是___________ 。用乙醇洗涤的目的是___________ 。
(6)产品纯度测定:称取 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。
① 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是___________ 。
②产品中 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为___________ 。
 )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下:
 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是
(2)步骤2是溶解过程,溶解时反应的离子方程式
(3)步骤3为主反应,
 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。
②比较
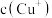 相对大小:A点
相对大小:A点③提高C点状态混合物中
 沉淀率的措施是
沉淀率的措施是(4)步骤4进行的实验操作是
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是
(6)产品纯度测定:称取
 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。①
 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是②产品中
 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为
您最近一年使用:0次
2023-05-31更新
|
709次组卷
|
7卷引用:北京市朝阳区2023届高三下学期三模化学试题
解题方法
6 . 在一定条件下,反应x A+yB zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是_______ ;
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向______ (填“正”或“逆”)反应方向移动;
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为____ 态;
(4)加热后C的质量分数减少,则正反应是________ (填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变___ (填“大”或“小”)。
 zC达到平衡:
zC达到平衡:(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为
(4)加热后C的质量分数减少,则正反应是
您最近一年使用:0次
2022-12-05更新
|
48次组卷
|
2卷引用:贵州省金沙县精诚中学2021-2022学年高二上学期期中理综化学试题
解题方法
7 . 铜基催化剂催化甲醇水蒸气重整制氢是液体燃料制氢的重要方向,主要包含甲醇水蒸气重整反应。甲醇分解反应和水气变换反应,具体反应方程式如下:
Ⅰ.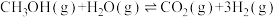
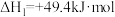
Ⅱ.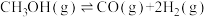

Ⅲ.
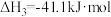
回答下列问题:
(1)则
_______ kJ⋅mol 。
。
(2)有利于提高甲醇平衡转化率的是_______ (填标号)。
A.增加 的用量
的用量
B.恒温恒压条件下通入Ar
C.升高温度
D.选择更高效的催化剂
E.及时分离出
(3)一定条件下,向压强为 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中
物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中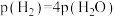 ,
,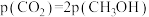 ,此时
,此时 的产率为
的产率为_______ ,反应Ⅱ的以分压表示的化学平衡常数 为
为_____ (用含 的代数式表示)。
的代数式表示)。
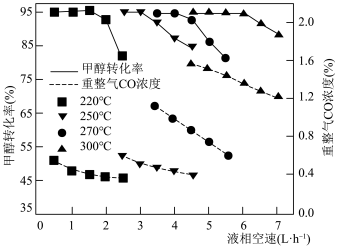
(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是_______ ,制氢产物可以用于车载燃料电池,CO含量太高会对电池产生巨大危害。甲醇水蒸气重整制氢的适宜条件是_______ ℃,_______ L·h 。
。 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。_______ 。
Ⅰ.
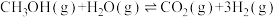
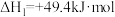
Ⅱ.
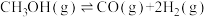

Ⅲ.

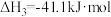
回答下列问题:
(1)则

 。
。(2)有利于提高甲醇平衡转化率的是
A.增加
 的用量
的用量B.恒温恒压条件下通入Ar
C.升高温度
D.选择更高效的催化剂
E.及时分离出

(3)一定条件下,向压强为
 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中
物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中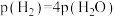 ,
,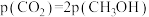 ,此时
,此时 的产率为
的产率为 为
为 的代数式表示)。
的代数式表示)。(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是
 。
。
 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。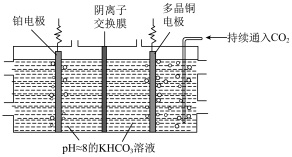
您最近一年使用:0次
8 . 五氧化二钒(V2O5)广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5新工艺流程如图:

已知:a.部分含钒物质常温下在水中溶解性如表所示:
b.VO +2OH-
+2OH- VO
VO +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为____ (写两条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_____ (填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式:____ 。
(4)生成VO 的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式:
的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式:____ 。
(5)在第II步反应中需要加入氨水,结合化学用语,用平衡移动原理解释加入氨水的一种作用为_____ 。
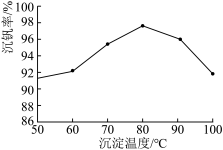
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该步反应钒的回收率。请解释如图温度超过80℃以后,沉钒率下降的可能原因是:____ (写一条即可)。
(7)测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)SO4溶液。再加b1mLc1mol•L-1(NH4)2Fe(SO4)2溶液(VO +2H++Fe2+=VO2++Fe3++H2O)。最后用c2mol•L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O)。最后用c2mol•L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g•mol-1)的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g•mol-1)的质量分数是____ 。(列出计算式)

已知:a.部分含钒物质常温下在水中溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b.VO
 +2OH-
+2OH- VO
VO +H2O
+H2O回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式:
(4)生成VO
 的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式:
的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式:(5)在第II步反应中需要加入氨水,结合化学用语,用平衡移动原理解释加入氨水的一种作用为
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该步反应钒的回收率。请解释如图温度超过80℃以后,沉钒率下降的可能原因是:

(7)测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)SO4溶液。再加b1mLc1mol•L-1(NH4)2Fe(SO4)2溶液(VO
 +2H++Fe2+=VO2++Fe3++H2O)。最后用c2mol•L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O)。最后用c2mol•L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g•mol-1)的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g•mol-1)的质量分数是
您最近一年使用:0次
2022-11-09更新
|
146次组卷
|
2卷引用:河北省邢台市五校联考2022-2023学年高三上学期期中考试化学试题
解题方法
9 . 乙醇是一种重要的工业原料,广泛应用于能源、化工、食品等领域。
Ⅰ.工业上乙烯水化制乙醇过程中能量变化如图所示:
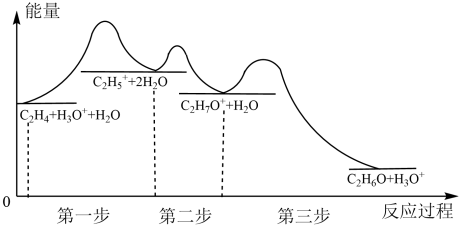
(1)图中所示活化能最大的步骤是第_______ 步。
(2)写出该反应过程中速率最快的基元反应:_______ 。
Ⅱ.研究显示乙酸甲酯催化加氢也可以制取乙醇,主要反应如下:
①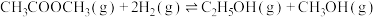
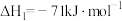
②

(3)已知反应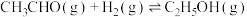 的
的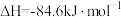 ,则
,则
_______ 。
(4)在体积密闭容器中进行上述反应时发现,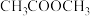 流速过大时乙酸甲酯的转化率下降,其原因可能是
流速过大时乙酸甲酯的转化率下降,其原因可能是_______ 。
Ⅲ.乙醇的一种重要用途是与乙酸反应合成乙酸乙酯。已知纯物质和相关恒沸混合物的常压沸点如下表:
(5)实际生产中,一般控制乙酸过量。若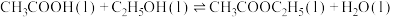
 ,则控制乙酸过量的作用有
,则控制乙酸过量的作用有_______ 。
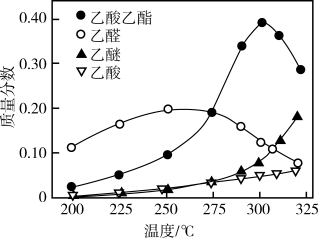
(6)一种新的乙醇催化合成乙酸乙酯的方法如下: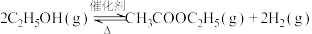 。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
Ⅰ.工业上乙烯水化制乙醇过程中能量变化如图所示:

(1)图中所示活化能最大的步骤是第
(2)写出该反应过程中速率最快的基元反应:
Ⅱ.研究显示乙酸甲酯催化加氢也可以制取乙醇,主要反应如下:
①
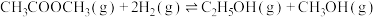
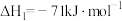
②


(3)已知反应
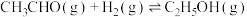 的
的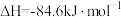 ,则
,则
(4)在体积密闭容器中进行上述反应时发现,
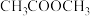 流速过大时乙酸甲酯的转化率下降,其原因可能是
流速过大时乙酸甲酯的转化率下降,其原因可能是Ⅲ.乙醇的一种重要用途是与乙酸反应合成乙酸乙酯。已知纯物质和相关恒沸混合物的常压沸点如下表:
| 纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
| 乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
| 乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
| 乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08)+水(0.09) | 70.2 |
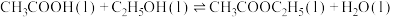
 ,则控制乙酸过量的作用有
,则控制乙酸过量的作用有(6)一种新的乙醇催化合成乙酸乙酯的方法如下:
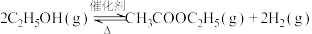 。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
| A.该反应的最宜温度应为325℃ |
| B.适当减小体系压强,有利于提高乙醇平衡转化率 |
| C.在催化剂作用下,乙醚是反应历程中的中间产物 |
| D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键 |
您最近一年使用:0次
2022-11-03更新
|
171次组卷
|
2卷引用:湖北省鄂东南联盟2022-2023学年高三上学期期中联考化学试题
10 . 酚类化合物在医疗、环保、工业等方面有着广泛的用途。
(1)苯酚可用于外科器械消毒、皮肤杀菌与止痒,可通过磺化法制备。该工艺具体流程如下:
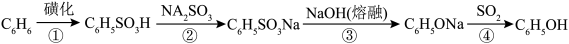
反应③的化学方程式为___________ 。
(2)石油加工、造纸等企业易产生含有苯酚的工业废水,可通过O3-H2O2氧化法进行处理,其原理为C6H5OH+H2O2+O3→CO2+H2O(非可逆反应,反应未配平)。在T1℃和T2℃时,分别向含有苯酚的水样中加入等量的30%H2O2溶液,再以相同的流速向水样中通入O3,测得水样中苯酚的含量随时间变化的曲线如图所示。
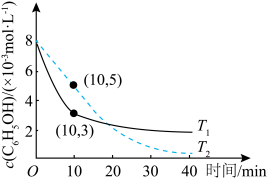
①在T1℃时,0~10min内,C6H5OH的平均反应速率为___________ 。
②请判断T1和T2的大小:T1___________ (填“>”“<”或“=”)T2,T1℃时对工业废水中苯酚的去除率低于T2℃时的原因可能是___________ (写一种即可)。
(3)利用FeCl3溶液与苯酚的显色反应,可定性检测工业废水中的苯酚,其反应原理为Fe3++6C6H5OH [Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。
[Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。
(4)邻苯二酚钠类配体(L)与金属离子(M)形成的配合物可应用于医药、水处理等领域。其溶液中存在平衡:
M+L ML K1
ML K1
ML+L ML2 K2
ML2 K2
某研究小组配制了M与L起始浓度比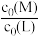 不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。
不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。
测得平衡时L、ML、ML2的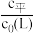 与
与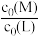 的变化关系如图所示。
的变化关系如图所示。
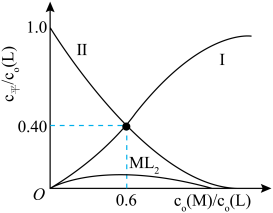
①表示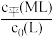 与
与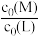 变化关系的曲线为
变化关系的曲线为___________ (填“Ⅰ”或“Ⅱ”)。
②当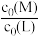 =0.6时,c平(ML2)=
=0.6时,c平(ML2)=___________ ,K1=___________ 。
(1)苯酚可用于外科器械消毒、皮肤杀菌与止痒,可通过磺化法制备。该工艺具体流程如下:
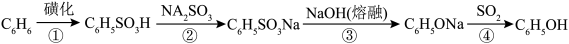
反应③的化学方程式为
(2)石油加工、造纸等企业易产生含有苯酚的工业废水,可通过O3-H2O2氧化法进行处理,其原理为C6H5OH+H2O2+O3→CO2+H2O(非可逆反应,反应未配平)。在T1℃和T2℃时,分别向含有苯酚的水样中加入等量的30%H2O2溶液,再以相同的流速向水样中通入O3,测得水样中苯酚的含量随时间变化的曲线如图所示。

①在T1℃时,0~10min内,C6H5OH的平均反应速率为
②请判断T1和T2的大小:T1
(3)利用FeCl3溶液与苯酚的显色反应,可定性检测工业废水中的苯酚,其反应原理为Fe3++6C6H5OH
 [Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。
[Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。| A.加水稀释,溶液pH减小 |
B.滴入几滴浓盐酸,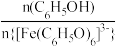 增大 增大 |
| C.加入少量NaOH固体,反应平衡常数增大 |
| D.加入少量Cu粉,溶液紫色变浅 |
(4)邻苯二酚钠类配体(L)与金属离子(M)形成的配合物可应用于医药、水处理等领域。其溶液中存在平衡:
M+L
 ML K1
ML K1ML+L
 ML2 K2
ML2 K2某研究小组配制了M与L起始浓度比
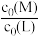 不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。
不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。测得平衡时L、ML、ML2的
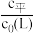 与
与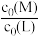 的变化关系如图所示。
的变化关系如图所示。
①表示
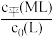 与
与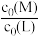 变化关系的曲线为
变化关系的曲线为②当
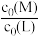 =0.6时,c平(ML2)=
=0.6时,c平(ML2)=
您最近一年使用:0次



