名校
1 . 氢气是重要的工业原料,煤的气化是一种重要的制氢途径。反应过程如下:
①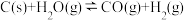 (吸热反应)
(吸热反应)
②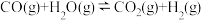 (放热反应)
(放热反应)
在一定温度下,向体积固定的密闭容器中加入足量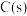 和
和 。反应平衡时,
。反应平衡时, 的物质的量为
的物质的量为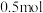 ,
, 的物质的量为
的物质的量为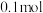 。
。
(1)下列说法错误的是___________。
(2)若要提高碳的转化率,请你再设计一种措施:___________ 。
①
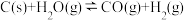 (吸热反应)
(吸热反应)②
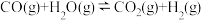 (放热反应)
(放热反应)在一定温度下,向体积固定的密闭容器中加入足量
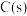 和
和 。反应平衡时,
。反应平衡时, 的物质的量为
的物质的量为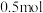 ,
, 的物质的量为
的物质的量为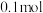 。
。(1)下列说法错误的是___________。
| A.增加炭粉,能使反应①平衡正向移动 |
| B.混合气体的密度保持不变时,说明反应体系已达到平衡 |
C.平衡时 的体积分数可能大于 的体积分数可能大于 |
D.升高温度可能增大 的转化率 的转化率 |
您最近半年使用:0次
名校
2 . 某研究性学习小组通过亚硫酸钠固体和浓硫酸反应制备SO2并进行性质探究。
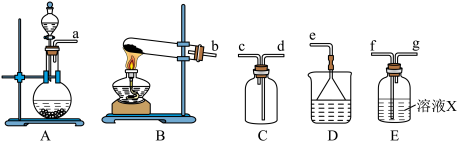
Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为___________ 。
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为___________ (填序号)。
(3)溶液X中盛放的试剂为___________ ,装置D的作用为___________ 。
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性
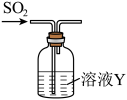
(4)Y是Na2S溶液,可观察到的现象___________ 。Na2S溶液的浓度为0.1 mol/L溶液最多可以吸收标况下的SO2体积为___________ mL(不考虑SO2的溶解)。
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为___________ ,用方程式表示产生该现象的原因___________ 。
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中: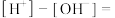
___________ (用溶液中的含硫微粒浓度表示)。
探究活动3:SO2与FeCl3溶液的反应
实验1中出现红棕色的原因,研究小组成员查阅资料得: 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: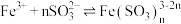 (红棕色)。
(红棕色)。
(7)实验2中,溶液由黄色变为浅绿色的离子方程式为___________ 。
(8)结合速率与平衡的知识,解释实验1颜色变化的原因___________ 。
(9)解释实验2的现象与实验1的现象不同的原因___________ 。

Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为
(3)溶液X中盛放的试剂为
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性

(4)Y是Na2S溶液,可观察到的现象
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中:
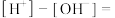
探究活动3:SO2与FeCl3溶液的反应
| 实验 | 溶液Y | 现象 |
| 1 | 1 mol/L FeCl3溶液 | 溶液由黄色变为红棕色,静置,溶液红棕色逐渐消失,1 h后变为浅绿色 |
| 2 | 1 mol/L FeCl3溶液和HCl混合溶液 | 溶液由黄色变为浅绿色 |
 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: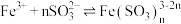 (红棕色)。
(红棕色)。(7)实验2中,溶液由黄色变为浅绿色的离子方程式为
(8)结合速率与平衡的知识,解释实验1颜色变化的原因
(9)解释实验2的现象与实验1的现象不同的原因
您最近半年使用:0次



