1 . 抗击“疫情”期间,过氧乙酸是常用的消毒剂之一,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%H2O2溶液,最终得到质量分数约68%的H2O2溶液。
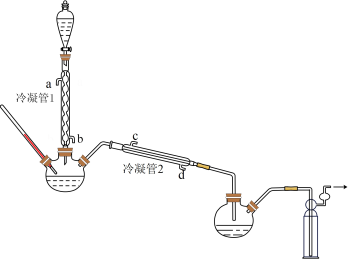
①冷凝管1、冷凝管2中进水接口依次为、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知CH3COOH+H2O2= +H2O)
+H2O)
①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(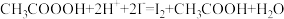 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(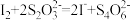 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、胶头滴管、玻璃棒和量筒外,还需要______ 。
②设计步骤b的目的是___________ 。
③过氧乙酸的质量分数为___________ %。
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%H2O2溶液,最终得到质量分数约68%的H2O2溶液。

①冷凝管1、冷凝管2中进水接口依次为、
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知CH3COOH+H2O2=
 +H2O)
+H2O)①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是
②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
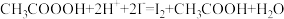 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(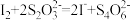 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、胶头滴管、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近半年使用:0次
名校
2 . 硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
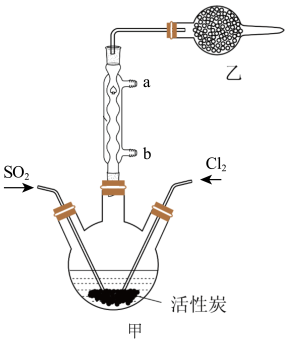
I.SO2Cl2的制备
(1)水应从___ (选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___ (填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___ 。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___ 。
(5)反应结束后,分离甲中混合物的最佳实验操作是___ 。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___ 。
(7)产品中SO2Cl2的质量分数为___ %,若步骤③不加入硝基苯则所测SO2Cl2含量将___ (填“偏高”、“偏低”或“无影响”)。
 SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
I.SO2Cl2的制备
(1)水应从
(2)制取SO2的最佳组合是
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是
(4)制备过程中需要将装置甲置于冰水浴中,原因是
(5)反应结束后,分离甲中混合物的最佳实验操作是
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为
(7)产品中SO2Cl2的质量分数为
您最近半年使用:0次
2019-12-10更新
|
482次组卷
|
3卷引用:陕西省西安市长安区第一中学2020-2021学年高三第七次质量检测理综化学试题
名校
3 . 现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则
(1)m+n_______ (填“>”“<”或“=”)p。
(2)减压时,A的质量分数_______ (填“增大”“减小”或“不变”,下同)。
(3)若加入B(体积不变),则B的转化率_______ 。
(4)若升高温度,则平衡时,B、C的浓度之比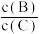 将
将_______ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量_______ 。
(6)若反应体系平衡后,再加入C(体积不变),则B的体积分数_______ ,而维持容器内气体的压强不变,充入氖气时,混合物的颜色_______ (填“变浅”“变深”或“不变”)。
(1)m+n
(2)减压时,A的质量分数
(3)若加入B(体积不变),则B的转化率
(4)若升高温度,则平衡时,B、C的浓度之比
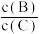 将
将(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若反应体系平衡后,再加入C(体积不变),则B的体积分数
您最近半年使用:0次
名校
解题方法
4 . 合成氨工业中采用循环操作,主要是为了
| A.增大化学反应速率 | B.提高平衡混合物中氨的含量 |
| C.降低氨的沸点 | D.提高氮气和氢气的利用率 |
您最近半年使用:0次
2023-06-30更新
|
495次组卷
|
16卷引用:陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题
陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷山西省怀仁市2021-2022学年高二上学期期中化学试题人教2019版选择性必修一第二章 第四节 化学反应的调控 课后习题河北省石家庄市2021-2022学年高二上学期期末考试化学试题(已下线)2.4 化学反应的调控-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)吉林省吉林市2022-2023学年高二上学期期中调研测试化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题新疆喀什地区疏附县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控(已下线)第08讲 化学反应的调控-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1) 广东实验中学越秀学校2023-2024学年高二上学期期中考试化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期11月期中化学试题青海省西宁市大通县2023-2024学年高二上学期期末考试化学试题贵州神贵阳市2023-2024学年清镇市博雅实验学校高二上学期第四次月考化学试卷
5 . 一定条件下的密闭容器中: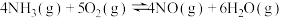
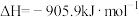 ,下列叙述不正确的是
,下列叙述不正确的是
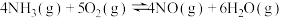
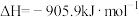 ,下列叙述不正确的是
,下列叙述不正确的是A.通入适当过量的氧气,有利于提高 的转化率 的转化率 |
| B.使用催化剂能缩短该反应到达平衡的时间 |
| C.平衡后降低压强,混合气体平均摩尔质量增大 |
| D.平衡后升高温度,混合气体中NO含量降低 |
您最近半年使用:0次
6 . 在一个2L的恒容密闭容器中,加入3molA和1molB发生如下反应:3A(g)+B(g) 2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应是___ 反应(填“吸热”或“放热”),D的状态是__ (填“气态”或“非气态”)。
(2)达到平衡时,A的转化率为___ ,此温度下的平衡常数K=__ (保留两位小数)。
(3)若加入适量B,则A的转化率将__ (填“增大”“减小”或“不变”,下同),化学平衡常数将__ 。
 2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应是
(2)达到平衡时,A的转化率为
(3)若加入适量B,则A的转化率将
您最近半年使用:0次
名校
7 . 对于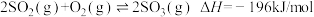 ,下列说法正确的是
,下列说法正确的是
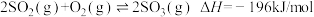 ,下列说法正确的是
,下列说法正确的是A.若反应达到平衡状态,升高温度,体系中 的含量上升 的含量上升 |
| B.若反应达到平衡状态,减小压强,正反应速率加快,逆反应速率减慢,平衡逆向移动 |
C.若反应达到平衡状态,充入 ,若容器容积恒定,则正逆反应速率不变,平衡不移动 ,若容器容积恒定,则正逆反应速率不变,平衡不移动 |
D.若反应达到平衡状态,充入 ,若容器压强恒定,则正逆反应速率均减小,平衡逆向移动 ,若容器压强恒定,则正逆反应速率均减小,平衡逆向移动 |
您最近半年使用:0次
名校
8 . 为减少大气污染,科学家采取多种措施处理工业废气中排放的氮氧化物(NOx)、SO2等。回答下列问题:
(1)某脱硝反应机理如图所示,Cu+的作用为____ ,C2H4参与的反应方程式为____ 。
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
①若有3molNO参与反应,则被NO氧化的NH3的物质的量为____ 。
②催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是____ 。
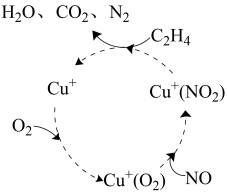
③350℃时NO的百分含量与氨氮比的关系如图所示,若只改变氨气的投放量,当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是____ (用化学方程式表示)。

(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点,ClO2在酸性条件下稳定,是性能优良的脱硫脱硝试剂。
①ClO 也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为
也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为____ 。
②某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。
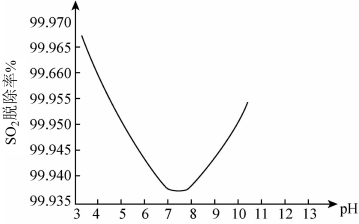
当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是:____ ;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是____ 。
(1)某脱硝反应机理如图所示,Cu+的作用为

(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
4N2(g)+6H2O(g) △H=-1627kJ·mol-1。①若有3molNO参与反应,则被NO氧化的NH3的物质的量为
②催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是
③350℃时NO的百分含量与氨氮比的关系如图所示,若只改变氨气的投放量,当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点,ClO2在酸性条件下稳定,是性能优良的脱硫脱硝试剂。
①ClO
 也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为
也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为②某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。

当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是:
您最近半年使用:0次
2022-08-29更新
|
240次组卷
|
4卷引用:陕西省咸阳高新一中2023届高三上学期第一次质量检测化学试题
名校
9 . 合成氨工业中采用循环操作,主要原因是
| A.降低氨的沸点 | B.提高氮气和氢气的利用率 |
| C.增大化学反应速率 | D.提高平衡混合物中氨的含量 |
您最近半年使用:0次
2022-03-10更新
|
414次组卷
|
7卷引用:陕西省渭南市韩城市2023-2024学年高二上学期期中质量检测化学试题
名校
10 . 反应mA(s)+nB(g)⇌pC(g)+qD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述正确的是


| A.达到平衡后,加入催化剂,C%增大 |
| B.达到平衡后,若升温,平衡向左移动 |
| C.化学方程式中n<p+q |
| D.达到平衡后,增加A的量有利于平衡向右移动 |
您最近半年使用:0次
2021-09-30更新
|
566次组卷
|
8卷引用:陕西省千阳中学2020-2021学年高二上学期期中化学(理科)试题
陕西省千阳中学2020-2021学年高二上学期期中化学(理科)试题重庆市暨华中学校2021-2022学年高二上学期第一次月考化学试题天津市武清区崔黄口中学2021-2022学年高二上学期第一次练习化学试题湖北省武汉市江夏实验高级中学2021-2022学年高二上学期10月考试化学试题广西贺州市昭平县昭平中学2021-2022学年高二上学期第二次月考化学试题青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题(已下线)第13讲 第二章《化学反应速率与化学平衡》单元测试(基础巩固)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)专题05 影响化学平衡的因素【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)



