名校
解题方法
1 . 白云石的主要化学成分为 ,还含有质量分数约为2.1%的
,还含有质量分数约为2.1%的 和1.0%的
和1.0%的 。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
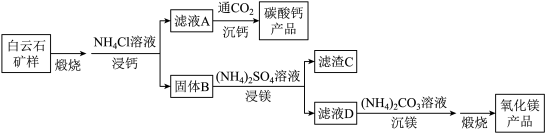
已知:
(1)白云石矿样煅烧完全分解的化学方程式为___________ 。
(2) 用量对碳酸钙产品的影响如下表所示。
用量对碳酸钙产品的影响如下表所示。
备注:ⅰ. 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量)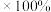 (M代表
(M代表 或
或 )
)
ⅱ. 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。
①解释“浸钙”过程中主要浸出 的原因是
的原因是___________ 。
②沉钙反应的离子方程式为___________ 。
③“浸钙”过程不适宜选用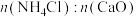 的比例为
的比例为___________ 。
④产品中 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是___________ 。
(3)“浸镁”过程中,取固体B与一定浓度的 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是___________ 。
(4)滤渣C中含有的物质是 、
、 和
和___________ 。
(5)该流程中可循环利用的物质是 、
、 和
和___________ 。
 ,还含有质量分数约为2.1%的
,还含有质量分数约为2.1%的 和1.0%的
和1.0%的 。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
已知:
| 物质 |  |  |  |  |
 |  |  |  | 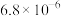 |
(1)白云石矿样煅烧完全分解的化学方程式为
(2)
 用量对碳酸钙产品的影响如下表所示。
用量对碳酸钙产品的影响如下表所示。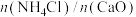 | 氧化物( )浸出率/% )浸出率/% | 产品中 纯度/% 纯度/% | 产品中 杂质含量/%(以 杂质含量/%(以 计) 计) | ||
 |  | 计算值 | 实测值 | ||
| 2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
| 2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
| 2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量)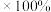 (M代表
(M代表 或
或 )
)ⅱ.
 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。①解释“浸钙”过程中主要浸出
 的原因是
的原因是②沉钙反应的离子方程式为
③“浸钙”过程不适宜选用
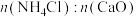 的比例为
的比例为④产品中
 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是(3)“浸镁”过程中,取固体B与一定浓度的
 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是(4)滤渣C中含有的物质是
 、
、 和
和(5)该流程中可循环利用的物质是
 、
、 和
和
您最近半年使用:0次
名校
解题方法
2 .  新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
(1) 的制备。
的制备。
①化学气相沉积法。
Ⅰ.一定温度下,以 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是______ 。
Ⅱ.上述反应适宜的温度范围是________ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有:___________ 、___________ 和 。
。
③碳热还原法。
以 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。
已知:i.
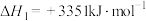
ii.
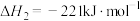
iii.
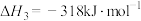
运用平衡移动原理分析反应ii对反应i的可能影响:___________ 。
(2) 的性质。
的性质。 粉末可发生水解的化学方程式是
粉末可发生水解的化学方程式是 。相同条件下,不同粒径的
。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。
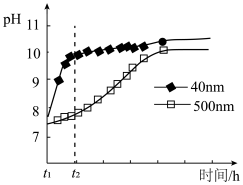
解释 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:___________ 。
(3) 含量检测。向
含量检测。向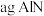 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的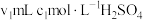 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是___________ 。
 新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:| 物质 | 熔点/℃ | 沸点/℃ | 与 反应温度 /℃ 反应温度 /℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 |  :>2000(>1400升华) :>2000(>1400升华) :(>181升华) :(>181升华) |
| Mg | 649 | 1090 | >300 |  :>800 :>800 |
(1)
 的制备。
的制备。①化学气相沉积法。
Ⅰ.一定温度下,以
 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有: 。
。③碳热还原法。
以
 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。已知:i.

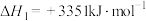
ii.

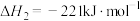
iii.

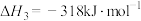
运用平衡移动原理分析反应ii对反应i的可能影响:
(2)
 的性质。
的性质。 粉末可发生水解的化学方程式是
粉末可发生水解的化学方程式是 。相同条件下,不同粒径的
。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。
解释
 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:(3)
 含量检测。向
含量检测。向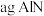 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的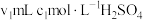 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是
您最近半年使用:0次
3 . 氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
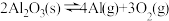
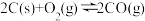
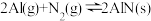
(1)断开N2分子内的共价键要_____ 热量(填“吸收”或“放出”)
(2)分析反应②对①、③平衡移动的影响_____ 。
(3)Al2O3、C、N2合成AlN的平衡常数表达式K=___________ 。
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):
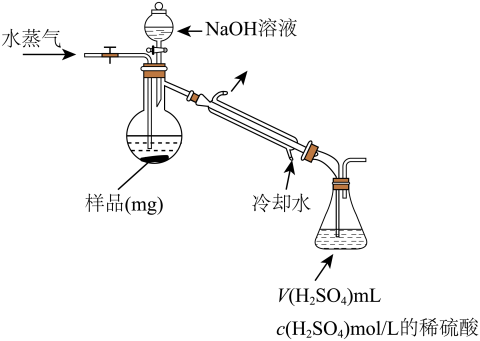
①AlN与NaOH溶液反应产生NH3的化学方程式是____________ 。
②锥形瓶内吸收NH3的离子方程式是____________ 。
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液,_____ (将检验过程补充完整)。
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为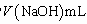 。下面有关计算正确的是
。下面有关计算正确的是_____ 。A.样品中AlN的质量: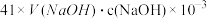
B.AlN的质量分数:
C.锥形瓶吸收NH3的物质的量: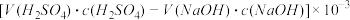
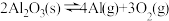
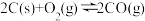
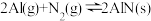
(1)断开N2分子内的共价键要
(2)分析反应②对①、③平衡移动的影响
(3)Al2O3、C、N2合成AlN的平衡常数表达式K=
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):

①AlN与NaOH溶液反应产生NH3的化学方程式是
②锥形瓶内吸收NH3的离子方程式是
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液,
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为
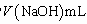 。下面有关计算正确的是
。下面有关计算正确的是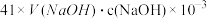
B.AlN的质量分数:

C.锥形瓶吸收NH3的物质的量:
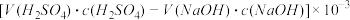
您最近半年使用:0次
名校
4 . 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq) CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
(1)利用上述反应制备760g CHCOH,放出的热量为_______ kJ。
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
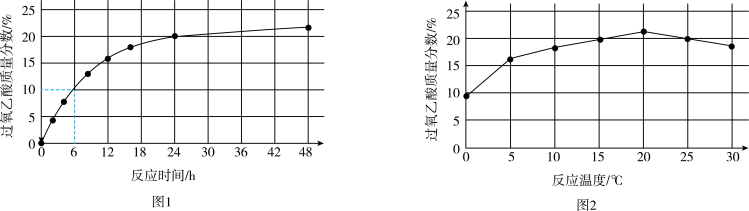 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=_____ g/h。(用含m的代数式表示)
②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是_______ (写出2条)。
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
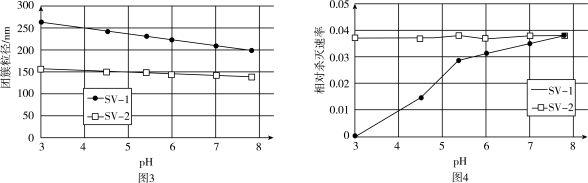
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是___________ 。
 CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol(1)利用上述反应制备760g CHCOH,放出的热量为
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
您最近半年使用:0次
名校
解题方法
5 . 在一密闭容器中,反应 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 | D. |
您最近半年使用:0次
2023-11-14更新
|
357次组卷
|
25卷引用:北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题
北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题(已下线)【浙江新东方】双师118安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题天津市第二南开学校2022-2023学年高二上学期9月阶段性线上练习化学试题 天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题浙江省金华第一中学2022-2023学年高一下学期6月期末化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题
6 . 向锌氨溶液(由 液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂
液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂 。不同
。不同 下(其它条件不变)达到平衡后
下(其它条件不变)达到平衡后 和
和 的萃取效果如图所示。
的萃取效果如图所示。
反应ⅱ:
反应ⅲ:
② 的锌氨溶液中,
的锌氨溶液中, 主要以
主要以 形式存在
形式存在
下列说法不正确 的是
 液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂
液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂 。不同
。不同 下(其它条件不变)达到平衡后
下(其它条件不变)达到平衡后 和
和 的萃取效果如图所示。
的萃取效果如图所示。

反应ⅱ:

反应ⅲ:

②
 的锌氨溶液中,
的锌氨溶液中, 主要以
主要以 形式存在
形式存在下列说法
A.锌氨溶液中存在 的电离平衡和 的电离平衡和 的水解平衡 的水解平衡 |
B. 时,加入萃取剂 时,加入萃取剂 达到平衡后, 达到平衡后,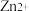 主要以 主要以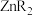 的形式存在 的形式存在 |
C. 由8到10,萃取剂中氨的含量增大的原因是反应ⅲ的平衡向正反应方向移动 由8到10,萃取剂中氨的含量增大的原因是反应ⅲ的平衡向正反应方向移动 |
D. 由8到6, 由8到6, 和 和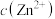 均增大,前者对反应ⅱ的影响小于后者 均增大,前者对反应ⅱ的影响小于后者 |
您最近半年使用:0次
解题方法
7 . 工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、SiO2、Fe2O3等杂质),低温硫酸化焙烧—水浸工艺制备V2O5,其流程如图:

资料:
ⅰ.VOSO4高温易分解
ⅱ.含磷有机试剂对溶液中离子萃取能力为Fe(III)>V(IV)>V(V)>Fe(II)
ⅲ.含磷有机试剂萃取过程中溶液的H+浓度越高,萃取率越低,萃取钒效果越差
ⅳ.10VO +8H2O
+8H2O H2V10O
H2V10O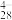 +14H+
+14H+
ⅴ.氢氧化物完全沉淀时溶液的pH表
(1)焙烧过程中向石煤中加硫酸焙烧,将V2O3转化为VOSO4的化学方程式是____ 。
(2)预处理过程中先加入Na2SO3溶液进行还原预处理,加入Na2SO3溶液的第一个作用是将V(V)还原为V(IV)减少钒的损失,再用氨水混合并调节溶液pH。
①请结合相关离子方程式,说明加入Na2SO3的第二个作用____ 。
②解释加氨水调节pH≈5的原因是____ 。
(3)上述I的具体操作为____ 。
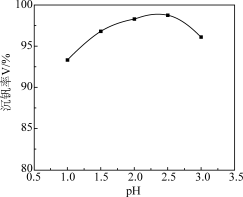
(4)沉钒过程中先加入NaClO3进行氧化,再加氨水调节pH,铵盐会将H2V10O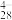 中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是
中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是____ 。
(5)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L-1(NH4)2Fe(SO4)2溶液(VO +2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是____ 。(V2O5的摩尔质量:182g•mol-1)

资料:
ⅰ.VOSO4高温易分解
ⅱ.含磷有机试剂对溶液中离子萃取能力为Fe(III)>V(IV)>V(V)>Fe(II)
ⅲ.含磷有机试剂萃取过程中溶液的H+浓度越高,萃取率越低,萃取钒效果越差
ⅳ.10VO
 +8H2O
+8H2O H2V10O
H2V10O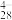 +14H+
+14H+ⅴ.氢氧化物完全沉淀时溶液的pH表
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 完全沉淀 | 3.2 | 9.0 | 4.7 |
(2)预处理过程中先加入Na2SO3溶液进行还原预处理,加入Na2SO3溶液的第一个作用是将V(V)还原为V(IV)减少钒的损失,再用氨水混合并调节溶液pH。
①请结合相关离子方程式,说明加入Na2SO3的第二个作用
②解释加氨水调节pH≈5的原因是
(3)上述I的具体操作为
(4)沉钒过程中先加入NaClO3进行氧化,再加氨水调节pH,铵盐会将H2V10O
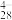 中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是
中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是
(5)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L-1(NH4)2Fe(SO4)2溶液(VO
 +2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
您最近半年使用:0次
8 . 四氧化三铅(化学式可以写为2PbO·PbO2)被广泛用作防锈漆成分。测定某样品中四氧化三铅含量的步骤如下(样品中杂质均不参与反应):
Ⅰ.称取ag样品,加酸溶解,滤去不溶物,所有的铅元素进入溶液中并得到含有Pb2+的溶液。
Ⅱ.加入过量K2Cr2O7溶液,加热,生成黄色沉淀(PbCrO4),冷却,过滤。
Ⅲ.将沉淀全部转移至仪器A中,加入浓HCl,沉淀溶解,溶液转为橙色。
Ⅳ.加入过量KI溶液,置于暗处5~10分钟,溶液呈棕黄色。
Ⅴ.加入cmol·L−1Na2S2O3溶液进行滴定,当溶液转为浅黄色时,加入淀粉,滴定至终点。进行3次平行实验,消耗Na2S2O3溶液的体积平均值为vmL。
已知:ⅰ. (橙色)+H2O
(橙色)+H2O 2
2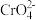 (黄色)+2H+。
(黄色)+2H+。
ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2(黄色)+I−(无色)
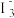 (棕黄色)。
(棕黄色)。
ⅳ.I2+2 (无色)=2I−+
(无色)=2I−+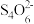 (无色)。
(无色)。
(1)PbO2中Pb的化合价是___________ 。
(2)Ⅱ中生成沉淀的离子方程式为___________ 。
(3)结合化学用语解释:Ⅲ中加入浓HCl后沉淀溶解的原因是___________ 。
(4)将Ⅳ中反应的离子方程式补全:□I−+___________+___________=□Cr3++___________+___________,___________
(5)Ⅴ中滴定终点的现象是___________ 。
(6)样品中四氧化三铅的质量分数为___________ 。(列出表达式即可,M(四氧化三铅)=685g·mol−1)
(7)步骤Ⅱ、Ⅲ在达成实验目的中起到的作用是___________ 。
Ⅰ.称取ag样品,加酸溶解,滤去不溶物,所有的铅元素进入溶液中并得到含有Pb2+的溶液。
Ⅱ.加入过量K2Cr2O7溶液,加热,生成黄色沉淀(PbCrO4),冷却,过滤。
Ⅲ.将沉淀全部转移至仪器A中,加入浓HCl,沉淀溶解,溶液转为橙色。
Ⅳ.加入过量KI溶液,置于暗处5~10分钟,溶液呈棕黄色。
Ⅴ.加入cmol·L−1Na2S2O3溶液进行滴定,当溶液转为浅黄色时,加入淀粉,滴定至终点。进行3次平行实验,消耗Na2S2O3溶液的体积平均值为vmL。
已知:ⅰ.
 (橙色)+H2O
(橙色)+H2O 2
2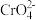 (黄色)+2H+。
(黄色)+2H+。ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2(黄色)+I−(无色)

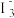 (棕黄色)。
(棕黄色)。ⅳ.I2+2
 (无色)=2I−+
(无色)=2I−+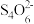 (无色)。
(无色)。(1)PbO2中Pb的化合价是
(2)Ⅱ中生成沉淀的离子方程式为
(3)结合化学用语解释:Ⅲ中加入浓HCl后沉淀溶解的原因是
(4)将Ⅳ中反应的离子方程式补全:□I−+___________+___________=□Cr3++___________+___________,
(5)Ⅴ中滴定终点的现象是
(6)样品中四氧化三铅的质量分数为
(7)步骤Ⅱ、Ⅲ在达成实验目的中起到的作用是
您最近半年使用:0次
解题方法
9 . 人体内血红蛋白分子(Hb)与O2形成氧合血红蛋白,人体生命维持取决于血红蛋白与氧的结合及其对氧的释放。反应方程式如下所示,下列叙述不正确 的是
Hb(aq)(血红蛋白)+O2(aq) PbO2(aq)(氧合血红蛋白)
PbO2(aq)(氧合血红蛋白)
Hb(aq)(血红蛋白)+O2(aq)
 PbO2(aq)(氧合血红蛋白)
PbO2(aq)(氧合血红蛋白)| A.人体大量运动时肌肉需氧量上升平衡逆向移动 |
| B.人体吸氧越多有利于氧合血红蛋白形成,对人体健康越有利 |
| C.突然进入高海拔的高山上出现高山病时是由于上述平衡逆移导致 |
| D.长时间在高山区生活人群血液中血红蛋白含量比生活在平原地区人多 |
您最近半年使用:0次
名校
10 . 一定条件下密闭容器中发生的可逆反应: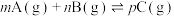 ,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度)。则下列判断正确的是
,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度)。则下列判断正确的是
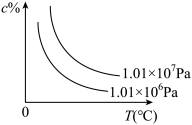
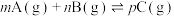 ,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度)。则下列判断正确的是
,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度)。则下列判断正确的是
A. | B.m+n>p |
| C.加入催化剂,c%增加 | D.增加A的浓度,A的转化率提高 |
您最近半年使用:0次
2022-10-21更新
|
325次组卷
|
5卷引用:北京市西城职业学校2021-2021学年高二上学期期中测试化学试题



