名校
1 . 向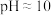 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图

(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____
(2)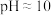 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为_____
(3)用化学平衡移动原理解释向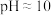 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:_____ 。
(4)某温度下,CuS和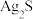 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
,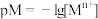 ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
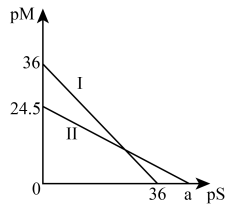
 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为(3)用化学平衡移动原理解释向
 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:(4)某温度下,CuS和
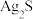 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
, ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
A.曲线Ⅱ代表的是 | B. |
C.此温度下CuS的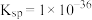 | D.此温度下的饱和溶液中 |
您最近一年使用:0次
2 . 下列方案设计、现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 检验铜和浓硫酸反应之后是否有酸剩余 | 取少量反应后的溶液于试管中,依次加入盐酸和BaCl2溶液 | 若出现白色沉淀,则硫酸剩余 |
| B | 探究淀粉在酸性条件下的水解程度 | 取少量淀粉溶液,加入适量稀硫酸加热5min后,再加NaOH中和硫酸,最后滴加碘水 | 溶液无明显现象,则淀粉完全水解 |
| C | 比较CH3COOH和HClO的酸性强弱 | 相同条件下分别用pH试纸测定0.1mol•L-1CH3COONa溶液、0.1mol•L-1NaClO溶液的pH | NaClO溶液pH>CH3COONa溶液的pH,证明CH3COOH的酸性比HClO的酸性强 |
| D | 探究浓度对化学平衡的影响 | 在4mL0.1mol•L-1K2Cr2O7溶液中加入数滴1mol•L-1NaOH溶液 | 若溶液由橙色变为黄色,则H+浓度减小,Cr2O +H2O +H2O 2CrO 2CrO +2H+平衡正移 +2H+平衡正移 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 实验小组探究酸对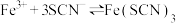 平衡的影响。将0.005mol/L
平衡的影响。将0.005mol/L 溶液(接近无色)和0.01mol/L
溶液(接近无色)和0.01mol/L 溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
(1) 水解显酸性的原因是
水解显酸性的原因是___________ (用方程式表示)。
(2)甲同学认为加入酸后,会使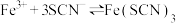 体系中
体系中___________ 浓度改变,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】Fe3+和 、
、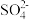 均能发生络合反应:
均能发生络合反应: (黄色);
(黄色); (无色)。
(无色)。
(3) 离子的空间构型为
离子的空间构型为___________ ,与 配位的原子是
配位的原子是___________ 。
实验Ⅰ.探究现象a中溶液颜色变化的原因
(4)实验(1)的目的是___________ 。
(5)根据实验(1)和实验(2)的结果,从平衡移动角度解释现象a:___________ 。
实验Ⅱ.探究现象b中溶液呈浅黄色的原因
(6)结合实验(3)可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是___________ 。
(7)乙同学进一步补充了实验(4),确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:___________ 。
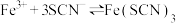 平衡的影响。将0.005mol/L
平衡的影响。将0.005mol/L 溶液(接近无色)和0.01mol/L
溶液(接近无色)和0.01mol/L 溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。(1)
 水解显酸性的原因是
水解显酸性的原因是(2)甲同学认为加入酸后,会使
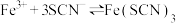 体系中
体系中【设计并实施实验】
 |  |
 、
、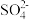 均能发生络合反应:
均能发生络合反应: (黄色);
(黄色); (无色)。
(无色)。(3)
 离子的空间构型为
离子的空间构型为 配位的原子是
配位的原子是实验Ⅰ.探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol/L 溶液 溶液 | 溶液颜色变浅,呈橙色 |
(5)根据实验(1)和实验(2)的结果,从平衡移动角度解释现象a:
实验Ⅱ.探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
| ③ | 取1mL 0.0025mol/L 溶液(无色),加入1mL 0.01mol/L 溶液(无色),加入1mL 0.01mol/L 溶液,再加入5滴1.5mol/L 溶液,再加入5滴1.5mol/L 溶液 溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL 0.005mol/L 溶液 溶液 | ___________ |
(7)乙同学进一步补充了实验(4),确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:
您最近一年使用:0次
2023-05-01更新
|
135次组卷
|
2卷引用:北京市第八十中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
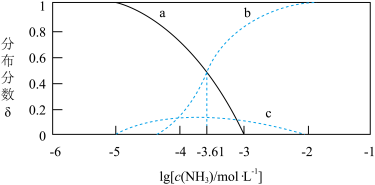
4 . 已知:Ag++NH3 Ag(NH3)+ K1=103.12
Ag(NH3)+ K1=103.12
Ag(NH3)++NH3 [Ag(NH3)2]+ K2
[Ag(NH3)2]+ K2
Ag+、Ag(NH3)+、[Ag(NH3)2]+的分布分数δ与lgc(NH3)关系如图所示,下列说法正确的是
{例如:分布分数δ(Ag+)= }
}
 Ag(NH3)+ K1=103.12
Ag(NH3)+ K1=103.12Ag(NH3)++NH3
 [Ag(NH3)2]+ K2
[Ag(NH3)2]+ K2Ag+、Ag(NH3)+、[Ag(NH3)2]+的分布分数δ与lgc(NH3)关系如图所示,下列说法正确的是
{例如:分布分数δ(Ag+)=
 }
}
| A.曲线c代表[Ag(NH3)2]+ |
| B.K2的数量级为105 |
C.[Ag(NH3)2]+ Ag++2NH3的平衡常数K=10-7.22 Ag++2NH3的平衡常数K=10-7.22 |
| D.当c(NH3)<0.01mol•L-1时,银元素主要以[Ag(NH3)2]+形式存在 |
您最近一年使用:0次
2023-04-30更新
|
264次组卷
|
2卷引用:辽宁省新民市高级中学2022-2023学年高一6月月考化学试题
名校
解题方法
5 . 某小组同学探究盐对 平衡体系的影响。
平衡体系的影响。
实验Ⅰ:探究KCl对 和
和 平衡体系的影响
平衡体系的影响
将等体积、低浓度的 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
② 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。
(1)稀盐酸酸化 溶液的目的是
溶液的目的是___________ 。采用浓度较低的 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免___________ (填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向___________ (填“正”或“逆”)反应方向移动。
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。
(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
①上述实验可证明盐效应影响了 和
和 平衡体系的是
平衡体系的是___________ (填字母序号)。
a.1和2 b.1和3 c.1和4
②选择实验___________ (填序号)可得出结论: 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。
(4)取等体积的溶液a继续进行实验,结果如下表。
上述实验可证明副反应影响了 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:___________ 。
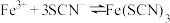 平衡体系的影响。
平衡体系的影响。实验Ⅰ:探究KCl对
 和
和 平衡体系的影响
平衡体系的影响将等体积、低浓度的
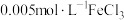 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和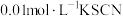 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②
 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。(1)稀盐酸酸化
 溶液的目的是
溶液的目的是 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免(2)从实验结果来看,KCl溶液确实对
 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使
 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。原因2:溶液中存在副反应
 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
| 序号 | 加入少量盐 | 溶液颜色 |
| 1 | 无 | 红色 |
| 2 | KCl | 变浅 |
| 3 |  | 略变浅 |
| 4 | NaCl | 变浅程度较大 |
 和
和 平衡体系的是
平衡体系的是a.1和2 b.1和3 c.1和4
②选择实验
 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。(4)取等体积的溶液a继续进行实验,结果如下表。
| 序号 | 加入溶液 | 溶液颜色 |
| 5 | 1mL浓盐酸 | 明显变浅,溶液偏黄 |
| 6 | 1mL去离子水 | 略变浅 |
 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:
您最近一年使用:0次
2023-04-20更新
|
117次组卷
|
4卷引用:江西省五校2022-2023学年高一下学期直升班联考化学试题
名校
解题方法
6 . 某反应4A(g)⇌mB(g)+2C(g) ΔH<0,正反应速率的变化如图。其中t1、t2、t3、t4只改变一个条件,t2时刻图像变化并非加入催化剂引起,下列叙述中错误 的是


| A.m=2 | B.t1时增大了A的浓度 |
| C.t3时降低了温度 | D.t1至t4时间段内,化学平衡常数的值保持不变 |
您最近一年使用:0次
2022-12-02更新
|
417次组卷
|
2卷引用:上海市实验学校2022-2023学年高一下学期期末考试化学试题
名校
7 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是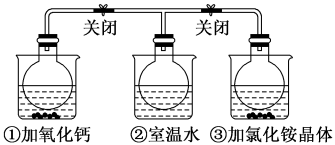
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1132次组卷
|
23卷引用:广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题
广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题(已下线)选择题11-15
名校
8 . 工业上常采取以下方法除去 和
和 以减少有害气体的排放。完成下列填空:
以减少有害气体的排放。完成下列填空:
Ⅰ. 的除去。用
的除去。用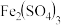 溶液吸收
溶液吸收 生成
生成 。
。 被
被 氧化使
氧化使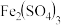 再生,其原理为:
再生,其原理为: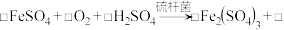 _______
_______
(1)硫杆菌存在时, 被氧化的速率是无菌时的
被氧化的速率是无菌时的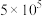 倍。由图1和图2判断,使用硫杆菌的最佳条件为
倍。由图1和图2判断,使用硫杆菌的最佳条件为_______ ;若反应温度过高,反应速率下降,其原因是_______ 。

(2)补全、配平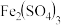 再生的化学方程式,并标出电子转移的数目和方向
再生的化学方程式,并标出电子转移的数目和方向_______ 。
(3)在一定条件下,也可以用 氧化
氧化 ,其氧化产物随参加反应的
,其氧化产物随参加反应的 变化而不同。当
变化而不同。当 =4时,氧化产物的化学式为
=4时,氧化产物的化学式为_______ 。
Ⅱ. 的除去。用NaOH溶液吸收
的除去。用NaOH溶液吸收 ,并用CaO使NaOH再生:NaOH溶液
,并用CaO使NaOH再生:NaOH溶液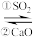
 溶液
溶液
(1)写出过程①的离子方程式:_______ 。
(2)CaO在水中存在如下转化: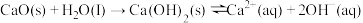 。从平衡移动的角度,简述过程②NaOH再生的原理
。从平衡移动的角度,简述过程②NaOH再生的原理_______ 。
(3)也可用氨水除去 。某废气含0.2%
。某废气含0.2% 和10%
和10% (体积含量,其余为
(体积含量,其余为 ),一定条件下,该废气以
),一定条件下,该废气以 的速率通过催化剂与速率为20 L/h的
的速率通过催化剂与速率为20 L/h的 混合,再喷水,得到
混合,再喷水,得到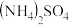 晶体(气体体积均已折算为标准状况)。通过计算说明
晶体(气体体积均已折算为标准状况)。通过计算说明 速率控制在20L/h的原因
速率控制在20L/h的原因_______ 。
 和
和 以减少有害气体的排放。完成下列填空:
以减少有害气体的排放。完成下列填空:Ⅰ.
 的除去。用
的除去。用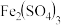 溶液吸收
溶液吸收 生成
生成 。
。 被
被 氧化使
氧化使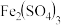 再生,其原理为:
再生,其原理为: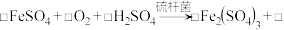 _______
_______(1)硫杆菌存在时,
 被氧化的速率是无菌时的
被氧化的速率是无菌时的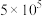 倍。由图1和图2判断,使用硫杆菌的最佳条件为
倍。由图1和图2判断,使用硫杆菌的最佳条件为
(2)补全、配平
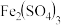 再生的化学方程式,并标出电子转移的数目和方向
再生的化学方程式,并标出电子转移的数目和方向(3)在一定条件下,也可以用
 氧化
氧化 ,其氧化产物随参加反应的
,其氧化产物随参加反应的 变化而不同。当
变化而不同。当 =4时,氧化产物的化学式为
=4时,氧化产物的化学式为Ⅱ.
 的除去。用NaOH溶液吸收
的除去。用NaOH溶液吸收 ,并用CaO使NaOH再生:NaOH溶液
,并用CaO使NaOH再生:NaOH溶液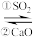
 溶液
溶液(1)写出过程①的离子方程式:
(2)CaO在水中存在如下转化:
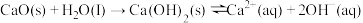 。从平衡移动的角度,简述过程②NaOH再生的原理
。从平衡移动的角度,简述过程②NaOH再生的原理(3)也可用氨水除去
 。某废气含0.2%
。某废气含0.2% 和10%
和10% (体积含量,其余为
(体积含量,其余为 ),一定条件下,该废气以
),一定条件下,该废气以 的速率通过催化剂与速率为20 L/h的
的速率通过催化剂与速率为20 L/h的 混合,再喷水,得到
混合,再喷水,得到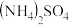 晶体(气体体积均已折算为标准状况)。通过计算说明
晶体(气体体积均已折算为标准状况)。通过计算说明 速率控制在20L/h的原因
速率控制在20L/h的原因
您最近一年使用:0次
名校
9 . 相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:
资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3- Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21
(实验1)用以下装置制取无水氯化亚铁

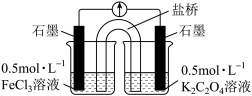
(1)仪器a的名称为___________ ,B的作用为___________ 。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________ 。
(3)D中用NaOH溶液进行尾气处理,存在的问题是___________ 、___________ 。
(实验2)通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。
(4)取实验2中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是___________ 。
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是___________ 。
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:___________ [Fe(C2O4)3]3-
___________ FeC2O4↓+___________ ↑+___________
(实验3)又设计以下装置直接比较Fe2+和C2O 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
(7)描述达到预期目的可能产生的现象:___________ 。
 )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-
 Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是
(3)D中用NaOH溶液进行尾气处理,存在的问题是
(实验2)通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。操作 | 现象 |
| 在避光处,向10mL 0.5 mol·L-1FeCl3溶液中缓慢加入0.5 mol·L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到亮绿色溶液和亮绿色晶体 |
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:

(实验3)又设计以下装置直接比较Fe2+和C2O
 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
(7)描述达到预期目的可能产生的现象:
您最近一年使用:0次
2020-12-11更新
|
1227次组卷
|
4卷引用:重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题
重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)黑龙江省哈尔滨市第九中学2021届高三上学期第四次验收化学试卷
名校
解题方法
10 . 已知反应S2O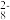 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )

①2Fe3+(aq)+2I-(aq) I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)
②2Fe2+(aq)+S2O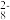 (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)
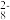 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
①2Fe3+(aq)+2I-(aq)
 I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O
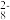 (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)| A.Fe3+是该反应的催化剂,加入Fe3+后降低了该反应的活化能 |
| B.反应①比反应②所需活化能大 |
| C.向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深 |
| D.该反应可设计成原电池 |
您最近一年使用:0次
2020-09-25更新
|
1721次组卷
|
14卷引用:江西省景德镇一中2020-2021学年高一下学期期中考试化学(1班)试题
江西省景德镇一中2020-2021学年高一下学期期中考试化学(1班)试题山西省大同市2021届高三上学期学情调研测试化学试题辽宁省六校协作体2021届高三第一次联考化学试题江西省赣州市会昌县七校2021届高三联合9月月考化学试题辽宁省开原市中固镇第二中学2021届高三上学期9月月考化学试题内蒙古自治区赤峰二中2020-2021学年高二上学期第一次月考化学试题江西省红色七校(分宜中学、会昌中学、莲花中学、南城一中、任弼时中学、瑞金一中、遂川中学)2021届高三上学期第一次联考化学试题陕西省西安市长安区第一中学2021届高三上学期第三次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题江苏省苏州市姑苏区苏州中学2020-2021学年高二下学期期中考试化学试题吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期第一次月考化学试题吉林省汪清县第六中学2021-2022学年高二12月月考化学试题吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题



