1 . 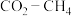 催化重整可获得合成气
催化重整可获得合成气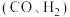 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为
反应①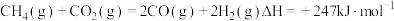
反应②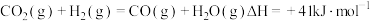
反应③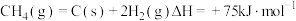
反应④
研究发现在密闭容器中 下,
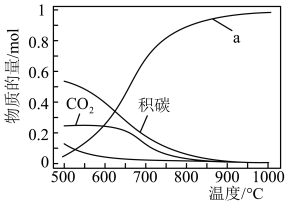
下,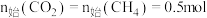 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
 催化重整可获得合成气
催化重整可获得合成气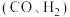 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为反应①
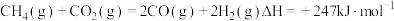
反应②
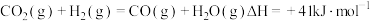
反应③
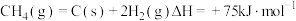
反应④

研究发现在密闭容器中
 下,
下,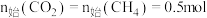 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
A.图中a表示 |
B. 的 的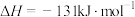 |
C.其他条件不变,在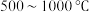 范围,随着温度的升高,平衡时 范围,随着温度的升高,平衡时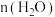 不断增大 不断增大 |
D.当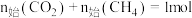 ,其他条件不变时,提高 ,其他条件不变时,提高 的值,能减少平衡时积碳量 的值,能减少平衡时积碳量 |
您最近一年使用:0次
2024-02-13更新
|
1166次组卷
|
4卷引用:江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷
江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)山东省潍坊市2024届高高考模拟训练调研化学试题
名校
2 . 下列事实不能用勒夏特列原理解释的是
A.用饱和食盐水来除 中的 中的 | B.红棕色的 加压后颜色变深 加压后颜色变深 |
| C.开启啤酒瓶后,瓶中马上泛起大量泡沫 | D.增大压强,有利于 与 与 反应生成 反应生成 |
您最近一年使用:0次
2024-02-13更新
|
119次组卷
|
2卷引用:新疆乌鲁木齐市第101中学2023-2024学年高二上学期1月期末化学试题
名校
3 . Ⅰ.甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
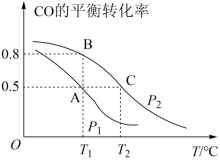
(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是___________ ;平衡常数K=___________ 。平衡后再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大”、“不变”成“减小”),CO与CH3OH的浓度比
___________ (填“增大”、“不变”或“减小”)。
(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)___________ v(逆)(填“>”、“<”或“=”)。
(3)若p2压强恒定为p,则平衡常数Kp=___________ (Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s) PH3(g)+HI(g)
PH3(g)+HI(g)
②4PH3(g) P4(g)+6H2(g)
P4(g)+6H2(g)
③2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将___________ (填“增加”、“减小”或“不变”)。
(5)平衡后容器内P4(g)的物质的量___________ 。
(6)求反应①的K___________ 。
 CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是

(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)
(3)若p2压强恒定为p,则平衡常数Kp=
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s)
 PH3(g)+HI(g)
PH3(g)+HI(g) ②4PH3(g)
 P4(g)+6H2(g)
P4(g)+6H2(g) ③2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将
(5)平衡后容器内P4(g)的物质的量
(6)求反应①的K
您最近一年使用:0次
4 . 下列事实中,不能用勒夏特列原理解释的是
| A.向稀盐酸中加入少量蒸馏水,盐酸中氯离子浓度降低 |
| B.常温时,AgCl在饱和氯化钠溶液中的溶解度小于在水中的溶解度 |
| C.热的纯碱溶液去油污效果更好 |
| D.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
您最近一年使用:0次
名校
5 . 尿酸(Uric acid)的化学式为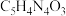 ,可用
,可用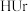 表示。痛风病与关节滑液中尿酸钠(
表示。痛风病与关节滑液中尿酸钠( )的沉积有关,
)的沉积有关, 增多,病情加重,其在体内产生的过程可表示为
增多,病情加重,其在体内产生的过程可表示为 。下列说法不正确的是
。下列说法不正确的是
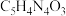 ,可用
,可用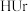 表示。痛风病与关节滑液中尿酸钠(
表示。痛风病与关节滑液中尿酸钠( )的沉积有关,
)的沉积有关, 增多,病情加重,其在体内产生的过程可表示为
增多,病情加重,其在体内产生的过程可表示为 。下列说法不正确的是
。下列说法不正确的是| A.寒冷季节更易诱发关节疼痛 | B.大量饮水会增大痛风病发作的可能性 |
| C.饮食中摄入过多食盐,会加重痛风病病情 | D.痛风病患者应少吃能代谢产生尿酸的食物 |
您最近一年使用:0次
2024-02-11更新
|
129次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期1月月考化学试题
名校
6 . 甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式为:
ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;
ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;
ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。
回答下列问题:
(1)a=______ (用b、c表示),已知反应ⅱ在一定条件下可自发进行,则b______ (填“>”“<”或“=”)0。
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)___ (填“>”“<”或“=”)v(逆),平衡常数_______ (填“变大”“变小”或“不变”)。
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
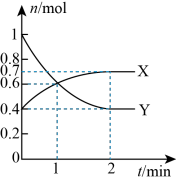
①Y为_____ (填化学式)。
②0~1min时v(CO)为_____ mol/(L·min)。
③该温度下,该反应的平衡常数Kc=______ 。
(4)工业上以 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

______ 。若该反应的 ,
, (
(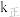 、
、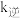 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则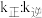
_______ (填“增大”“不变”或“减小”)。
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和 分别取
分别取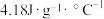 和
和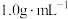 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热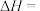
_____  。
。
②下列操作会使所测得的焓变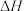 偏小的是
偏小的是______ 。
a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
ⅰ.CO(g)+2H2(g)
 CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。回答下列问题:
(1)a=
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
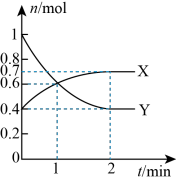
①Y为
②0~1min时v(CO)为
③该温度下,该反应的平衡常数Kc=
(4)工业上以
 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

 ,
, (
(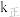 、
、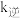 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则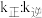
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和
 分别取
分别取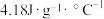 和
和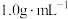 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热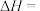
 。
。②下列操作会使所测得的焓变
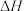 偏小的是
偏小的是a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
您最近一年使用:0次
名校
7 . Ⅰ.实验室用如图所示简易量热计进行中和热的测定实验,请回答。
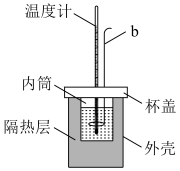
(1)图中仪器b的名称是_______ ;
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式_______ ;
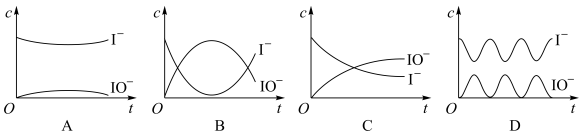
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为_______ ,决定总反应速率的是第_______ 步基元反应。
(4)反应过程中I-和IO-的浓度变化趋势为_______ 。
Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g) S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
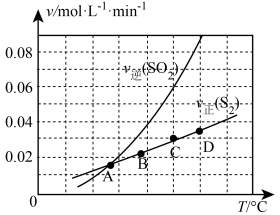
(5)A、B、C、D四点对应的状态中,达到平衡状态的有_______ (填字母)。
(6)该反应的△H_______ 0(填>、<或=)。
(7)下列措施能够增大SO2平衡转化率的是_______。

(1)图中仪器b的名称是
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为
(4)反应过程中I-和IO-的浓度变化趋势为

Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g)
 S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
(5)A、B、C、D四点对应的状态中,达到平衡状态的有
(6)该反应的△H
(7)下列措施能够增大SO2平衡转化率的是_______。
| A.降温 | B.增加C(s)的量 |
| C.减小容器体积 | D.恒压通入一定量SO2 |
您最近一年使用:0次
名校
8 . 下列实验操作、现象、结论均正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入适量KCl固体 Fe(SCN)3+3KCl中加入适量KCl固体 | 溶液的颜色变浅 | 平衡逆向移动 |
| B | 对平衡体系2NO2(g) N2O4(g)压缩体积,增大压强 N2O4(g)压缩体积,增大压强 | 混合气体的颜色变深 | 平衡逆向移动 |
| C | 2mL0.1mol•L-1K2Cr2O7溶液中存在:Cr2O (橙色)+H2O (橙色)+H2O 2CrO 2CrO (黄色)+2H+,向其中滴加5~10滴6mol•L-1NaOH溶液 (黄色)+2H+,向其中滴加5~10滴6mol•L-1NaOH溶液 | 溶液变为橙色 | 平衡逆向移动 |
| D | 分别取5mL0.5mol·L-1H2SO4溶液和5mL0.1mol·L-1H2SO4溶液于两支试管中,然后同时加入5mL0.1mol·L-1Na2S2O3溶液 | 两支试管中的溶液都变浑浊,前者先变浑浊 | 增大H2SO4浓度,可以加快反应速率 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 氯化硫酰(SO2Cl2)常用作氧化剂,它是一种无色液体,熔点:-54.1℃,沸点:69.1℃,可用干燥的SO2和Cl2在活性炭作催化剂的条件下制取:SO2(g)+Cl2(g)⇌SO2Cl2(l) ΔH=-97.3kJ·mol-1。下列有关SO2Cl2制取的说法正确的是
| A.该反应在高温下能自发进行 |
| B.使用活性炭作催化剂能缩短该反应达平衡的时间 |
| C.化学平衡发生移动,该反应平衡常数必发生变化 |
| D.使SO2Cl2液化从平衡体系中分离,能加快正反应速率,增大Cl2转化率 |
您最近一年使用:0次
10 . 下列实验方案不能达到相应目的的是
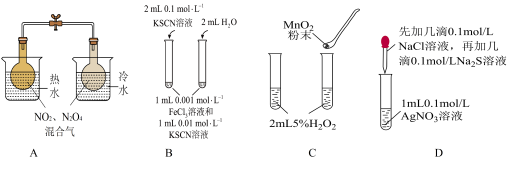

| A.探究温度对化学平衡的影响 | B.研究浓度对化学平衡的影响 |
| C.探究催化剂对反应速率的影响 | D.证明溶解度: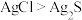 |
您最近一年使用:0次



