名校
1 .  可生产
可生产 并进而制得硫酸等,其反应原理为:
并进而制得硫酸等,其反应原理为: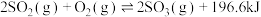 。下列说法正确的是
。下列说法正确的是
 可生产
可生产 并进而制得硫酸等,其反应原理为:
并进而制得硫酸等,其反应原理为: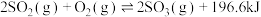 。下列说法正确的是
。下列说法正确的是| A.该反应在工业上需要在高温高压下进行 |
B.反应速率平衡后再通入 、 、 的体积分数一定增加 的体积分数一定增加 |
C.反应在高温、催化剂条件下进行可提高 的平衡转化率 的平衡转化率 |
D. 和 和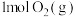 充分反应放出的热量小于196.6kJ 充分反应放出的热量小于196.6kJ |
您最近一年使用:0次
2 . 从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列电离平衡,故可用作酸、碱指示剂:

在上述溶液中加入适量下列物质,最终能使指示剂显黄色的是

在上述溶液中加入适量下列物质,最终能使指示剂显黄色的是
| A.盐酸 | B.NaHCO3溶液 | C.NaHSO4溶液 | D.NaClO(固体) |
您最近一年使用:0次
2022-03-08更新
|
287次组卷
|
9卷引用:第30练 电离平衡-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)第30练 电离平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题3.2.2 酸碱中和滴定和pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.1.1 电离平衡-2021-2022学年高二化学课后培优练(人教版选修4)宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题福建省莆田第二中学2020-2021学年高二上学期期中考试化学试题(已下线)第三章 第一节 弱电解质的电离(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)陕西省西安市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)3.1.2 电离平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河南省温县第一高级中学2021-2022学年高二上学期12月月考化学试题
名校
解题方法
3 . 磷酸亚铁锂电池是新能源汽车的动力电池之一、采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
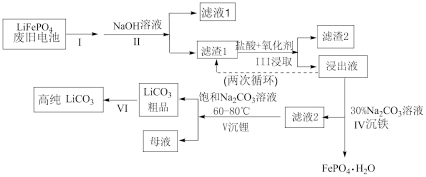
资料:碳酸锂在水中溶解度:
(1)I步操作是粉碎废旧电极,其主要目的是___________ 。
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是___________ 。
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
(4)浸出液中存在大量 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入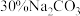 溶液沉铁的主要原理是
溶液沉铁的主要原理是___________ 。
(5)滤液2中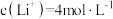 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中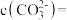
___________ 。[溶液混合后体积变化忽略不计,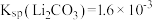 ]
]
(6)为将粗品 提纯,VI步使用
提纯,VI步使用___________ (填“热”或“冰”)水进行洗涤操作,理由是___________ 。
(7)工业上将回收的 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:___________ 。
 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
资料:碳酸锂在水中溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
A. | B.酸性 | C. | D. |
 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入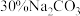 溶液沉铁的主要原理是
溶液沉铁的主要原理是(5)滤液2中
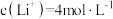 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中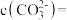
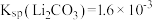 ]
](6)为将粗品
 提纯,VI步使用
提纯,VI步使用(7)工业上将回收的
 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:
您最近一年使用:0次
2022-02-05更新
|
611次组卷
|
7卷引用:专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)
(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)北京市通州区2022届高三查缺补漏化学试题北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题广东省华南师范大学附属中学2022届高三下学期押题预测(三)化学试题重庆市2021-2022学年高三上学期学业质量调研抽测(第一次)化学试卷内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题
名校
4 .  资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。
资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。
Ⅰ. 与
与 催化重整制合成气是研究热点之一、发生的主要反应有:
催化重整制合成气是研究热点之一、发生的主要反应有:
反应①:
反应②: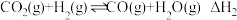
(1)有关化学键键能数据如表:
则反应②的反应热
_______  。
。
(2)对于上述反位体系,下列说法错误的是_______ 。
A.增大 的浓度,反应①②的正反应速率均增加
的浓度,反应①②的正反应速率均增加
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,可提高 的平衡转化率
的平衡转化率
(3)恒压下进行 与
与 催化重整实验。初始压强为
催化重整实验。初始压强为 ,起始投料
,起始投料 ,
, 和
和 的平衡转化率随温度变化曲线如图所示。
的平衡转化率随温度变化曲线如图所示。
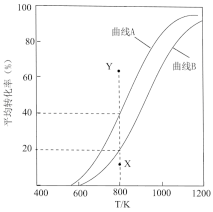
①曲线_______ (填“A”或“B”)表示 的平衡转化率。
的平衡转化率。
②800K,反应至 转化率达到X点时,v(正)
转化率达到X点时,v(正)_______ v(逆)(填“>”、“<”或“=”)。若要使 的转化率由X点达到Y点,改变的外界条件可以是
的转化率由X点达到Y点,改变的外界条件可以是_______ (答一条即可)。
③800K,反应①的分压平衡常数
_______ (分压=总压×物质的量分数)。
Ⅱ.利用电化学装置可实现 和
和 两种分子的耦合转化,其原理如图所示。
两种分子的耦合转化,其原理如图所示。
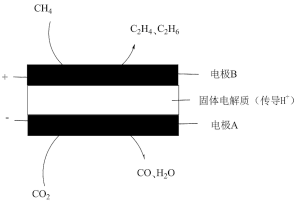
(4)阴极的电极反应式为_______ 。
 资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。
资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。Ⅰ.
 与
与 催化重整制合成气是研究热点之一、发生的主要反应有:
催化重整制合成气是研究热点之一、发生的主要反应有:反应①:

反应②:
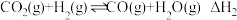
(1)有关化学键键能数据如表:
| 化学键 |  | H-O | C=O |  |
键能/ | 436 | 463 | 803 | 1076 |

 。
。(2)对于上述反位体系,下列说法错误的是
A.增大
 的浓度,反应①②的正反应速率均增加
的浓度,反应①②的正反应速率均增加B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,可提高
 的平衡转化率
的平衡转化率(3)恒压下进行
 与
与 催化重整实验。初始压强为
催化重整实验。初始压强为 ,起始投料
,起始投料 ,
, 和
和 的平衡转化率随温度变化曲线如图所示。
的平衡转化率随温度变化曲线如图所示。
①曲线
 的平衡转化率。
的平衡转化率。②800K,反应至
 转化率达到X点时,v(正)
转化率达到X点时,v(正) 的转化率由X点达到Y点,改变的外界条件可以是
的转化率由X点达到Y点,改变的外界条件可以是③800K,反应①的分压平衡常数

Ⅱ.利用电化学装置可实现
 和
和 两种分子的耦合转化,其原理如图所示。
两种分子的耦合转化,其原理如图所示。
(4)阴极的电极反应式为
您最近一年使用:0次
2022-01-24更新
|
594次组卷
|
4卷引用:专项16 化学反应原理综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)
(已下线)专项16 化学反应原理综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)甘肃省武威第六中学2022届高三下学期第八次诊断考试理综化学试题四川省成都艺术高级中学2021-2022学年高三下学期模拟考试理科综合化学部分试题(三)安徽省合肥市2022届高三上学期第一次教学质量检测化学试题
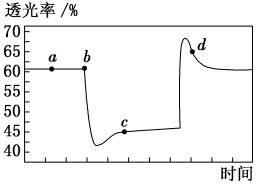
5 . 2NO2(红棕色) N2O4(无色)
N2O4(无色)  。将一定量的NO2充入注射器中并密封,改变活塞位置,气体透光率随时间的变化如图所示(颜色越深,透光率越小)。下列说法正确的是
。将一定量的NO2充入注射器中并密封,改变活塞位置,气体透光率随时间的变化如图所示(颜色越深,透光率越小)。下列说法正确的是
 N2O4(无色)
N2O4(无色)  。将一定量的NO2充入注射器中并密封,改变活塞位置,气体透光率随时间的变化如图所示(颜色越深,透光率越小)。下列说法正确的是
。将一定量的NO2充入注射器中并密封,改变活塞位置,气体透光率随时间的变化如图所示(颜色越深,透光率越小)。下列说法正确的是
| A.a、b、c点:处于平衡状态 |
| B.b点操作:将注射器的活塞向外拉 |
| C.若在c点将温度降低,其透光率将减小 |
| D.d点:υ正<υ逆 |
您最近一年使用:0次
2022-01-23更新
|
463次组卷
|
3卷引用:2022年广东卷高考真题变式题(11-16)
6 . 处理工业废水中 和
和 的工艺流程如下:
的工艺流程如下:

已知:(1)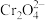 (黄色),
(黄色), (橙色)
(橙色)
(2)常温下, 的溶度积
的溶度积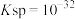
下列说法错误的是
 和
和 的工艺流程如下:
的工艺流程如下:
已知:(1)
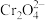 (黄色),
(黄色), (橙色)
(橙色)(2)常温下,
 的溶度积
的溶度积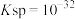
下列说法错误的是
A.第①步存在平衡: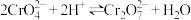 |
B.常温下,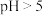 时 时 沉淀完全 沉淀完全 |
C.第②步能说明氧化性: |
D.稀释 溶液时,溶液中各离子浓度均减小 溶液时,溶液中各离子浓度均减小 |
您最近一年使用:0次
2022-01-21更新
|
368次组卷
|
4卷引用:专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)
(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)湖南省长沙市2021-2022学年高三新高考适应性考试化学试题福建省莆田第一中学2021-2022学年高二下学期期中考试化学试题(已下线)题型7 氧化还原反应原理在实际生产中的应用
7 . 《天工开物》中记载:“象牙色,栌木煎水薄染;金黄色,栌木煎水染,复用麻蒿灰淋,碱水漂”。下列说法错误的是
| A.该染色过程伴随化学变化 | B.记载中颜色的变化说明发生了化学平衡的移动 |
| C.麻蒿灰中含有碳酸钾,水溶液显碱性 | D.植物染料色素(栌木中的黄木素)难溶于水 |
您最近一年使用:0次
2022-01-20更新
|
255次组卷
|
3卷引用:卷01 化学与STSE-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)
(已下线)卷01 化学与STSE-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)安徽省部分省示范高中2021~2022学年高二上学期期末联考化学试题河南省三门峡市2022-2023学年高二上学期期末考试化学试题
名校
解题方法
8 . 铬(VI)在溶液中能以多种形式存在。25℃时,调节初始浓度为0.1mol·L-1的Na2CrO4溶液的pH,平衡时铬(VI)在水溶液中各种存在形式的物质的量分数δ(X)与pH的关系如图所示。已知溶液中存在反应:2CrO +2H+
+2H+ Cr2O
Cr2O +H2O。下列说法不正确的是
+H2O。下列说法不正确的是

 +2H+
+2H+ Cr2O
Cr2O +H2O。下列说法不正确的是
+H2O。下列说法不正确的是
| A.铬酸(H2CrO4)的第一步电离为不完全电离 |
B.a点处,δ(CrO )=δ(Cr2O )=δ(Cr2O )> )> |
| C.Ka2(H2CrO4)的数量级为10-7 |
D.若将Na2CrO4溶液加少量水稀释,则 的值减小 的值减小 |
您最近一年使用:0次
9 . 某小组探究 Br2、I2能否将Fe2+氧化,实验如下。
(1)实验i中产生 Fe3+的离子方程式是___________ 。
(2)以上实验体现出氧化性关系:Br2___________ I2(填“>”或“<”)。
(3)针对实验中未检测到Fe3+,小组同学分析:I2+2Fe2+ 2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡
2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡___________ (填“正向”“逆向”或“不移动”)移动,c(Fe3+)增大。
(4)针对小组同学的分析,进行实验i:向的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,加入浓硝酸,黑色固体消失,生成红棕色气体。再向溶液中加入NaCl溶液,出现白色沉淀,证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
针对上述现象,小组同学提出不同观点并对之进行研究。
①观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:___________ 。经证实观点1合理。
②观点2:Fe3+可能由 Ag+氧化产生。
实验iv:向 FeSO4溶液滴加 AgNO3溶液,___________ (填操作、现象),观点2合理。
(5)观点1、2 虽然合理,但加入 AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。
设计实验:取ii的黄色溶液,___________ (填操作、现象)。由此得出结论:不能充分说明(4)中产生 Fe3+的原因是由反应a的平衡移动造成的。
| 实验 | 试剂x | 现象及操作 |
 | 溴水 | i.溶液呈黄色,取出少量滴加KSCN溶液,变红 |
| 碘水 | ii.溶液呈黄色,取出少量滴加KSCN溶液,未变红 |
(2)以上实验体现出氧化性关系:Br2
(3)针对实验中未检测到Fe3+,小组同学分析:I2+2Fe2+
 2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡
2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡(4)针对小组同学的分析,进行实验i:向的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,加入浓硝酸,黑色固体消失,生成红棕色气体。再向溶液中加入NaCl溶液,出现白色沉淀,证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
针对上述现象,小组同学提出不同观点并对之进行研究。
①观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:
②观点2:Fe3+可能由 Ag+氧化产生。
实验iv:向 FeSO4溶液滴加 AgNO3溶液,
(5)观点1、2 虽然合理,但加入 AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。
设计实验:取ii的黄色溶液,
您最近一年使用:0次
名校
10 . 下列事实不能用勒夏特列原理解释的是
| A.二氧化氮转化为四氧化二氮的平衡体系,缩小容器体积后混合气体颜色加深 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.用钠与氯化钾共融的方法制备气态钾: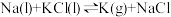 |
D.反应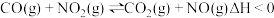 ,达到化学平衡后,升高温度体系的颜色加深 ,达到化学平衡后,升高温度体系的颜色加深 |
您最近一年使用:0次



