1 .  可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:
反应1:
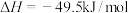
反应2:
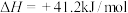 (副反应)
(副反应)
(1) ,该反应的
,该反应的
___________  。
。
(2)将 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数
___________ (保留两位有效数字)。
④分子筛膜反应器可提高反应1的平衡转化率、且实现 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是___________ 。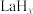 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
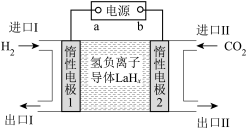
①电极a为电源的___________ (填“正极”或“负极”)。
②生成 的电极反应式为
的电极反应式为___________ 。
③若反应2也同时发生,出口Ⅱ为CO、 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为___________ (
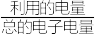 ×100%)。
×100%)。
 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:反应1:

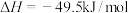
反应2:

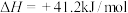 (副反应)
(副反应)(1)
 ,该反应的
,该反应的
 。
。(2)将
 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数

④分子筛膜反应器可提高反应1的平衡转化率、且实现
 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是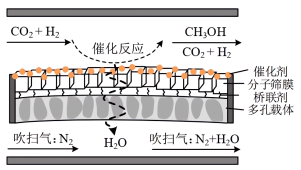
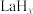 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
①电极a为电源的
②生成
 的电极反应式为
的电极反应式为③若反应2也同时发生,出口Ⅱ为CO、
 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为
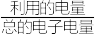 ×100%)。
×100%)。
您最近一年使用:0次
2023-06-03更新
|
704次组卷
|
5卷引用:重庆市巴蜀中学校2023学年高三模拟预测化学试题
重庆市巴蜀中学校2023学年高三模拟预测化学试题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)广西名校2023-2024学年高三上学期仿真卷(一)化学试题湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题湖南省宁乡市实验中学等多校联考2024届高三下学期一轮复习总结性考试(月考)化学试题
名校
解题方法
2 . 一定温度下,在恒容密闭容器中发生反应: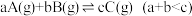 ,达平衡后将体积缩小为原来的一半,则C的体积分数
,达平衡后将体积缩小为原来的一半,则C的体积分数
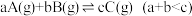 ,达平衡后将体积缩小为原来的一半,则C的体积分数
,达平衡后将体积缩小为原来的一半,则C的体积分数| A.变大 | B.变小 | C.不变 | D.无法判断 |
您最近一年使用:0次
2023-05-15更新
|
404次组卷
|
3卷引用: 重庆市第一中学校2022-2023学年高一下学期期中考试化学试题
名校
3 . 为实现“碳达峰”、“碳中和”目标,可将CO2催化加氢制甲醇。该反应体系中涉及以下两个主要反应:
反应I: △H1<0
△H1<0
反应II: △H2>0
△H2>0
(1)已知101kPa和298K时一些物质的标准摩尔生成热(在101kPa和一定温度下,由最稳定单质生成1mol纯物质的热效应,称为该物质的标准摩尔生成热)数据如表所示:
则反应I的
_______ 。
(2)在密闭容器中上述反应混合体系建立平衡后,下列说法正确的是_______。
(3)向容器中加入1mol CO2、1mol H2,维持压强100kpa发生反应,CO2和H2的平衡转化率随温度变化曲线如图所示。

①曲线_______ (填“L1”或“L2”)表示CO2的平衡转化率。
②温度高于T2K后曲线L2随温度升高而降低的原因为_______ 。
③T1K下反应达到平衡时,H2O(g)的物质的量为_______ mol,反应I的标准平衡常数
_______ (保留1位小数)。(已知:分压=总压×该组分物质的量分数,对于反应: ,
,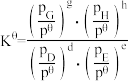 ,其中
,其中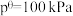 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
(4)利用电催化可将CO2同时转化为多种燃料,装置如图:
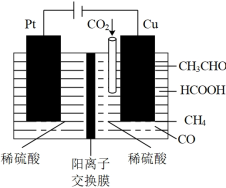
①铜电极上产生CH4的电极反应式为_______ 。
②5.6L(标准状况下) CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g,则生成CO和CH4的体积比为_______ 。
反应I:
 △H1<0
△H1<0反应II:
 △H2>0
△H2>0(1)已知101kPa和298K时一些物质的标准摩尔生成热(在101kPa和一定温度下,由最稳定单质生成1mol纯物质的热效应,称为该物质的标准摩尔生成热)数据如表所示:
| 物质 | H2(g) | CO2(g) | CH3OH(g) | H2O(g) |
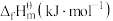 | 0 | -393.5 | -201 | -241.8 |

(2)在密闭容器中上述反应混合体系建立平衡后,下列说法正确的是_______。
| A.增大压强,CO的浓度一定保持不变 |
| B.降低温度,反应II的逆反应速率增大,正反应速率减小 |
| C.增大 CH3OH的浓度,反应II的平衡向正反应方向移动 |
| D.恒温恒压下充入气,反应I的平衡向逆反应方向移动 |

①曲线
②温度高于T2K后曲线L2随温度升高而降低的原因为
③T1K下反应达到平衡时,H2O(g)的物质的量为

 ,
,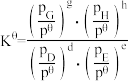 ,其中
,其中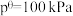 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。(4)利用电催化可将CO2同时转化为多种燃料,装置如图:

①铜电极上产生CH4的电极反应式为
②5.6L(标准状况下) CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g,则生成CO和CH4的体积比为
您最近一年使用:0次
名校
解题方法
4 . 已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
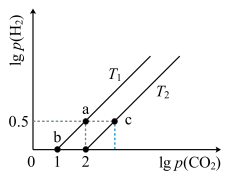
 2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
A.a点时对应的Kp= (MPa) (MPa) |
| B.T1>T2 |
| C.c点对应的p(CO2)=1000MPa |
| D.当容器中CH4与CO的压强比为1∶2时,不能说明该反应达平衡状态 |
您最近一年使用:0次
2023-03-20更新
|
484次组卷
|
3卷引用:重庆市巴蜀中学校2023届高三适应性月考卷(七)化学试题
名校
解题方法
5 . 恒容密闭容器中, 与
与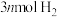 在不同温度下发生反应:
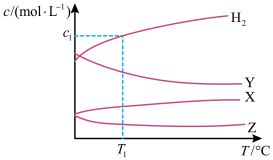
在不同温度下发生反应: ,达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
,达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
下列说法正确的是
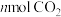 与
与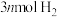 在不同温度下发生反应:
在不同温度下发生反应: ,达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
,达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
下列说法正确的是
| A.该反应的平衡常数随温度升高而增大 |
B.曲线Y表示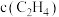 随温度的变化关系 随温度的变化关系 |
C.提高投料比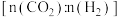 ,可提高 ,可提高 的平衡转化率 的平衡转化率 |
D.其他条件不变,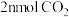 与 与 在 在 ℃下反应,达到平衡时 ℃下反应,达到平衡时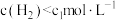 |
您最近一年使用:0次
2023-02-19更新
|
1746次组卷
|
4卷引用:重庆市南开中学校2023届高三模拟考试化学试题
重庆市南开中学校2023届高三模拟考试化学试题广东省深圳市2022-2023学年高三第一次调研考试化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(选择题1-16)(已下线)专题15 化学反应速率和化学平衡
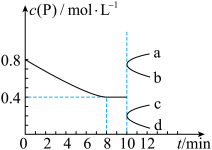
6 . 一定温度下,向容积为5L的恒容密闭容器中充入4molP和8molQ,发生反应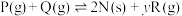
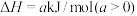 。反应过程中测得气体P的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后升高温度,混合气体的平均相对分子质量将增大(y为正整数),下列说法正确的是
。反应过程中测得气体P的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后升高温度,混合气体的平均相对分子质量将增大(y为正整数),下列说法正确的是
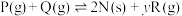
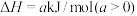 。反应过程中测得气体P的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后升高温度,混合气体的平均相对分子质量将增大(y为正整数),下列说法正确的是
。反应过程中测得气体P的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后升高温度,混合气体的平均相对分子质量将增大(y为正整数),下列说法正确的是
| A.该反应中,化学计量数y=3 |
B.8min时,该反应的平衡常数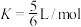 |
| C.反应达到平衡后,向该容器中加入适量P达到新平衡后,平衡常数增大 |
| D.10min时,仅将容器容积缩小至原来的两倍,则气体P的物质的量浓度的变化曲线为d |
您最近一年使用:0次
名校
7 . 下列实验操作对应的现象和结论均正确的是
| 实验方案 | 现象和结论 | |
| A | 向平衡体系 中加入适量KC1固体 中加入适量KC1固体 | 溶液的颜色变浅,说明生成物浓度增加,平衡逆向移动 |
| B | 常温下,等pH等体积的两种酸溶液HX和HY,分别与足量铁反应 | HX放出的氢气多,说明HX的酸,性弱于HY |
| C | 常温下,将 的氨水稀释为 的氨水稀释为 ,测量稀释前后溶液的pH ,测量稀释前后溶液的pH | 稀释后的氨水pH小,说明 的电离程度变小。 的电离程度变小。 |
| D | 向密闭容器中充入 ,一段时间后反应达平衡,将体积压缩至原来的一半 ,一段时间后反应达平衡,将体积压缩至原来的一半 | 气体颜色加深,说明平衡向生成 的方向移动 的方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-12更新
|
130次组卷
|
2卷引用:重庆市2023-2024学年高二下学期开学考试化学试题
名校
8 . 温度为T℃,向体积不等的密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示(V1<V2<V3)。下列说法正确的是
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示(V1<V2<V3)。下列说法正确的是
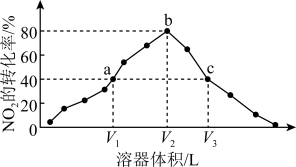
 N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示(V1<V2<V3)。下列说法正确的是
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示(V1<V2<V3)。下列说法正确的是
| A.对a点容器加压,缩小容器体积,则此时v(逆)<v(正) |
| B.若增加C的质量,则a点可能变成b点 |
| C.向a点体系中充入一定量N2,达到新平衡时,NO2转化率将减小 |
| D.图中c点所示条件下v(逆)>v(正) |
您最近一年使用:0次
名校
9 . 某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应:
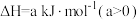 。下列有关说法不正确的是
。下列有关说法不正确的是

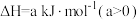 。下列有关说法不正确的是
。下列有关说法不正确的是| A.该反应在高温条件下能自发进行 |
| B.若容器内混合气体的密度不变,则说明反应达到平衡状态 |
| C.若升高体系温度,则正、逆反应速率均增大 |
D.反应达到平衡后,保持容器体积和温度不变,再往容器中充入一定量 ,则平衡逆向移动 ,则平衡逆向移动 |
您最近一年使用:0次
2023-01-13更新
|
280次组卷
|
5卷引用:重庆市七校(江津中学、大足中学、长寿中学、铜梁中学、合川中学、綦江中学、实验中学)2022-2023学年高二上学期期末学情调研化学试题
名校
10 . 下列事实,不能用勒夏特列原理解释的是
| A.工业上采用高压条件合成氨气 |
| B.实验室中常用排饱和食盐水的方法收集Cl2 |
| C.室温下,pH=1的醋酸溶液加水稀释100倍后pH<3 |
| D.往盛有30%H2O2的试管中加入少许MnO2粉末,迅速产生大量气泡 |
您最近一年使用:0次
2022-12-09更新
|
198次组卷
|
3卷引用:重庆市杨家坪中学2022-2023学年高二上学期1月期末考试化学试题



