名校
1 . 某固定容积为1L的密闭容器中,1molA(g)与1molB(g)在催化剂作用下加热到500℃发生反应:A(g)+B(g) C(g)+2D(s) ΔH>0,下列有关说法正确的是
C(g)+2D(s) ΔH>0,下列有关说法正确的是
 C(g)+2D(s) ΔH>0,下列有关说法正确的是
C(g)+2D(s) ΔH>0,下列有关说法正确的是A.升高温度, 增大, 增大, 逆减小 逆减小 |
| B.平衡后再加入1molB,上述反应的ΔH增大 |
| C.通入稀有气体,压强增大,平衡向正反应方向移动 |
| D.若B的平衡转化率为50%,则该反应的平衡常数等于2 |
您最近一年使用:0次
2019-02-07更新
|
344次组卷
|
3卷引用:【市级联考】广东省中山市2018-2019学年高二上学期期末水平测试化学试题
名校
2 . 甲醇是一种重要的可再生能源。已知:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a kJ/mol,CO(g)+2H2(g)=CH3OH(g)△H=b kJ/mol。
(1)写出由CH4和O2制取CH3OH(g)的热化学方程式:__________________________ 。
(2)在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。该反应的化学方程式为N2O4 2NO2。
2NO2。
①0~20s内N2O4的平均反应速率为__________ 。
②该反应的平衡常数表达式K=______________ ,在80℃时该反应的平衡常数K值为____ (保留2位小数)。
③下列说法正确的是___________ 。
A.K值越大,N2O4的转化率越高
B.加压,平衡逆向移动,气体颜色变浅
C.增大N2O4的浓度,新平衡建立过程中正反应速率不断加快
D.起始条件相同,将等量的N2O4分别在A、B两个相同的容器中反应建立平衡,A保持恒温、恒容;B保持恒温、恒压,达到平衡后,A中的N2O4平衡转化率小于B
(3)可逆反应 A(g)+2B(g) xC(g)。
xC(g)。
①在一容积不变的绝热密闭容器中充入10mol A和20molB,一定能判断该反应达到化学平衡状态的是__ (填选项字母)。
A.B的消耗速率等于A的生成速率的2倍 B.温度不变
C.A的转化率和B的转化率相等 D.气体密度不变
E.混合气体的平均相对分子质量不再改变
②恒温:若在体积可变的密闭容器中反应,压缩容器,达新平衡时A的平衡浓度如下:
则容器体积由4L至2L过程中,平衡______ 移动(填正向或逆向);解释容器体积由2L压缩至1L,平衡移动方向,及其可能的原因______________________ 。
(1)写出由CH4和O2制取CH3OH(g)的热化学方程式:
(2)在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.10 | c | d | e |
| c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。该反应的化学方程式为N2O4
 2NO2。
2NO2。①0~20s内N2O4的平均反应速率为
②该反应的平衡常数表达式K=
③下列说法正确的是
A.K值越大,N2O4的转化率越高
B.加压,平衡逆向移动,气体颜色变浅
C.增大N2O4的浓度,新平衡建立过程中正反应速率不断加快
D.起始条件相同,将等量的N2O4分别在A、B两个相同的容器中反应建立平衡,A保持恒温、恒容;B保持恒温、恒压,达到平衡后,A中的N2O4平衡转化率小于B
(3)可逆反应 A(g)+2B(g)
 xC(g)。
xC(g)。①在一容积不变的绝热密闭容器中充入10mol A和20molB,一定能判断该反应达到化学平衡状态的是
A.B的消耗速率等于A的生成速率的2倍 B.温度不变
C.A的转化率和B的转化率相等 D.气体密度不变
E.混合气体的平均相对分子质量不再改变
②恒温:若在体积可变的密闭容器中反应,压缩容器,达新平衡时A的平衡浓度如下:
| 容器体积 | 4L | 2L | 1L |
| A的平衡浓度 | 2mol/L | 3mol/L | 6.5mol/L |
则容器体积由4L至2L过程中,平衡
您最近一年使用:0次
3 . (I)在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g)  2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
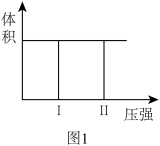
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H_______ 0; 熵变△S__________ 0 ( 填:“< ,> ,= ”)。该反应在___________ (填高温或低温)条件下能自发进行。
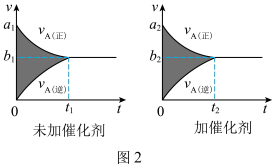
(2)该反应的v-t图象如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示。以下说法正确的是________
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
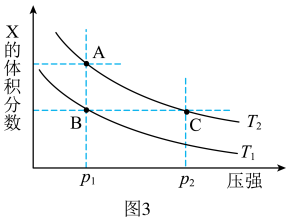
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示。下列说法正确的是_________ 。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g) pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡_______________ 移动(填:向左, 向右 ,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是_______________ mol。
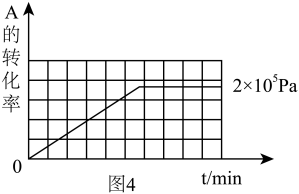
(3)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强)。__________________
 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H


(2)该反应的v-t图象如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示。以下说法正确的是
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示。下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法


(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)
 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是
(3)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强)。
您最近一年使用:0次
10-11高二下·浙江杭州·期中
4 . 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2 mol A和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
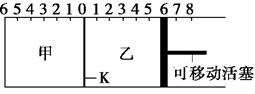
 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
| A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |
| B.达到平衡后,隔板K最终停留在左侧刻度0~2之间 |
| C.达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量 |
| D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
您最近一年使用:0次
名校
5 . 在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下[已知N2(g)十3H2(g) 2NH3(g) △H=-92.4kJ/mol];下列说法正确的是
2NH3(g) △H=-92.4kJ/mol];下列说法正确的是

 2NH3(g) △H=-92.4kJ/mol];下列说法正确的是
2NH3(g) △H=-92.4kJ/mol];下列说法正确的是
| A.2c1>c3 | B.a+b>92.4 | C.2p2<p3 | D.α1+α3<1 |
您最近一年使用:0次
名校
6 . 一定条件下,CH4与H2O(g)发生反应:CH4(g)+ H20(g) C0(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
C0(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

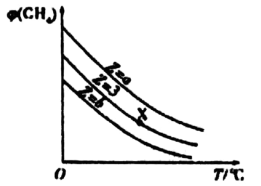
 C0(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
C0(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是 

| A.该反应的焓变△H<0 |
| B.图中X点对应的平衡浪合物中n(H2O)/n(CH4)= 3 |
| C.图中Z的大小为a<3<b |
| D.温度不变时,图中X点对应的平衡在加压后φ(CO)增大 |
您最近一年使用:0次
2018-12-31更新
|
237次组卷
|
2卷引用:云南省大理市下关一中2018-2019学年高二上学期期中考试化学试题
名校
7 . 一定条件下,向一容积可变的密闭容器中充入2 mol X,发生反应:2X(g) Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡浓度不变的是( )
Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡浓度不变的是( )
 Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡浓度不变的是( )
Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡浓度不变的是( )| A.恒温恒压下,充入1 mol X(g) | B.恒温恒容下,充入1 mol Y(g) |
| C.恒温恒压下,充入2 mol Z(g) | D.恒温恒压下,充入1 mol He(g) |
您最近一年使用:0次
2018-12-26更新
|
377次组卷
|
3卷引用:【校级联考】江西省赣州市南康中学、于都中学2018-2019学年高二上学期第三次月考化学试题
名校
8 . 在一密闭容器中,反应aA(g) 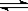 bB (g) 达到平衡后,保持温度不变,将容器体积增加一倍,达到新的平衡时B的浓度是原来的60%,则下列说法不正确的是
bB (g) 达到平衡后,保持温度不变,将容器体积增加一倍,达到新的平衡时B的浓度是原来的60%,则下列说法不正确的是
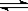 bB (g) 达到平衡后,保持温度不变,将容器体积增加一倍,达到新的平衡时B的浓度是原来的60%,则下列说法不正确的是
bB (g) 达到平衡后,保持温度不变,将容器体积增加一倍,达到新的平衡时B的浓度是原来的60%,则下列说法不正确的是| A.平衡向正反应方向移动了 | B.a >b |
| C.物质B的质量分数增加了 | D.物质A的转化率增大了 |
您最近一年使用:0次
名校
9 . (1)SO2、NOx、CO等气体和可吸入颗粒物对环境的污染尤其严重,为了减少它们对环境的污染,通常采用下列措施进行处理:
已知:①N2(g)+O2(g) 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为____________________________ ,该反应自发进行的条件是_________ 。
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g) 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。
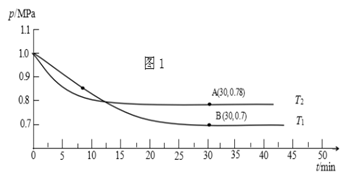
①下列说法不正确的是________ ;
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=__________________________ (提示:用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。______________
(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)______________________________ ;常温下,若用pH=3的盐酸滴定pH=11的氨水生成NH4Cl溶液,则用去两溶液的体积关系:V(盐酸)________ V(氨水)(填“>”、“=”或“<”),滴定终点的判断:__________________ 。
已知:①N2(g)+O2(g)
 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g)
 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。
①下列说法不正确的是
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。

(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)
您最近一年使用:0次
名校
10 . 将NO2装入带活塞的密闭容器中,当反应2NO2(g)  N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是
 N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是| A.升高温度,气体颜色加深,则此正反应为吸热反应 |
| B.慢慢压缩气体体积,平衡向右移动,混合气体颜色较原来深 |
| C.慢慢压缩气体使体积减小一半,压强增大,但小于原来的两倍 |
| D.恒温恒容时,充入惰性气体,压强增大,平衡不会移动 |
您最近一年使用:0次
2018-12-12更新
|
777次组卷
|
10卷引用:重庆市第七中学2018-2019学年高二上学期期中考试化学试题
重庆市第七中学2018-2019学年高二上学期期中考试化学试题(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)河北省武安市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期10月月考化学试题广东省珠海市实验中学2022-2023学年高二上学期第一次段考化学试题(已下线)考点22 化学平衡状态与化学平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)第二章 章末训练



