名校
1 . 某温度时,在一个容积为3L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化曲线如图所示。请回答以下问题:
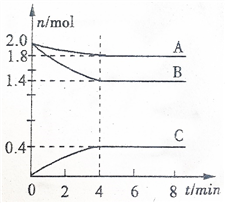
(1)该反应的化学方程式是_________________________________ 。
(2)反应从开始到平衡时,气体B的平均反应速率是___________________ 。
(3)该反应的化学平衡常数表达式是______________________________ 。
(4)其他条件不变,升高温度,逆反应速率将____________ (填“加快”、“减慢”或“不变”)。
(5)反应达平衡后,其他条件不变,增加容器体积,平衡将__________ (填“正向移动”、“逆向移动”或“不移动”)。

(1)该反应的化学方程式是
(2)反应从开始到平衡时,气体B的平均反应速率是
(3)该反应的化学平衡常数表达式是
(4)其他条件不变,升高温度,逆反应速率将
(5)反应达平衡后,其他条件不变,增加容器体积,平衡将
您最近一年使用:0次
2017-11-03更新
|
354次组卷
|
2卷引用:吉林省长春外国语学校2017-2018学年高二上学期期中考试(文)化学试题
名校
2 . 向相同容积的甲乙两容器中都分别充入1molSO2和0.5molO2,若甲容器保持温度容积不变,乙容器保持温度压强不变,分别达到平衡,下列说法正确的是
| A.平衡时,容器内的压强:甲>乙 | B.反应达到平衡时所需时间:甲<乙 |
| C.平衡时,氧气的浓度:甲<乙 | D.平衡时,容器内SO3的体积百分数:甲>乙 |
您最近一年使用:0次
2017-10-28更新
|
587次组卷
|
11卷引用:辽宁省庄河市高级中学2017-2018学年高二10月月考化学试题
辽宁省庄河市高级中学2017-2018学年高二10月月考化学试题河南省洛阳市孟津县第二高级中学2020-2021学年高二上学期9月月考化学试题山东省枣庄市第八中学东校区2020-2021学年高二上学期第二次质量检测化学试题辽宁省大连市一〇三中学2020-2021学年高二10月月考化学试题黑龙江省哈尔滨市师大附中2020-2021学年高二上学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题湖北省武汉市江夏实验高级中学2021-2022学年高二上学期10月考试化学试题天津市实验中学滨海学校黄南民族班2021-2022学年高二上学期期中质量监测化学试题上海交通大学附属中学2022-2023学年高二下学期开学摸底考化学试题吉林省长春市第二实验中学2023-2024学年高二上学期10月月考化学试题天津市实验中学滨海学校2023-2024学年高二上学期期中质量调查化学试题
名校
3 . 一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量。在同温同压下向密闭容器中通入lmolN2和3molH2,达平衡时放出热量为QlkJ;向另一体积相同的容器中通入0.5molN2和l.5molH2,相同温度下达到平衡时放出热量为Q2kJ。则下列叙述正确的是
| A.2Q2l<92.4kJ | B.2Q2=Q1=92.4kJ |
| C.2Q2>Q1=92.4kJ | D.2Q2=Q1<92.4kJ |
您最近一年使用:0次
名校
4 . 一定量的混合气体,在密闭容器中发生如下反应:xA(g) +yB(g)  zC(g),达到平衡后测得A气体的浓度为lmol • L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.4 mol • L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为lmol • L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.4 mol • L-1,则下列叙述正确的是
 zC(g),达到平衡后测得A气体的浓度为lmol • L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.4 mol • L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为lmol • L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.4 mol • L-1,则下列叙述正确的是| A.平衡向正反应方向移动 | B.A + B  C C |
| C.C的体积分数降低 | D.B的转化率降低 |
您最近一年使用:0次
名校
5 . 将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同
2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同
 2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同
2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同 | A.保持体积和温度不变,充入一定量的氧气 | B.保持温度不变,缩小容器的体积 |
| C.保持体积不变,升高温度 | D.保持体积和温度不变,加入BaO2 |
您最近一年使用:0次
2017-10-22更新
|
351次组卷
|
6卷引用:河南省八市2017-2018学年高二上学期第一次质量检测化学试题
名校
6 . 合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
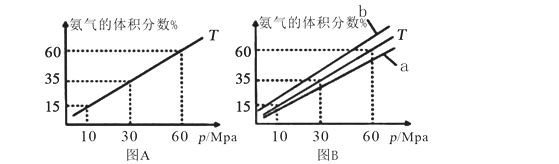
①图A中氨气的体积分数为15%时,H2的转化率为_______ 。
②图B中T=500℃,则温度为450℃时对应的曲线是_______ (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
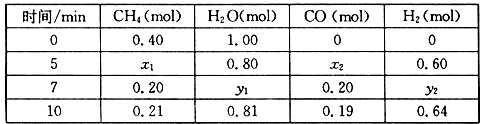
①分析表中数据,判断5 min时反应是否处于平衡状态?_____ (填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________ 。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________ (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________ 。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______ 。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
①当压强从2×105 Pa增加到5×105 Pa时,平衡______ 移动(填“正向、逆向或不”)。
②当压强为1×106 Pa时,此反应的平衡常数表达式为______________ 。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为
②图B中T=500℃,则温度为450℃时对应的曲线是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
①分析表中数据,判断5 min时反应是否处于平衡状态?
②该温度下,上述反应的平衡常数K=
③反应在7~10 min内,CO的物质的量减少的原因可能是
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)
 CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡
②当压强为1×106 Pa时,此反应的平衡常数表达式为
您最近一年使用:0次
2017-10-22更新
|
464次组卷
|
2卷引用:四川省成都市郫都区第一中学2017-2018学年高二上学期第一次月考化学试题
名校
7 . 利用催化技术可将汽车尾气中的 NO和 CO转变成CO2和N2,化学方程式:2NO(g)+2CO(g)  2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
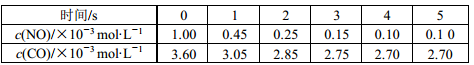
下列说法中不正确的是
 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
下列说法中不正确的是
| A.2 s内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1 |
| B.在该温度下,反应的平衡常数 K=5 |
| C.若将容积缩小为原来的一半, NO 转化率大于 90% |
| D.使用催化剂可以提高整个过程中 CO 和 NO 的处理量 |
您最近一年使用:0次
名校
8 . 下列反应不能用勒夏特例原理解释的是( )
| A.光照新制的氯水时 溶液的 pH逐渐减小 |
| B.锌与稀硫酸反应,加入少量硫酸铜反应速率加快 |
| C.可用浓氨水和氢氧化钠固体快速制取氨气 |
| D.增大压强,有利于SO2和O2反应生成 SO3 |
您最近一年使用:0次
2017-10-20更新
|
554次组卷
|
3卷引用:四川省成都市第七中学2017-2018学年高二上学期第一次月考化学试题
名校
9 . (1)在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在—定温度下使其发生反应:H2(g)+I2(g)  2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率
2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______ (填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
(2)火箭残骸中存在红棕色气体,原因为:N2O4 2NO2(g) △H
2NO2(g) △H
①当温度升高时,气体颜色变深,则反应为_______________ ( “吸热”或“放热”)反应。
②T℃,将1molN2O4充入恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态是____________
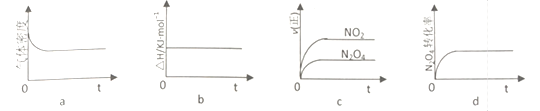
③T℃,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___________ (填“增大”“ 不变”或“减小”)。
(3)已知 4HCl(g)+O2(g) 2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:

①写出该反应的热化学方程式___________________ 。
②断开1 mol H-O键与断开1 molH-C1键所需能量相差约为_________ kJ,H2O中H-O键比HCl中H-Cl键___________ (填“强”或“弱”)。
 2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率
2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率(2)火箭残骸中存在红棕色气体,原因为:N2O4
 2NO2(g) △H
2NO2(g) △H①当温度升高时,气体颜色变深,则反应为
②T℃,将1molN2O4充入恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态是
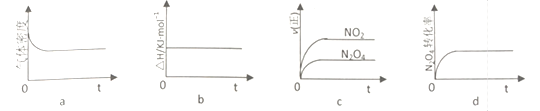
③T℃,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数
(3)已知 4HCl(g)+O2(g)
 2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
①写出该反应的热化学方程式
②断开1 mol H-O键与断开1 molH-C1键所需能量相差约为
您最近一年使用:0次
名校
10 . 下列说法中,能说明化学平衡一定向逆反应方向移动的是
A.N2O4(g) 2NO2(g),改变某一条件后,气体颜色变浅 2NO2(g),改变某一条件后,气体颜色变浅 |
B.N2(g)+3H2(g) 2NH3(g),改变某一条件后,NH3的体积分数减少 2NH3(g),改变某一条件后,NH3的体积分数减少 |
C.H2(g)+I2(g) 2HI(g),单位时间内消耗H2和HI的物质的量之比等于1∶2 2HI(g),单位时间内消耗H2和HI的物质的量之比等于1∶2 |
D.2SO2(g)+O2(g) 2SO3(g),恒温恒压条件下,充入He 2SO3(g),恒温恒压条件下,充入He |
您最近一年使用:0次



