名校
1 . 下列事实不能用平衡移动原理解释的是
| A.由H2、I2(g)、HI组成的恒压平衡体系,加入氦气后颜色变浅 |
| B.农村盐碱地(主要含Na2CO3等)加入石膏可降低土壤碱性 |
| C.蒸馏水和0.1 mol·L-1 NaOH溶液中的c(OH-),前者大于后者 |
| D.向含有少量Fe3+的MgCl2酸性溶液中加MgCO3,可将Fe3+转化成Fe(OH)3除去 |
您最近一年使用:0次
名校
解题方法
2 . 一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 2 | 4 | 6 | 8 |
| n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
| A.反应在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1 |
| B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大 |
| C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10% |
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时 减小 减小 |
您最近一年使用:0次
2017-02-17更新
|
712次组卷
|
7卷引用:2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷
名校
解题方法
3 . 为探究外界条件对反应:mA(g) +nB(g) cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
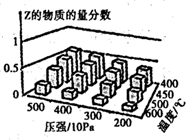
 cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
| A.在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大 |
| B.升高温度,正、逆反应速率都增大,平衡常数增大 |
| C.△H<0 m + n >c |
| D.△H>0 m +n<c |
您最近一年使用:0次
2016-12-09更新
|
230次组卷
|
3卷引用:2015-2016学年河南省南阳一中高二下期末模拟化学试卷
4 . 在一定条件下,某可逆反应aA(g)+bB(s)⇌cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是
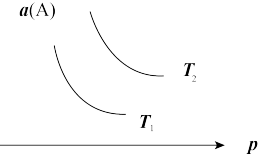

| A.a+b<c |
| B.若T2>T1,则该反应在高温下易自发进行 |
| C.△H>0 |
| D.若T2<T1,则该反应一定不能自发进行 |
您最近一年使用:0次
名校
5 . 已知反应:2NO2(红棕色) N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

 N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
| A.b点的操作是拉伸注射器 |
| B.d点:v(正)>v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
您最近一年使用:0次
2016-12-09更新
|
113次组卷
|
2卷引用:2016届湖南省长沙长郡中学高三下学期第六次月考化学试卷
解题方法
6 . 下列各表述与示意图一致的是


| A.图①表示室温时,用0.1 mol.L-1盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化 |
B.T℃时,反应2NO2(g) N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 |
C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g) 2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 |
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g) Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时  将增大 将增大 |
您最近一年使用:0次
7 . 在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)⇌2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
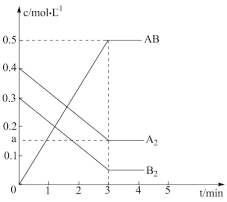
(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线_______ 。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向_______ 反应方向进行(填“正”或“逆”)。判断依据是_______ 。反应达到平衡后,各物质的体积分数与原平衡相比_______ (填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定

(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
您最近一年使用:0次
名校
8 . 将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
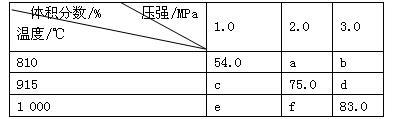
 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
| A.a<54.0 |
| B.b> f |
| C.915 ℃,2.0 MPa时E的转化率为60% |
| D.K(1000 ℃)>K(810 ℃) |
您最近一年使用:0次
2016-12-09更新
|
371次组卷
|
2卷引用:2014-2015学年江苏省扬州市高二下学期期末考试化学试卷
13-14高二上·吉林·期末
9 . 已知2NO2(g) N2O4(g)ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g)ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
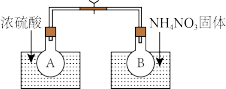
请回答:
(1)A中的现象_____________ ,B中的现象_______________________ ;
(2)由此可知,降低温度,该化学平衡向_____ (填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为___________ ,升高温度,该反应中NO2的转化率将________ (填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(4)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后颜色变深的原因是_________________________ ;
②一段时间后气体颜色又变浅的原因是__________________________ ;
③由此实验得出的结论是___________________ 。
(5)将第三支针筒活塞拉至20cm3处,该同学观察到的现象是________________ ;在此过程中,该反应的化学平衡常数将________ (填“增大”、“减小”或“不变”,下同),NO2的转化率将____ 。
 N2O4(g)ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g)ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。

请回答:
(1)A中的现象
(2)由此可知,降低温度,该化学平衡向
(3)该化学反应的浓度平衡常数表达式为
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(4)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后颜色变深的原因是
②一段时间后气体颜色又变浅的原因是
③由此实验得出的结论是
(5)将第三支针筒活塞拉至20cm3处,该同学观察到的现象是
您最近一年使用:0次
10 . 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO气体,写出反应的热化学方程式________ 。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol/(L·min),则平衡后n(CO)=________ mol,关于该平衡的下列说法正确的是________ 。
a.增大压强,平衡一定向右移动
b.其它条件不变,升高温度,化学反应速率一定增大
c.其它条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.向平衡后的容器中再充人0. 2mol NO和0.1mol CO,化学平衡常数增大
e.达到平衡后v正(NO)=2v逆(N2)
(3)其它条件相同,tmin时不同温度下测得NO的转化率如图所示。A点的反应速率v正________ v逆(填><或=),A、B两点反应的平衡常数较大的是_________ (填A或B)。
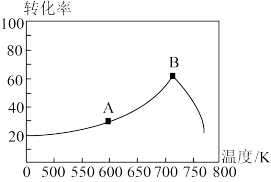
(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH )较小,试分析原因:
)较小,试分析原因:________ .0.1mol·L-1NH4NO3溶液中离子浓度由大到小的顺序是________ ,常温下NO 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=________ mol·L-1(保留两位有效数字)。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1)
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO2(g)+N2(g) △H=-748kJ·mol-12CO(g)+O2(g)=2CO2(g) △H2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO气体,写出反应的热化学方程式
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol/(L·min),则平衡后n(CO)=
a.增大压强,平衡一定向右移动
b.其它条件不变,升高温度,化学反应速率一定增大
c.其它条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.向平衡后的容器中再充人0. 2mol NO和0.1mol CO,化学平衡常数增大
e.达到平衡后v正(NO)=2v逆(N2)
(3)其它条件相同,tmin时不同温度下测得NO的转化率如图所示。A点的反应速率v正

(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH
 )较小,试分析原因:
)较小,试分析原因: 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=
您最近一年使用:0次



