名校
1 . 在一定温度下,2HI(g) H2(g)+I2(g) △H>0的反应达到平衡,下列条件的改变将使混含气体颜色加深的是
H2(g)+I2(g) △H>0的反应达到平衡,下列条件的改变将使混含气体颜色加深的是
 H2(g)+I2(g) △H>0的反应达到平衡,下列条件的改变将使混含气体颜色加深的是
H2(g)+I2(g) △H>0的反应达到平衡,下列条件的改变将使混含气体颜色加深的是| A.降低HI的浓度 | B.升高反应温度 | C.增大容器体积 | D.增大氢气浓度 |
您最近一年使用:0次
2017-08-20更新
|
349次组卷
|
3卷引用:广西桂林市2016-2017学年高二下学期期末质量检测化学试题
2 . 在容积一定的密闭器中发生可逆反应:A(g)+2B(g)  2C(g)
2C(g)  H=+Q(Q>0),条件变化时,影响平衡移动的关系如图所示。下列说法不正确的是
H=+Q(Q>0),条件变化时,影响平衡移动的关系如图所示。下列说法不正确的是

 2C(g)
2C(g)  H=+Q(Q>0),条件变化时,影响平衡移动的关系如图所示。下列说法不正确的是
H=+Q(Q>0),条件变化时,影响平衡移动的关系如图所示。下列说法不正确的是
A.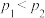 ,纵坐标指A的质量分数 ,纵坐标指A的质量分数 |
B. ,纵坐标指C的质量分数 ,纵坐标指C的质量分数 |
C. ,纵坐标指混合气体的平均摩尔质量 ,纵坐标指混合气体的平均摩尔质量 |
D. ,纵坐标指A的转化率 ,纵坐标指A的转化率 |
您最近一年使用:0次
2017-06-29更新
|
387次组卷
|
5卷引用:江西省玉山县第一中学2016-2017学年高一(19-31班)下学期期中考试化学试题
江西省玉山县第一中学2016-2017学年高一(19-31班)下学期期中考试化学试题北京市第161中学2017-2018学年高二上学期期中适应性训练化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象新疆昌吉州教育共同体2020-2021学年高二上学期期中考试化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(精讲)-2022年一轮复习讲练测
名校
解题方法
3 . 丙烷脱氢制丙烯是液化气生产化工原料的重要途径。回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2217.8 kJ/mol、2049 kJ/mol、285.8 kJ/mol。写出丙烷脱氢制丙烯的热化学方程式:____________________________ 。
(2)实验测得在总压强分别为p1和p2时,平衡时丙烷及丙烯的物质的量分数如图所示:
①压强:p1____ (填“>”或“<”)p2。
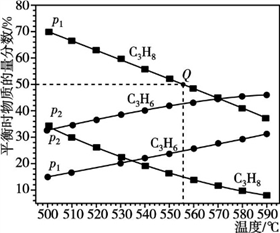
②已知p1=0.1 MPa,Q点对应温度下该反应的平衡常数Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:
2C3H8(g)+O2(g) = 2C3H6(g)+2H2O(g) ΔH=-235 kJ·mol-1
通入O2的目的是_________________________________________ 。
(4)有些学者研究用CO2重整丙烷:CO2(g)+C3H8(g) C3H6(g)+CO(g)+H2O(g) ΔH,下表列出了按不同投料比
C3H6(g)+CO(g)+H2O(g) ΔH,下表列出了按不同投料比 和不同温度下丙烷的平衡转化率。
和不同温度下丙烷的平衡转化率。
①该重整反应ΔH____ (填“>”或“<”)0。
②由实验数据知,适宜的n(CO2)∶n(C3H8)为____ ,温度为____ 。
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2217.8 kJ/mol、2049 kJ/mol、285.8 kJ/mol。写出丙烷脱氢制丙烯的热化学方程式:
(2)实验测得在总压强分别为p1和p2时,平衡时丙烷及丙烯的物质的量分数如图所示:

①压强:p1
②已知p1=0.1 MPa,Q点对应温度下该反应的平衡常数Kp=
(3)目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:
2C3H8(g)+O2(g) = 2C3H6(g)+2H2O(g) ΔH=-235 kJ·mol-1
通入O2的目的是
(4)有些学者研究用CO2重整丙烷:CO2(g)+C3H8(g)
 C3H6(g)+CO(g)+H2O(g) ΔH,下表列出了按不同投料比
C3H6(g)+CO(g)+H2O(g) ΔH,下表列出了按不同投料比 和不同温度下丙烷的平衡转化率。
和不同温度下丙烷的平衡转化率。| n(CO2)∶n(C3H8) | 600 K | 700 K | 800 K | 900 K | 1 000 K |
| 1∶1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1∶2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1∶3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
②由实验数据知,适宜的n(CO2)∶n(C3H8)为
您最近一年使用:0次
名校
4 . 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
PCl5(g)=====PCl3(g)+Cl2(g) △H=akJ/mol(a>0)
0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是
PCl5(g)=====PCl3(g)+Cl2(g) △H=akJ/mol(a>0)
0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是

| A.0~4min的平均速率v(Cl2)=0.05mol/(L·min ) |
| B.10min时改变的条件是分离出一定量的PCl5 |
| C.起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ |
| D.温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆) |
您最近一年使用:0次
2017-05-06更新
|
684次组卷
|
3卷引用:江苏省南通、扬州、泰州市2017届高三第三次模拟考试化学试题
名校
5 . 氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g) 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1
③4NO(g)+6H2O(g) 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________ 。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________ 。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是_________________ ;测得B(X,60)点时N2的转化率为50%,则X=________ 。
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________ (用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________ 。
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g)
 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1③4NO(g)+6H2O(g)
 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式
(二)工业合成氨的原理为:N2(g)+3H2(g)
 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。(1)下列反应条件的控制不能用勒夏特列原理解释的是
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是

(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:
您最近一年使用:0次
2017-04-25更新
|
865次组卷
|
3卷引用:山西省2017届高三高考考前质量检测(二)理科综合化学试题
解题方法
6 . 可逆反应m A(s)+n B(g) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
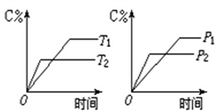
下列叙述正确的是( )
 e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
下列叙述正确的是( )
| A.达平衡后,若升温,则K减小 |
| B.达平衡后,加入催化剂C%增大 |
| C.化学方程式中n>e+f |
| D.达平衡后,若增加A的量,B的转化率增大 |
您最近一年使用:0次
7 . 一定条件下,体积为10L的密闭容器中,2molX和1molY进行反应:2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的 |
| C.若压强增大1倍,则物质Y的转化率增大1倍 |
| D.若升高温度,X的浓度增大,则该反应的正反应为吸热反应 |
您最近一年使用:0次
8 . 下列图示与对应的叙述相符的是
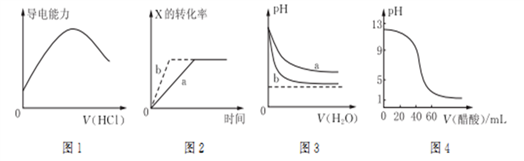
| A.图1表示向氨水中通入HCl气体,溶液的导电能力变化 |
B.图2所示反应:X(g)+2Y(g)  3Z(g),b曲线表示的一定是增大压强 3Z(g),b曲线表示的一定是增大压强 |
| C.图3可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水 |
| D.图4可表示用0.100 0 mol/L,醋酸滴定40.00 mL 0.100 0 mol/L NaOH溶液得到的滴定曲线 |
您最近一年使用:0次
2017-04-02更新
|
480次组卷
|
2卷引用:2017届江苏省南通市高三高考全真模拟(三)化学试卷
9 . 在①、②、③容积不等的恒容密闭容器中,均充入0.lmolCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g)  CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
下列说法正确的是
 CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示: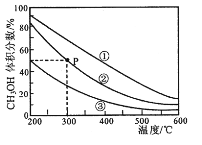
下列说法正确的是
| A.该反应的正反应为放热反应 |
| B.三个容器容积:①>②>③ |
| C.在P点,CO转化率为75% |
| D.在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆 |
您最近一年使用:0次
2017-03-22更新
|
683次组卷
|
5卷引用:2017届江苏省苏锡常镇四市高三教学情况调研(一)化学试卷
名校
10 . T℃时,向10L容积不变的密闭容器中加入1.0molNH2COONH4,发生反应NH2COONH4(s) CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
 CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是| A.0~5min内,v(CO2)=0.16mol·L-1·min-1 |
| B.氨气体积分数不变时,该反应一定达到平衡状态 |
| C.平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大 |
| D.其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80% |
您最近一年使用:0次
2017-03-16更新
|
530次组卷
|
3卷引用:2017届河北省张家口市蔚县一中高三第一学期期末教学质量监测化学试卷



