1 . 在一体积可变的密闭容器中,加入一定量的X、Y、Z,发生反应mX(g)+nY(g) pZ(g) △H=Q kJ/mol。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。
pZ(g) △H=Q kJ/mol。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。
下列说法不正确的是
 pZ(g) △H=Q kJ/mol。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。
pZ(g) △H=Q kJ/mol。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。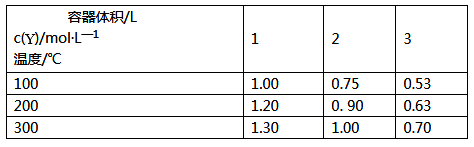
下列说法不正确的是
| A.m+n>p |
| B.Q <0 |
| C.体积不变,温度升高,平衡向逆反应方向移动 |
| D.温度不变,压强增大,Y的质量分数增大 |
您最近一年使用:0次
名校
2 . 在一体积可变的密闭容器中,加入一定量的X、Y、Z,发生反应mX(g)+nY(g) pZ(g)ΔH=QkJ·mol-1。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。
pZ(g)ΔH=QkJ·mol-1。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。
下列说法不正确的是
 pZ(g)ΔH=QkJ·mol-1。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。
pZ(g)ΔH=QkJ·mol-1。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。容器体积/L c(Y)/(mol·L-1) 温度/℃ | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
| A.m+n>p |
| B.Q<0 |
| C.体积不变,温度升高,平衡向逆反应方向移动 |
| D.温度不变,压强增大,Y的质量分数增大 |
您最近一年使用:0次
2017-03-11更新
|
336次组卷
|
2卷引用:2016-2017学年河北省张家口市高二上学期期末考试化学试卷
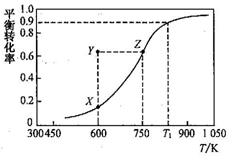
3 . 甲醇脱氢可制取甲醛:CH3OH(g) HCHO(g)+ H2(g), 甲醇的平衡转化率随温度变化的曲线如右图所示(已知反应在IL 的密闭容器中进行)。下列有关说法正确的是
HCHO(g)+ H2(g), 甲醇的平衡转化率随温度变化的曲线如右图所示(已知反应在IL 的密闭容器中进行)。下列有关说法正确的是
 HCHO(g)+ H2(g), 甲醇的平衡转化率随温度变化的曲线如右图所示(已知反应在IL 的密闭容器中进行)。下列有关说法正确的是
HCHO(g)+ H2(g), 甲醇的平衡转化率随温度变化的曲线如右图所示(已知反应在IL 的密闭容器中进行)。下列有关说法正确的是 
| A.平衡常数:K600K<K750K |
| B.从Y到Z点可通过增大压强实现 |
| C.在TlK时,该反应的平衡常数为8.1 |
| D.若工业上利用此反应进行生产,为了提高经济效益将反应温度升高至1050K以上 |
您最近一年使用:0次
名校
4 . 某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是

| A.反应达到平衡时,X的转化率为80% |
B.该反应的平衡常数表达式为K=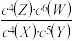 |
| C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动 |
| D.改变温度可以改变此反应的平衡常数 |
您最近一年使用:0次
名校
5 . 已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
 N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
| A.b点到c点的实验现象是气体颜色先变深后变浅,最后气体颜色比a点还要深 |
| B.c点与a点相比,n(NO2)减小,混合气体密度增大 |
| C.d 点:v(正)<v(逆) |
D.若在注射器中对反应H2(g)+I2(g)  2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 |
您最近一年使用:0次
2017-02-28更新
|
320次组卷
|
3卷引用:2016-2017学年浙江省台州市高二上学期期末质量评估考试化学试卷
6 . 在一定条件下,反应A2+ B2 2AB △H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
2AB △H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
 2AB △H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
2AB △H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是 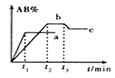
| A.△H>0 | B.AB一定是气体物质 |
| C.反应温度a低于b | D.A2、B2中最少有一种是气态物质 |
您最近一年使用:0次
名校
7 . 下列叙述中正确的是
A.向氨水中不断通入CO2, 随着CO2的增加, 不断变大 不断变大 |
| B.在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu |
| C.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)= 4Fe(OH)3(s) △H>0, △S<0 |
D.将图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深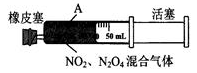 |
您最近一年使用:0次
2017-02-28更新
|
453次组卷
|
3卷引用:2017届江苏省淮阴中学高三下学期期初考试化学试卷
名校
8 . 下列关于各图的叙述正确的是
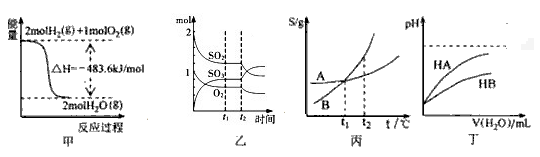

| A.图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 |
B.图乙表示一定条件下进行的反应2SO2+O2 2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积 2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积 |
| C.图丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω(A) |
| D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH |
您最近一年使用:0次
名校
9 . 反应N2O4(g) 2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是
2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是
 2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是
2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是
| A.由图可知B点时平衡常数与C点时相同 |
| B.A、C两点气体的平均相对分子质量:A<C |
| C.A、C两点气体的颜色:A深,C浅 |
| D.保持容器体积不变,再充入N2O4气体,平衡逆向移动 |
您最近一年使用:0次
名校
解题方法
10 . 乙酸是重要的有机化工原料之一,目前世界上一半以上的乙酸都都采用甲醇与CO反应来制备.某实验小组在一个恒压密闭容器中加入0.20molCH3OH和0.22molCO气体,发生反应CH3OH(g)+CO(g) CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
已知:2CO(g)+O2(g)═2CO2(g) △H=﹣566kJ·mol-1
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(I) △H=﹣1529kJ·mol-1
CH3COOH(I)+2O2(g)═2CO2(g)+2H2O(I) △H=﹣874kJ·mol-1
按要求回答下列问题:
(1)求工业制乙酸反应:CH3OH(g)+CO(g) CH3COOH(I) △H=
CH3COOH(I) △H= ______ kJ·mol-1
(2)在温度为T2时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为_________ mol·min-1.
(3)在温度为T2时,该反应的平衡常数K=_________ ;在T3温度下,C点时,ν(正) ____ ν(逆)(填“>”、“<”或“=” )。
(4)在温度为T2时,往上述已达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,平衡的移动方向为__________ (填“向左”或“向右”或“不移动” )
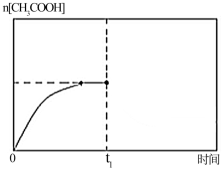
(5)在温度为T1时,乙酸的物质的量随时间变化的趋势曲线如下图所示.当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度。请在图中画出t1时刻后乙酸物质的量的变化总趋势曲线.
__________
 CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.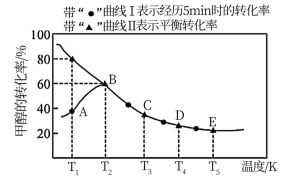
已知:2CO(g)+O2(g)═2CO2(g) △H=﹣566kJ·mol-1
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(I) △H=﹣1529kJ·mol-1
CH3COOH(I)+2O2(g)═2CO2(g)+2H2O(I) △H=﹣874kJ·mol-1
按要求回答下列问题:
(1)求工业制乙酸反应:CH3OH(g)+CO(g)
 CH3COOH(I) △H=
CH3COOH(I) △H= (2)在温度为T2时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为
(3)在温度为T2时,该反应的平衡常数K=
(4)在温度为T2时,往上述已达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,平衡的移动方向为
(5)在温度为T1时,乙酸的物质的量随时间变化的趋势曲线如下图所示.当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度。请在图中画出t1时刻后乙酸物质的量的变化总趋势曲线.
您最近一年使用:0次



