名校
解题方法
1 . 已知
 ,平衡体系中气体的平均摩尔质量(
,平衡体系中气体的平均摩尔质量(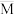 )在不同温度下随压强p的变化曲线如图所示。下列说法正确的是
)在不同温度下随压强p的变化曲线如图所示。下列说法正确的是
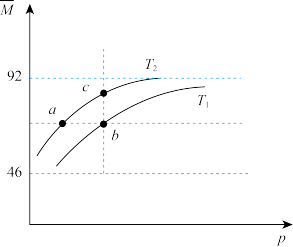

 ,平衡体系中气体的平均摩尔质量(
,平衡体系中气体的平均摩尔质量(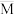 )在不同温度下随压强p的变化曲线如图所示。下列说法正确的是
)在不同温度下随压强p的变化曲线如图所示。下列说法正确的是
A.温度: |
B.平衡常数: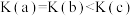 |
C.反应速率: |
D.当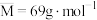 时, 时,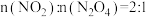 |
您最近一年使用:0次
2022-12-04更新
|
554次组卷
|
11卷引用:山东省滕州市第二中学2022-2023学年高三上学期11月定时检测化学试题
山东省滕州市第二中学2022-2023学年高三上学期11月定时检测化学试题安徽省淮北市树人高级中学2020-2021学年高二上学期第四阶段考试化学试题湖北省石首市第一中学2021-2022学年高二上学期10月月考化学试题湖北省石首市第一中学2021-2022学年高二上学期12月月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高三上学期期中检测化学试题山东省枣庄滕州市2022-2023学年高三上学期期中考试化学试题河北省张家口市2017-2018学年高二上学期期末考试化学试题安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题江西省景德镇一中2022-2023学年高一下学期期中考试(18班)化学试题.第二章 章末训练重庆市长寿中学校2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
2 . 某反应4A(g)⇌mB(g)+2C(g) ΔH<0,正反应速率的变化如图。其中t1、t2、t3、t4只改变一个条件,t2时刻图像变化并非加入催化剂引起,下列叙述中错误 的是


| A.m=2 | B.t1时增大了A的浓度 |
| C.t3时降低了温度 | D.t1至t4时间段内,化学平衡常数的值保持不变 |
您最近一年使用:0次
2022-12-02更新
|
442次组卷
|
2卷引用:黑龙江省虎林市高级中学2022-2023学年高二9月月考化学试题
名校
3 . 一定温度下,在三个容积均为 的恒容密闭容器中进行反应:
的恒容密闭容器中进行反应: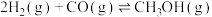 ,并达到平衡。下列说法正确的是
,并达到平衡。下列说法正确的是
 的恒容密闭容器中进行反应:
的恒容密闭容器中进行反应: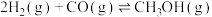 ,并达到平衡。下列说法正确的是
,并达到平衡。下列说法正确的是| 容器 | 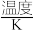 |  | 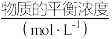 | ||
 |  | 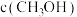 | 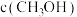 | ||
| I | 400 | 0.20 | 0.10 | 0 | 0.080 |
| II | 400 | 0.40 | 0.20 | 0 | |
| III | 500 | 0 | 0 | 0.10 | 0.025 |
| A.该反应的正反应吸热 |
| B.达到平衡时,容器I中反应物转化率比容器II中的大 |
C.达到平衡时,容器II中 大于容器I中 大于容器I中 的两倍 的两倍 |
| D.达到平衡时,容器III中的正反应速率比容器I中的大 |
您最近一年使用:0次
2022-11-29更新
|
209次组卷
|
2卷引用:河南省安阳市第三十九中学2022-2023学年高二上学期第二次考试化学试题
名校
解题方法
4 . 下列说法不正确的是
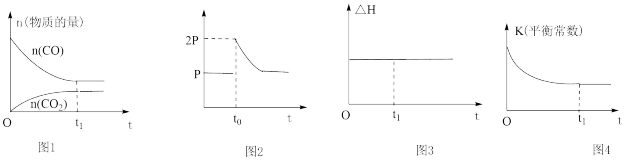

A.图1可表示将一定量的CO和NO通入刚性容器发生反应:2NO(g)+2CO(g) 2CO2(g)+N2(g),物质的量随时间的变化关系,且t1时候达到平衡 2CO2(g)+N2(g),物质的量随时间的变化关系,且t1时候达到平衡 |
| B.图2可表示反应CaCO3(s)=CaO(s)+CO2(g),在t0时刻将容器的体积缩小为原来的一半后再次平衡的过程中压强随时间的变化关系 |
| C.图3可表示反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH与时间的变化关系,且t1时候不一定达到平衡 |
D.图4可表示在绝热容器中充入一定量的A和B,发生反应mA(g)+nB(g) pC(g)+qD(g) ΔH<0,平衡常数与时间的关系图,且t1时候达到平衡 pC(g)+qD(g) ΔH<0,平衡常数与时间的关系图,且t1时候达到平衡 |
您最近一年使用:0次
2022-11-22更新
|
294次组卷
|
2卷引用:陕西省咸阳市实验中学 2022-2023学年高二上学期第三次月考化学试题
名校
解题方法
5 . 工业上利用 和
和 制
制 的反应为
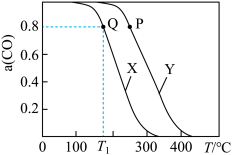
的反应为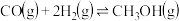 ,实验测得在两种不同压强下,
,实验测得在两种不同压强下, 的平衡转化率
的平衡转化率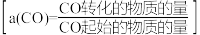 与温度(T)的关系如图所示,查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比,下列说法正确的是
与温度(T)的关系如图所示,查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比,下列说法正确的是
 和
和 制
制 的反应为
的反应为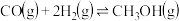 ,实验测得在两种不同压强下,
,实验测得在两种不同压强下, 的平衡转化率
的平衡转化率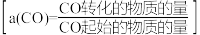 与温度(T)的关系如图所示,查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比,下列说法正确的是
与温度(T)的关系如图所示,查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比,下列说法正确的是
A.反应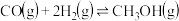 的 的 |
| B.图中曲线X所对应的压强大于曲线Y所对应的压强 |
C.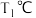 , ,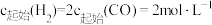 时,平衡常数 时,平衡常数 |
| D.图中P点所示条件下,延长反应的时间能提高CO转化率 |
您最近一年使用:0次
2022-11-19更新
|
280次组卷
|
3卷引用:江苏省南通市如东县2022-2023学年高二上学期10月月考化学试题
6 . 2molSO2和1molO2在一定条件反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0。若恒温恒容条件下SO2的转化率为a%;恒温恒压条件下SO2的转化率为b%;恒容绝热条件下SO2的转化率为c%;则它们之间的关系是
| A.a% > b%> c% | B.b%> a% >c% | C.a% >c% > b% | D.b%> c% >a% |
您最近一年使用:0次
名校
7 . 在一定温度下的密闭容器中发生反应: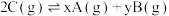 ,平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断不正确的是
,平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断不正确的是
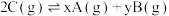 ,平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断不正确的是
,平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断不正确的是A.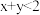 | B.平衡向正反应方向移动 |
| C.C的转化率增大 | D.B的体积分数增大 |
您最近一年使用:0次
2022-10-29更新
|
284次组卷
|
3卷引用:广东省江门市蓬江区棠下中学2022-2023学年高二上学期第一次月考化学试题
8 . 相同温度下,体积相等的两个恒容密闭容器中发生如下反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表所示:
下列叙述错误的是
 2NH3(g) ΔH=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表所示:| 容器编号 | 起始时各物质物质的量/mol | 到达平衡时能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:27.78 kJ |
| ② | 0 | 0 | 2 | 吸收热量:Q kJ |
| A.平衡时,容器①中N2的转化率为30% |
| B.平衡后,向容器②再充入N2,氨气的体积分数一定增大 |
| C.容器①达到平衡时,混合气体的密度是同温同压下H2密度的5倍 |
| D.Q = 64.82 |
您最近一年使用:0次
9 . 推进能源绿色转型,实现碳达峰、碳中和,事关经济社会发展全局。CO2甲烷化及甲烷重整制甲醇是能源综合利用领域的研究热点。回答下列问题:
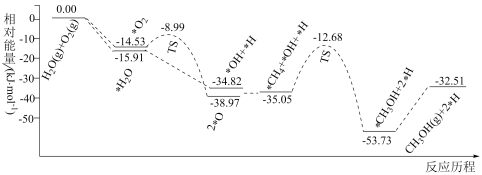
(1)已知CH4、O2和H2O(g)(H2O的作用是活化催化剂)按照一定体积比在催化剂表面可合成甲醇:CH4(g)+ O2(g)=CH3OH(g) △H,反应的部分历程如图所示(吸附在催化剂表面的物种用“*”标注,TS代表过渡态)。下列说法正确的是
O2(g)=CH3OH(g) △H,反应的部分历程如图所示(吸附在催化剂表面的物种用“*”标注,TS代表过渡态)。下列说法正确的是_____ (填标号)。
(2)催化剂的选择是CO2甲烷化的核心,金属Ni或Ni-CeO2均可作为催化剂。
①基态Ni原子的核外电子排布式为_____ 。
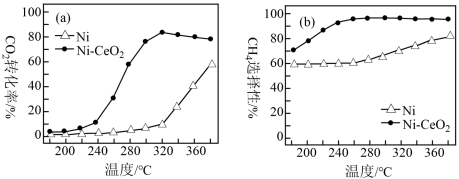
②在上述两种催化剂的条件下反应相同时间,测得CO2转化率和CH4选择性随温度的变化如图所示。高于320℃,以Ni-CeO2为催化剂,CO2转化率略有下降,而以Ni为催化剂,CO2转化率却仍在上升,其原因是____ 。对比上述两种催化剂的催化性能,工业上应选择的催化剂和温度分别是____ 。
(3)一定条件下,发生反应CO(g)+3H2(g) CH4(g)+H2O(g) △H=-198kJ•mol-1,测CO的平衡转化率与温度、起始投料比m[m=
CH4(g)+H2O(g) △H=-198kJ•mol-1,测CO的平衡转化率与温度、起始投料比m[m=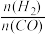 ]的关系如图所示。已知v正=k正•c(CO)•c3(H2),v逆=k逆•c(CH4)•c(H2O) (k正、k逆为速率常数,只与温度有关)。
]的关系如图所示。已知v正=k正•c(CO)•c3(H2),v逆=k逆•c(CH4)•c(H2O) (k正、k逆为速率常数,只与温度有关)。

①图中m1、m2、m3由大到小的顺序为_____ 。
②向一体积为2L的恒容密闭容器中充入1molCO和3molH2,在一定温度下,经5s达到平衡,此时CO的转化率为50%。0~5s内,v(H2)=____ mol•L-1•s-1。平衡时k正:k逆=____ ,达到平衡后,升高温度,k正:k逆_____ (填“增大”、“减小”或“不变”)。
(4)微生物电化学产甲烷法的装置如图所示。b电极的电极反应式为____ 。

(1)已知CH4、O2和H2O(g)(H2O的作用是活化催化剂)按照一定体积比在催化剂表面可合成甲醇:CH4(g)+
 O2(g)=CH3OH(g) △H,反应的部分历程如图所示(吸附在催化剂表面的物种用“*”标注,TS代表过渡态)。下列说法正确的是
O2(g)=CH3OH(g) △H,反应的部分历程如图所示(吸附在催化剂表面的物种用“*”标注,TS代表过渡态)。下列说法正确的是
| A.该反应的△H=-32.5kJ•mol-1 |
| B.H2O(g)比O2(g)更容易吸附在催化剂表面 |
| C.该反应过程中只涉及σ键的断裂与形成 |
| D.图中慢反应的化学方程式为*CH4+*OH=*CH3OH+*H |
①基态Ni原子的核外电子排布式为
②在上述两种催化剂的条件下反应相同时间,测得CO2转化率和CH4选择性随温度的变化如图所示。高于320℃,以Ni-CeO2为催化剂,CO2转化率略有下降,而以Ni为催化剂,CO2转化率却仍在上升,其原因是

(3)一定条件下,发生反应CO(g)+3H2(g)
 CH4(g)+H2O(g) △H=-198kJ•mol-1,测CO的平衡转化率与温度、起始投料比m[m=
CH4(g)+H2O(g) △H=-198kJ•mol-1,测CO的平衡转化率与温度、起始投料比m[m=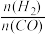 ]的关系如图所示。已知v正=k正•c(CO)•c3(H2),v逆=k逆•c(CH4)•c(H2O) (k正、k逆为速率常数,只与温度有关)。
]的关系如图所示。已知v正=k正•c(CO)•c3(H2),v逆=k逆•c(CH4)•c(H2O) (k正、k逆为速率常数,只与温度有关)。
①图中m1、m2、m3由大到小的顺序为
②向一体积为2L的恒容密闭容器中充入1molCO和3molH2,在一定温度下,经5s达到平衡,此时CO的转化率为50%。0~5s内,v(H2)=
(4)微生物电化学产甲烷法的装置如图所示。b电极的电极反应式为

您最近一年使用:0次
名校
10 . 在双碳目标驱动下,大批量氢燃料客车在2022年北京冬奥会上投入使用。氢源的获取和利用成为科学研究热点。回答下列问题:
Ⅰ.氢源的获取:电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。现以液氨为原料,使用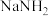 非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有
非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有 、
、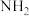 和
和 )
)
(1)产生 的电极反应式为
的电极反应式为______ 。
Ⅱ.氢源的利用: 还原
还原 制甲醇
制甲醇
(2)800℃时, 还原
还原 反应的热化学方程式及其平衡常数如下:
反应的热化学方程式及其平衡常数如下:
反应1:
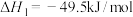

反应2: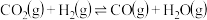

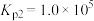
反应3: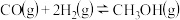
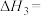
______ 
(3)800℃时,正反应进行的程度“反应2”______ “反应1”(选填“>”或“<”),判断依据是______ 。
(4)反应1在一定条件下建立平衡,关于反应1的相关描述正确的是______。
(5)某温度下,向2L恒容密闭容器中充入0.5mol 和0.9mol
和0.9mol 发生反应1和反应2,经过5min达到平衡状态,反应过程中
发生反应1和反应2,经过5min达到平衡状态,反应过程中 和
和 的物质的量随时间变化情况如下图所示:
的物质的量随时间变化情况如下图所示:
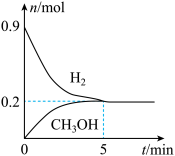
平衡时, 的转化率为
的转化率为______ ,该温度下,反应2的化学平衡常数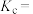
______ 。
(6) 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:______ 。
Ⅰ.氢源的获取:电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。现以液氨为原料,使用
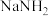 非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有
非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有 、
、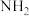 和
和 )
)(1)产生
 的电极反应式为
的电极反应式为Ⅱ.氢源的利用:
 还原
还原 制甲醇
制甲醇(2)800℃时,
 还原
还原 反应的热化学方程式及其平衡常数如下:
反应的热化学方程式及其平衡常数如下:反应1:

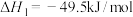

反应2:
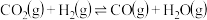

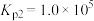
反应3:
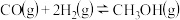
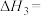

(3)800℃时,正反应进行的程度“反应2”
(4)反应1在一定条件下建立平衡,关于反应1的相关描述正确的是______。
| A.使用高效催化剂可降低反应的活化能,增大活化分子百分数,加快化学反应速率 |
| B.该反应的反应物总能量小于生成物总能量 |
| C.容器内气体的平均相对分子质量不再改变说明反应达到了平衡 |
D.增大压强,反应1的化学平衡常数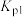 变小 变小 |
 和0.9mol
和0.9mol 发生反应1和反应2,经过5min达到平衡状态,反应过程中
发生反应1和反应2,经过5min达到平衡状态,反应过程中 和
和 的物质的量随时间变化情况如下图所示:
的物质的量随时间变化情况如下图所示:
平衡时,
 的转化率为
的转化率为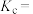
(6)
 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次



