名校
1 . 在容积为2 L的恒容密闭容器中充入P(g)和Q(g),发生反应P(g)+2Q(g)⇌3R(g)+4S(s) ΔH。所得数据如下表:
下列说法正确的是
| 组号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| n(P) | n(Q) | n(R) | n(S) | ||
| ① | 500 | 0.10 | 0.80 | 0.24 | 0.32 |
| ② | 500 | 0.20 | 1.60 | x | 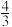 x x |
| ③ | 700 | 0.10 | 0.30 | 0.18 | 0.24 |
| A.该反应的ΔH>0 | B.反应达到平衡后增大压强,平衡逆向移动 |
| C.②中反应的平衡常数K=6.0 | D.根据题目信息不能确定x的值 |
您最近一年使用:0次
2022-09-24更新
|
533次组卷
|
3卷引用:山东省威海乳山市银滩高级中学2022-2023学年高二9月月考化学试题
名校
2 . 在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ。则下列分析正确的是
 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ。则下列分析正确的是| A.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ |
| B.2min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量变小 |
| C.若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4mol |
| D.若反应开始时容器体积为2L,则v(SO3)=0.7mol·L-1·min-1 |
您最近一年使用:0次
2022-08-24更新
|
1023次组卷
|
3卷引用:浙江省舟山市舟山中学2021-2022学年高一下学期阶段性检测化学试题
名校
解题方法
3 . 以CO和CO2为原料合成乙烯、二甲醚(CH3OCH3)等有机物,一直是当前化学领域研究的热点。回答下列问题:
(1)已知相关物质能量变化示意图如下:
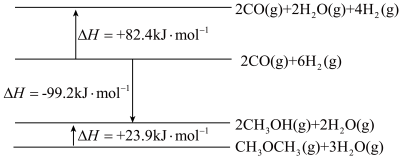
①写出由CO(g)和H2(g)反应生成CH3OCH3(g)和H2O(g)的热化学方程式:_______ 。
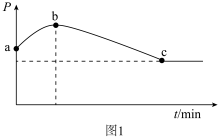
②在一绝热的恒容密闭容器中,通入CO和H2(物质的量之比1 :2)发生反应2CO(g)+4H2(g) C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是_______ 。
③CO2与H2催化重整制备CH3OCH3的过程中存在反应:
Ⅰ.2CO2(g) + 6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
Ⅱ.CO2(g) +H2(g) CO(g) + H2O(g)。
CO(g) + H2O(g)。
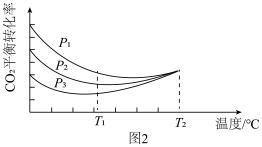
向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图2所示。p1、p2、p3由大小的顺序为_______ ;T2℃时主要发生反应_______ (填“Ⅰ”或“Ⅱ”),平衡转化率随温度变化先降后升的原因为_______ 。
(2)一定温度和压强为3. 3p MPa条件下,将CO和H2按物质的量之比为2: 3通入密闭弹性容器中发生催化反应,假设只发生反应:3CO(g) + 3H2 (g) CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)
CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)  C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=
C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=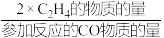 )。该温度下。反应C2H4(g)+ 2H2O(g)
)。该温度下。反应C2H4(g)+ 2H2O(g)  2CO(g) +4H2(g)的Kp=
2CO(g) +4H2(g)的Kp=_______ MPa3(用含字母p的代数式表示,已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替),若要提高C2H4的选择性,则应考虑的因素是_______ 。
(1)已知相关物质能量变化示意图如下:

①写出由CO(g)和H2(g)反应生成CH3OCH3(g)和H2O(g)的热化学方程式:
②在一绝热的恒容密闭容器中,通入CO和H2(物质的量之比1 :2)发生反应2CO(g)+4H2(g)
 C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
③CO2与H2催化重整制备CH3OCH3的过程中存在反应:
Ⅰ.2CO2(g) + 6H2(g)
 CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);Ⅱ.CO2(g) +H2(g)
 CO(g) + H2O(g)。
CO(g) + H2O(g)。向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图2所示。p1、p2、p3由大小的顺序为

(2)一定温度和压强为3. 3p MPa条件下,将CO和H2按物质的量之比为2: 3通入密闭弹性容器中发生催化反应,假设只发生反应:3CO(g) + 3H2 (g)
 CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)
CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)  C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=
C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=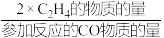 )。该温度下。反应C2H4(g)+ 2H2O(g)
)。该温度下。反应C2H4(g)+ 2H2O(g)  2CO(g) +4H2(g)的Kp=
2CO(g) +4H2(g)的Kp=
您最近一年使用:0次
2022-07-29更新
|
291次组卷
|
3卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期12月月考化学试题
名校
解题方法
4 . 工业上利用硫(S8)与 为原料制备
为原料制备 。450℃以上,发生反应Ⅰ:
。450℃以上,发生反应Ⅰ: ;通常在600℃以上发生反应Ⅱ:
;通常在600℃以上发生反应Ⅱ: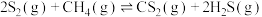 。一定条件下,
。一定条件下, 分解产生
分解产生 的体积分数、
的体积分数、 与
与 反应中
反应中 的平衡转化率与温度的关系如图所示。下列说法一定正确的是
的平衡转化率与温度的关系如图所示。下列说法一定正确的是

 为原料制备
为原料制备 。450℃以上,发生反应Ⅰ:
。450℃以上,发生反应Ⅰ: ;通常在600℃以上发生反应Ⅱ:
;通常在600℃以上发生反应Ⅱ: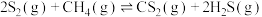 。一定条件下,
。一定条件下, 分解产生
分解产生 的体积分数、
的体积分数、 与
与 反应中
反应中 的平衡转化率与温度的关系如图所示。下列说法一定正确的是
的平衡转化率与温度的关系如图所示。下列说法一定正确的是
| A.反应Ⅱ的正反应为吸热反应 |
B.在恒温密闭容器中,反应相同时间,温度越低, 的转化率越大 的转化率越大 |
C.发生反应Ⅱ温度不低于600℃的原因是:此温度 平衡转化率已很高;低于此温度, 平衡转化率已很高;低于此温度, 浓度小,反应速率慢 浓度小,反应速率慢 |
D.某温度下若 完全分解成 完全分解成 ,在密闭容器中, ,在密闭容器中, 开始反应,当 开始反应,当 体积分数为10%时, 体积分数为10%时, 转化率为43% 转化率为43% |
您最近一年使用:0次
2022-07-03更新
|
638次组卷
|
4卷引用:湖南省长沙市第一中学2021-2022学年高三下学期月考(八)化学试题
名校
5 . 氯乙烯是制备塑料的重要中间体,可通过乙炔选择性催化制备。已知:
I.C2H2(g)+HCl(g) C2H3Cl(g) △H1=-124.8kJ·mol-1
C2H3Cl(g) △H1=-124.8kJ·mol-1
II.C2H2(g)+2HCl(g) C2H4Cl2(g) △H2=-179.3kJ·mol-1
C2H4Cl2(g) △H2=-179.3kJ·mol-1
(1)HCl(g)+C2H3Cl(g) C2H4Cl2(g)正反应活化能为25.8kJ/mol,则其逆反应的活化能为
C2H4Cl2(g)正反应活化能为25.8kJ/mol,则其逆反应的活化能为____ 。
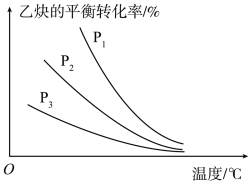
(2)在体积可变的密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。P1、P2、P3由大到小的顺序为____ 。
(3)一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),假设只发生反应I和II。实验测得反应前容器内压强为P0Pa,5min达到平衡时C2H4Cl2(g)、HCl(g)的分压分别为P1Pa、P2Pa。
①0~5min内,反应I和反应II中HCl的总的消耗速率v(HCl)=____ Pa·min-1
②反应II的平衡常数Kp=____ (用含P1、P2的代数式表示)
(4)电化学腐蚀法可有效将废水中的三氯乙烯转化为乙烯。利用活性纳米Fe电化学腐蚀处理酸性三氯乙烯(C2HCl3)废水的过程如图。定义单位时间内纳米Fe释放的总电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。
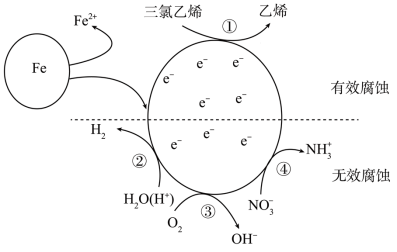
①上述电化学腐蚀过程①的电极反应为____ 。
②在处理过程中,当消耗amol纳米Fe时,产生bL的乙烯气体(标准状况),则该电化学腐蚀过程的电流效率η=____ (用含a、b的代数式表示)。[已知:η=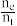 ×100%]
×100%]
I.C2H2(g)+HCl(g)
 C2H3Cl(g) △H1=-124.8kJ·mol-1
C2H3Cl(g) △H1=-124.8kJ·mol-1II.C2H2(g)+2HCl(g)
 C2H4Cl2(g) △H2=-179.3kJ·mol-1
C2H4Cl2(g) △H2=-179.3kJ·mol-1(1)HCl(g)+C2H3Cl(g)
 C2H4Cl2(g)正反应活化能为25.8kJ/mol,则其逆反应的活化能为
C2H4Cl2(g)正反应活化能为25.8kJ/mol,则其逆反应的活化能为(2)在体积可变的密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。P1、P2、P3由大到小的顺序为

(3)一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),假设只发生反应I和II。实验测得反应前容器内压强为P0Pa,5min达到平衡时C2H4Cl2(g)、HCl(g)的分压分别为P1Pa、P2Pa。
①0~5min内,反应I和反应II中HCl的总的消耗速率v(HCl)=
②反应II的平衡常数Kp=
(4)电化学腐蚀法可有效将废水中的三氯乙烯转化为乙烯。利用活性纳米Fe电化学腐蚀处理酸性三氯乙烯(C2HCl3)废水的过程如图。定义单位时间内纳米Fe释放的总电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。

①上述电化学腐蚀过程①的电极反应为
②在处理过程中,当消耗amol纳米Fe时,产生bL的乙烯气体(标准状况),则该电化学腐蚀过程的电流效率η=
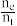 ×100%]
×100%]
您最近一年使用:0次
名校
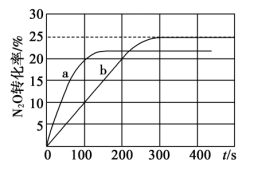
6 . 用CO还原 可减轻汽车尾气对空气的污染,该反应的热化学方程式为:
可减轻汽车尾气对空气的污染,该反应的热化学方程式为: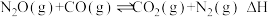 。在体积为1L的密闭容器A(500℃,恒温)、B(起始500℃,绝热)中分别加入0.1mol
。在体积为1L的密闭容器A(500℃,恒温)、B(起始500℃,绝热)中分别加入0.1mol 和0.4molCO,测得容器中
和0.4molCO,测得容器中 转化率随时间变化关系如图。下列说法正确的是
转化率随时间变化关系如图。下列说法正确的是
 可减轻汽车尾气对空气的污染,该反应的热化学方程式为:
可减轻汽车尾气对空气的污染,该反应的热化学方程式为: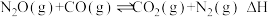 。在体积为1L的密闭容器A(500℃,恒温)、B(起始500℃,绝热)中分别加入0.1mol
。在体积为1L的密闭容器A(500℃,恒温)、B(起始500℃,绝热)中分别加入0.1mol 和0.4molCO,测得容器中
和0.4molCO,测得容器中 转化率随时间变化关系如图。下列说法正确的是
转化率随时间变化关系如图。下列说法正确的是
A.A容器中 的转化率随时间的变化关系是图中的曲线a 的转化率随时间的变化关系是图中的曲线a |
B.可通过缩小容器体积来缩短b曲线对应容器达到平衡的时间,同时不改变 的平衡转化率 的平衡转化率 |
C.500℃该反应的化学平衡常数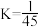 |
D.在平衡后向A容器中加入0.075mol 与0.025mol 与0.025mol ,则平衡正向移动 ,则平衡正向移动 |
您最近一年使用:0次
2022-06-07更新
|
970次组卷
|
3卷引用:湖南省常德市临澧县第一中学2022-2023学年高二上学期第三次月考化学试题
湖南省常德市临澧县第一中学2022-2023学年高二上学期第三次月考化学试题山东省德州市2022届高考三模化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(讲)-2023年高考化学一轮复习讲练测(全国通用)
7 . 甲烷、二氧化碳重整制合成气CO和H2,是一种有效实现碳达峰、碳中和的关键技术,也是近几年研究的热点之一。回答下列问题:
(1)已知:甲烷、二氧化碳重整工艺的相关反应如下:
①H2(g)+CO2(g)⇌H2O(g)+CO(g) ∆H1=+41kJ·mol−1
②2CO(g)⇌CO2(g)+C(s) ∆H2=−172kJ·mol−1
③CH4(g)⇌C(s)+2H2(g) ∆H3=+75kJ·mol−1
④CO(g)+H2(g)⇌C(s)+H2O(g) ∆H4=−131kJ·mol−1
则甲烷、二氧化碳重整制合成气的热化学方程式为CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H=_______ ;为了提高平衡时合成气的产率,反应条件应选择_______ (填标号)。
A.高压 B.低压 C.低温 D.高温
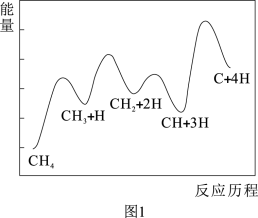
(2)一定条件下,CH4分解生成碳的反应历程如图1所示。该历程分4步进行,其中第_______ 步为放热反应,正反应活化能最大一步的反应方程式为_______ 。
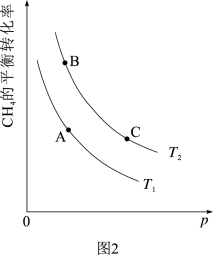
(3)CH4(g)+CO2(g)⇌2CO(g)+2H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2所示(不考虑副反应),则T1_______ T2(填“>”或“<”),A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为_______ 。
(4)在恒压p=100kPa、初始投料n(CO2)/n(CH4)=1的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图3所示。
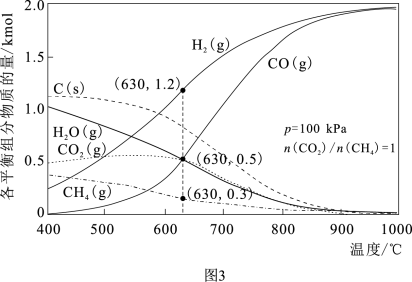
①随温度升高,产率增加,n(H2)/n(CO)减小,积碳含量_______ (填“增大”或“减小”)。
②在630℃时,反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的平衡常数Kp=_______ kPa2(Kp是以分压表示的平衡常数,已知分压=总压×物质的量分数)。
(1)已知:甲烷、二氧化碳重整工艺的相关反应如下:
①H2(g)+CO2(g)⇌H2O(g)+CO(g) ∆H1=+41kJ·mol−1
②2CO(g)⇌CO2(g)+C(s) ∆H2=−172kJ·mol−1
③CH4(g)⇌C(s)+2H2(g) ∆H3=+75kJ·mol−1
④CO(g)+H2(g)⇌C(s)+H2O(g) ∆H4=−131kJ·mol−1
则甲烷、二氧化碳重整制合成气的热化学方程式为CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H=
A.高压 B.低压 C.低温 D.高温
(2)一定条件下,CH4分解生成碳的反应历程如图1所示。该历程分4步进行,其中第

(3)CH4(g)+CO2(g)⇌2CO(g)+2H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2所示(不考虑副反应),则T1

(4)在恒压p=100kPa、初始投料n(CO2)/n(CH4)=1的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图3所示。

①随温度升高,产率增加,n(H2)/n(CO)减小,积碳含量
②在630℃时,反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的平衡常数Kp=
您最近一年使用:0次
名校
8 . 在某容积可变的密闭容器中加入等量的A、B混合气体共4mol,发生反应:mA+nB pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
下列说法一定正确的是
 pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:| 压强p/Pa | 2×105 | 5×105 | 1×106 | 3×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.40 | 0.80 |
| A.保持一定温度,增大压强,平衡正向移动 |
B.当压强为3×106Pa时,此反应的平衡常数表达式:Kp=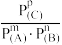 |
| C.反应平衡后若增大压强,则新平衡的逆反应速率大于原平衡的逆反应速率 |
| D.若再向体系中加入bmolB,当重新达到平衡时,体系中A、B、C总物质的量为(4+b)mol |
您最近一年使用:0次
2022-05-11更新
|
530次组卷
|
4卷引用:福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题
名校
解题方法
9 . 一种捕获并资源化利用 的方法是将
的方法是将 催化加氢合成
催化加氢合成 ,其过程中主要发生如下反应:
,其过程中主要发生如下反应:
I.
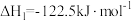
II.
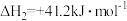
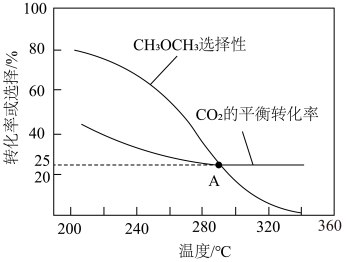
向恒压密闭容器中充入amol 和3amol
和3amol ,
, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性[
的选择性[ 的选择性=
的选择性=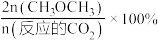 ]随温度的变化如下图所示。下列说法正确的是
]随温度的变化如下图所示。下列说法正确的是
 的方法是将
的方法是将 催化加氢合成
催化加氢合成 ,其过程中主要发生如下反应:
,其过程中主要发生如下反应:I.

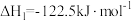
II.

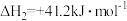
向恒压密闭容器中充入amol
 和3amol
和3amol ,
, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性[
的选择性[ 的选择性=
的选择性=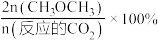 ]随温度的变化如下图所示。下列说法正确的是
]随温度的变化如下图所示。下列说法正确的是
| A.由图可知,210℃时以反应II为主 |
B.其它条件不变时,增大反应体系压强, 选择性增大 选择性增大 |
| C.其它条件不变时,改变催化剂,A点对应的坐标也会发生改变 |
D.反应状态达A点时,容器中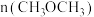 占反应体系中气体总物质的量的 占反应体系中气体总物质的量的 |
您最近一年使用:0次
2022-05-08更新
|
288次组卷
|
2卷引用:重庆市南开中学2022届高三第九次质量检测化学试题
2022·河北·模拟预测
名校
10 . 在固定容积的密闭容器中,按 与
与 的物质的量之比为1∶3进行投料,发生反应
的物质的量之比为1∶3进行投料,发生反应 ,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表
,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表 。下列说法正确的是
。下列说法正确的是
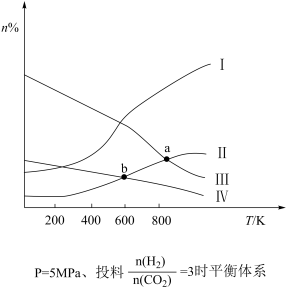
 与
与 的物质的量之比为1∶3进行投料,发生反应
的物质的量之比为1∶3进行投料,发生反应 ,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表
,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表 。下列说法正确的是
。下列说法正确的是
A.图中曲线交点a、b对应的平衡常数 |
B.图中曲线交点b对应的 转化率为40% 转化率为40% |
| C.平衡时,向体系中加入氢气,氢气转化率变大 |
D.若其他条件相同,甲为恒温恒容,乙为绝热恒容,达到平衡时 产率:甲>乙 产率:甲>乙 |
您最近一年使用:0次
2022-03-24更新
|
589次组卷
|
6卷引用:江西省南昌市第二中学2022-2023学年高三上学期第四次考试化学试题
江西省南昌市第二中学2022-2023学年高三上学期第四次考试化学试题湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题(已下线)2022年河北省新高考测评卷(七)(已下线)2022年湖南卷高考真题变式题(11-14)天津市第二十五中学2022 -2023学年高二上学期期中考试化学试题广东省广州市第二中学2022-2023学年高三 上学期(11月25日)周测化学试题



