解题方法
1 . 根据实验操作及现象,下列解释或结论正确的是
| 选项 | 实验操作及现象 | 解释或结论 |
| A | 向盛有KI溶液的试管中滴加少量新制氯水,振荡,再加入四氯化碳,振荡后静置,液体分层,下层呈紫红色 | 非金属性:Cl>I |
| B | 常温下,测得0.1mol·L-1NaHC2O4溶液的pH<7 |  的电离程度小于其水解程度 的电离程度小于其水解程度 |
| C | 推动装有NO2的密闭注射器的活塞,气体颜色先变深后变浅 |  平衡先逆向移动,后正向移动 平衡先逆向移动,后正向移动 |
| D | 将铁片分别插入冷的浓硫酸和热的浓硫酸中,前者无明显现象,后者产生刺激性气味气体 | 铁与浓硫酸只有在加热条件下才反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 在密闭容器中,使2molN2和6molH2混合发生下列反应:  。
。
(1)当反应达到平衡时,N2和H2的浓度比是_____ ;N2和H2的转化率比是_____ 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_____ ;密度_____ 。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增加一倍,平衡将_____ 。(填“正移”“逆移”或“不移动”,下同)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将_____ 。
 。
。(1)当反应达到平衡时,N2和H2的浓度比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增加一倍,平衡将
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将
您最近一年使用:0次
3 . 高温下,某反应达到平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.该反应的焓变为正值 |
| C.恒温恒容下,增大压强,H2浓度一定减小 |
D.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
您最近一年使用:0次
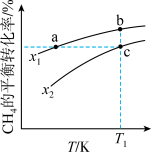
4 . 向一恒容密闭容器中充入
 和一定量的
和一定量的 ,发生反应
,发生反应 ,
, 的平衡转化率与投料比x
的平衡转化率与投料比x 及温度的关系如图所示。下列说法错误的是
及温度的关系如图所示。下列说法错误的是

 和一定量的
和一定量的 ,发生反应
,发生反应 ,
, 的平衡转化率与投料比x
的平衡转化率与投料比x 及温度的关系如图所示。下列说法错误的是
及温度的关系如图所示。下列说法错误的是
A.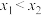 |
B.密度: |
C.a、b、c点对应的平衡常数: |
D.若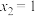 ,c点压强为p,则 ,c点压强为p,则 时, 时,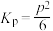 |
您最近一年使用:0次
名校
5 . 下列事实不能用勒夏特列原理解释的是
A.用饱和食盐水来除 中的 中的 | B.红棕色的 加压后颜色变深 加压后颜色变深 |
| C.开启啤酒瓶后,瓶中马上泛起大量泡沫 | D.增大压强,有利于 与 与 反应生成 反应生成 |
您最近一年使用:0次
2024-02-13更新
|
118次组卷
|
2卷引用:陕西省咸阳市实验中学2022-2023学年高三上学期第二次月考化学试题
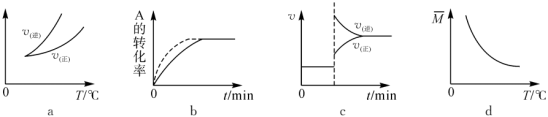
6 . 在密闭容器中进行反应: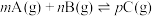 ,有关下列图像说法错误的是
,有关下列图像说法错误的是
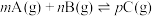 ,有关下列图像说法错误的是
,有关下列图像说法错误的是
| A.依据图a可判断正反应为放热反应 |
| B.在图b中,虚线的反应条件可能是使用了催化剂 |
C.若 ,则图c表示减小压强,平衡逆向移动 ,则图c表示减小压强,平衡逆向移动 |
D.若 ,由图d中可知 ,由图d中可知 |
您最近一年使用:0次
2024-02-07更新
|
132次组卷
|
2卷引用:陕西省榆林市府谷县第一中学2023-2024学年高二上学期12月月考化学试题
名校
7 . 甲、乙两容器都发生反应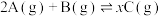 ,两容器温度和初始压强都相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为φ、物质的量为
,两容器温度和初始压强都相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为φ、物质的量为 ;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为φ、物质的量为
;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为φ、物质的量为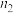 。下列说法中正确的是
。下列说法中正确的是
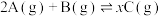 ,两容器温度和初始压强都相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为φ、物质的量为
,两容器温度和初始压强都相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为φ、物质的量为 ;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为φ、物质的量为
;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为φ、物质的量为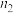 。下列说法中正确的是
。下列说法中正确的是| A.若甲、乙两容器均为恒容容器,则x一定等于2 |
| B.若甲、乙两容器均为恒压容器,则x一定等于3 |
C.若甲为恒容容器、乙为恒压容器,且 ,则 ,则 一定大于 一定大于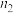 |
D.若甲为恒压容器、乙为恒容容器,且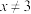 ,则 ,则 一定小于 一定小于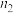 |
您最近一年使用:0次
名校
解题方法
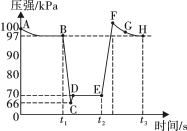
8 . 利用传感技术可探究压强对反应 化学平衡移动的影响。在常温、100kPa条件下,往注射器中充入适量
化学平衡移动的影响。在常温、100kPa条件下,往注射器中充入适量 气体,当活塞位置不变时,分别在
气体,当活塞位置不变时,分别在 、
、 时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图所示。下列说法错误的是
时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图所示。下列说法错误的是
 化学平衡移动的影响。在常温、100kPa条件下,往注射器中充入适量
化学平衡移动的影响。在常温、100kPa条件下,往注射器中充入适量 气体,当活塞位置不变时,分别在
气体,当活塞位置不变时,分别在 、
、 时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图所示。下列说法错误的是
时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图所示。下列说法错误的是
| A.由B点到D点观察到注射器内气体颜色先变浅后逐渐变深 |
| B.E点的操作是压缩注射器 |
| C.B、H两点对应的正反应速率相等 |
| D.由E点到F点注射器内气体颜色加深是平衡移动所致 |
您最近一年使用:0次
名校
9 . 光气(COCl2)有剧毒,微溶于水,是有机物、药物、染料及其他化工制品的重要中间体。一定温度下,在某恒容密闭容器中发生反应2CHCl3(g)+O2(g) 2HCl(g)+2COCl2(g),下列说法正确的是
2HCl(g)+2COCl2(g),下列说法正确的是
 2HCl(g)+2COCl2(g),下列说法正确的是
2HCl(g)+2COCl2(g),下列说法正确的是A.该反应的平衡常数表达式为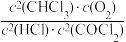 |
| B.适当减小压强,有利于提高O2的平衡转化率 |
| C.每消耗0.2molCHCl3(g),同时生成2.24LCOCl2(g) |
| D.当混合气体的密度不再随时间而改变时,该反应达到平衡 |
您最近一年使用:0次
2024-01-14更新
|
104次组卷
|
3卷引用:陕西省西安市黄河中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
10 . “碳达峰”“碳中和”是推动我国经济社会高质量发展的内在要求。通过二氧化碳催化加氢合成二甲醚是一种重要的转化方法,其过程如下:
反应Ⅰ:
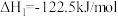
反应Ⅱ:
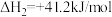
回答下列问题:
(1)二氧化碳与氢气合成CH3OCH3时,通常控制温度为 500℃左右,其可能的原因为_____(填字母)。
(2)在 1L 恒温密闭容器中充入4molCO2和6molH2 ,初始压强为 p,20min 时反应 Ⅰ、Ⅱ都达到平衡状态,体系压强为 0.8p,测得 c(H2O)=3mol/L。
①0~20min 内v(CO)=________ 。
②反应Ⅱ的化学平衡常数Kp=________ 。
③平衡时 CH3OCH3的选择性=________ 。( )
)
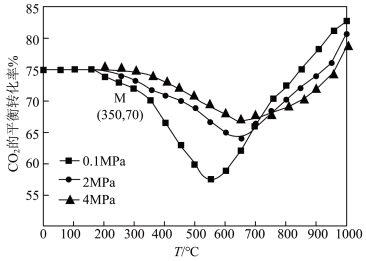
(3)在密闭容器中通入1 nolCO2和3molH2,在铁系催化剂作用下进行反应, 的平衡转化率随温度和压强的变化如图所示。图中,温度大于 800℃时,随着压强的增大, CO2的平衡转化率减小,请解释原因:___________ 。
反应Ⅰ:

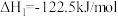
反应Ⅱ:

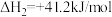
回答下列问题:
(1)二氧化碳与氢气合成CH3OCH3时,通常控制温度为 500℃左右,其可能的原因为_____(填字母)。
| A.反应速率快 | B.平衡的转化率高 |
| C.催化剂活性高 | D.主反应催化剂选择性好 |
(2)在 1L 恒温密闭容器中充入4molCO2和6molH2 ,初始压强为 p,20min 时反应 Ⅰ、Ⅱ都达到平衡状态,体系压强为 0.8p,测得 c(H2O)=3mol/L。
①0~20min 内v(CO)=
②反应Ⅱ的化学平衡常数Kp=
③平衡时 CH3OCH3的选择性=
 )
)(3)在密闭容器中通入1 nolCO2和3molH2,在铁系催化剂作用下进行反应, 的平衡转化率随温度和压强的变化如图所示。图中,温度大于 800℃时,随着压强的增大, CO2的平衡转化率减小,请解释原因:

您最近一年使用:0次



