名校
1 . 工业上利用CO和H2合成二甲醚:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ΔH。其它条件不变时,相同时间内CO的转化率随温度T的变化情况如图所示。下列说法不正确 的是
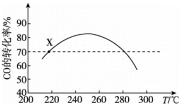

| A.ΔH<0 |
| B.状态X时,v消耗(CO)=v生成(CO) |
| C.相同温度时,增大压强,可以提高CO的转化率 |
| D.状态X时,选择合适催化剂,可以提高相同时间内CO的转化率 |
您最近一年使用:0次
2021-01-24更新
|
1071次组卷
|
11卷引用:北京市朝阳区2021届高三上学期期末考试化学试题
北京市朝阳区2021届高三上学期期末考试化学试题广东省华附、省实、广雅、深中四校2020-2021学年高二下学期期末联考化学试题(已下线)第1周 周测卷-备战2022年高考化学周测与晚练(新高考专用)北京一零一中学2021-2022学年高二上学期期中考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题天津市南开区2021-2022学年高二上学期期末考试化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题天津市第二十五中学2022-2023 学年高二上学期期末阶段测试化学试题河南省信阳高级中学2022-2023学年高二上学期期末考试化学试题北京市八一学校2022-2023学年高二上学期期中考试化学试题广东省清远市阳山县南阳中学2023-2024学年高二上学期第二次月考(期中)化学试题
2 . 在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ/mol。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。下列说法错误的是
2SO3(g) △H=-196.6kJ/mol。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。下列说法错误的是
 2SO3(g) △H=-196.6kJ/mol。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。下列说法错误的是
2SO3(g) △H=-196.6kJ/mol。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。下列说法错误的是温度/℃ | 平衡时SO2的转化率/% | ||||
0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
500 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
| A.从理论上分析,为了使二氧化硫尽可能多转化为三氧化硫,应选择的条件是450℃,10MPa |
| B.在实际生产中,选定的温度为400~500℃原因是考虑催化剂的活性最佳 |
| C.在实际生产中,为了增大SO2的转化率可以无限量通入空气 |
| D.在实际生产中,采用的压强为常压原因是常压时转化率已经很高,增大压强对设备及成本要求太高 |
您最近一年使用:0次
2021-01-15更新
|
296次组卷
|
3卷引用:辽宁省丹东市2020-2021学年高二上学期期末考试化学试题
辽宁省丹东市2020-2021学年高二上学期期末考试化学试题山西省汾阳市汾阳中学2020-2021学年高二下学期开学考试化学试题(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
3 . 工业上可通过甲醇羰基化法制取甲酸甲酯( ):
):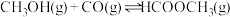 ,在容积固定的密闭容器中,投入等物质的量
,在容积固定的密闭容器中,投入等物质的量 和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法
和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法不正确 的是

 ):
):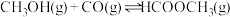 ,在容积固定的密闭容器中,投入等物质的量
,在容积固定的密闭容器中,投入等物质的量 和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法
和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法
| A.增大压强甲醇转化率增大 |
B.b点反应速率 |
C.平衡常数 ,反应速率 ,反应速率 |
| D.生产时反应温度控制在80~85℃为宜 |
您最近一年使用:0次
2022-05-10更新
|
900次组卷
|
29卷引用:北京市大兴区2020-2021学年高二上学期期末考试化学试题
北京市大兴区2020-2021学年高二上学期期末考试化学试题北京市八十中2020-2021学年高二下学期开学考试化学试题辽宁省营口市第二高级中学2021-2022学年高二上学期第一次月考化学试题北京市回民学校2021-2022学年高二上学期期中考试化学试题(已下线)综合复习与测试(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题北京市师范大学亚太实验学校2021-2022学年高二上学期期中考试化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市第四中学顺义分校2021-2022学年高二上学期期中考试化学试题陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题北京市第四十三中学2021-2022学年高二上学期12月月考化学试题北京市西城区2019-2020学年度高二上学期期末考试化学试题北京市中央民族大学附属中学2019-2020学年高二下学期期末考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡北京市第四十三中学2020-2021学年高二上学期12月月考化学试题江苏省海安高级中学2020-2021学年度高二上学期第二次合格性考试化学(选修)试题福建省莆田第一中学2021-2022学年高二下学期期中考试化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期练习卷化学试题(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)河北省石家庄新乐市第一中学2022-2023学年高二上学期第一次月考化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京师范大学附属中学2022-2023学年上学期高二化学期末试题云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题北京市育才学校2023-2024学年高二上学期10月月考化学试题北京市西城区2022-2023学年育才学校高二上学期化学期中考试北京市第二十二中学2023-2024学年高二上学期期中考试化学试题北京市2023-2024学年第二十二中学高二上学期化学期中试题北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷北京市第十一中学2022-2023学年高二上学期期中考试化学试卷
名校
4 . 我国科学家在全球首次实现二氧化碳到淀粉的合成,其第一阶段是将二氧化碳催化加氢制得甲醇,反应方程式如下:
Ⅰ:
Ⅱ: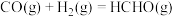
Ⅲ:
向容积为 的密闭装置中充入
的密闭装置中充入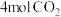 和
和 ,在t℃下反应,
,在t℃下反应, 后达平衡状态.测得容器内
后达平衡状态.测得容器内 ,
,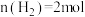 ,
,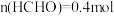 ,下列说法错误的是
,下列说法错误的是
Ⅰ:

Ⅱ:
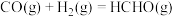
Ⅲ:

向容积为
 的密闭装置中充入
的密闭装置中充入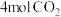 和
和 ,在t℃下反应,
,在t℃下反应, 后达平衡状态.测得容器内
后达平衡状态.测得容器内 ,
,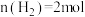 ,
,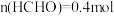 ,下列说法错误的是
,下列说法错误的是| A.可以通过监测容器内的总压来判断反应Ⅰ是否达到平衡 |
B.达平衡时,用 表示的反应Ⅰ的平均反应速率为 表示的反应Ⅰ的平均反应速率为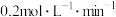 |
C.t℃下,反应Ⅱ的平衡常数为 |
D.向容器内再投入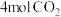 和 和 ,再次平衡后, ,再次平衡后,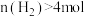 |
您最近一年使用:0次
2022-04-03更新
|
514次组卷
|
3卷引用:重庆市第一中学2021-2022学年高三上学期第三次月考化学试题
5 . N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g) △H>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见表:
4NO2(g)+O2(g) △H>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见表:
下列说法中错误的是
 4NO2(g)+O2(g) △H>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见表:
4NO2(g)+O2(g) △H>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见表:| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
| A.500s时O2的浓度为0.075mol/L |
| B.平衡后,升高温度,逆反应速率增大 |
| C.平衡后,要使平衡常数减小,改变的条件是降低温度 |
| D.1000s时将容器的体积缩小一半,重新达到平衡时0.25mol/L<c(N2O5)<0.50mol/L |
您最近一年使用:0次
名校
6 . 在 3 个初始温度均为 T ℃的容器中发生反应:2SO2(g) + O2(g) ⇌ 2SO3(g) ΔH < 0。下列说法不正确的是( )
| 容器编号 | 容器类型 | 初始体积 | 反应物起始物质的量(mol) | 平衡时 n(SO3)/ mol | ||
| SO2 | O2 | SO3 | ||||
| I | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 |
| II | 绝热恒容 | 1.0 L | 2 | 1 | 0 | a |
| III | 恒温恒压 | 0.5 L | 1 | 0.5 | 0 | b |
| A.a < 1.6 |
| B.b < 0.8 |
| C.平衡时,以 SO2 表示的正反应速率:v(I) < v(II) |
| D.若起始时向容器 I 中充入 0.4 mol SO2(g)、0.3 mol O2(g)和 1.6 mol SO3(g),反应正向进行 |
您最近一年使用:0次
2020-10-28更新
|
847次组卷
|
4卷引用:四川省绵阳东辰国际学校2021-2022学年高二上学期第二次月考化学试题
名校
7 . 甲醇脱氢可制取甲醛,反应原理为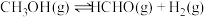 ,甲醇的平衡转化率随温度的变化曲线如图所示(已知反应在1L的密闭容器中进行,甲醇的初始物质的量为1mol)。下列有关说法正确的是
,甲醇的平衡转化率随温度的变化曲线如图所示(已知反应在1L的密闭容器中进行,甲醇的初始物质的量为1mol)。下列有关说法正确的是

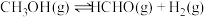 ,甲醇的平衡转化率随温度的变化曲线如图所示(已知反应在1L的密闭容器中进行,甲醇的初始物质的量为1mol)。下列有关说法正确的是
,甲醇的平衡转化率随温度的变化曲线如图所示(已知反应在1L的密闭容器中进行,甲醇的初始物质的量为1mol)。下列有关说法正确的是
A.脱氢反应的 |
B.600K时,Y点: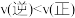 |
| C.要实现从Y点到Z点的变化可通过增大压强的方法 |
D.在 时,该反应的平衡常数为8.1 时,该反应的平衡常数为8.1 |
您最近一年使用:0次
2022-02-27更新
|
82次组卷
|
2卷引用:辽宁省渤海大学附属高级中学2021-2022学年高二上学期第二次月考化学试题
8 . 在一定条件下,碳与水蒸气可发生的化学反应为:C(s)+H2O(g)  CO(g)+H2(g) ΔH>0。下列有关说法正确的是
CO(g)+H2(g) ΔH>0。下列有关说法正确的是
 CO(g)+H2(g) ΔH>0。下列有关说法正确的是
CO(g)+H2(g) ΔH>0。下列有关说法正确的是| A.当反应达平衡时,恒温恒压条件下通入Ar,H2O的转化率不变 |
| B.在一定条件下达平衡时,使用催化剂能加快反应速率,增加生成物的产量 |
| C.当反应达平衡时,其他条件不变,降低温度可使该反应的平衡常数减小 |
| D.其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
您最近一年使用:0次
9 . 在不同体积的密闭容器中均投入0.5molCO和1molH2,在不同条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图所示。下列说法错误的是
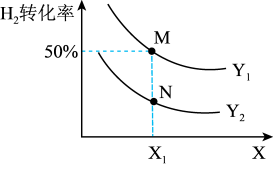

| A.X代表温度,且正反应放热 |
| B.Y代表压强,且Y1>Y2 |
| C.N点H2的转化率小于CO |
| D.若M点对应的容器体积为5L,则N点的平衡常数K=100 |
您最近一年使用:0次
名校
10 . 自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g) SiF4(g)+2H2O(g) △H=-148.9 kJ·mol-1。下列说法错误的是
SiF4(g)+2H2O(g) △H=-148.9 kJ·mol-1。下列说法错误的是
 SiF4(g)+2H2O(g) △H=-148.9 kJ·mol-1。下列说法错误的是
SiF4(g)+2H2O(g) △H=-148.9 kJ·mol-1。下列说法错误的是| A.在地壳浅处容易有SiO2固体沉积 |
| B.如果上述反应的平衡常数K值变大,该反应在平衡移动时逆反应速率先减小后增大 |
| C.如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,v(H2O)=2v(SiF4) |
| D.若该反应的容器容积为2.0 L,反应时间8.0 min,容器内气体的质量增加了0.24 g,在这段时间内HF的平均反应速率为0.0020 mol·L-1·min-1 |
您最近一年使用:0次
2020-09-28更新
|
256次组卷
|
3卷引用:湖南省2021届新高考化学考前押题《最后一卷》化学试题



