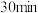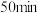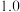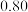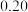名校
解题方法
1 . NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应: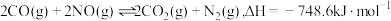 ,
, ,反应速率较小,有关该反应的说法正确的是
,反应速率较小,有关该反应的说法正确的是
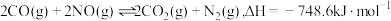 ,
, ,反应速率较小,有关该反应的说法正确的是
,反应速率较小,有关该反应的说法正确的是| A.K很大,说明NO与CO在排入大气之前就已反应完全 |
B.增大压强,反应速率增大,平衡将向右移动,K>2.5 106 106 |
| C.升高温度,既加快反应速率又可以提高有害气体的平衡转化率 |
| D.选用适宜催化剂可以使尾气排放达到标准 |
您最近一年使用:0次
2023-12-22更新
|
74次组卷
|
3卷引用:广东省广州真光中学2021-2022学年高二上学期期中考试化学试题
名校
2 . NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g)ΔH=57kJ·mol-1,下列有关说法正确的是
| A.升高体系温度正反应速率增大,逆反应速率也增大 |
| B.若容器体积不变,气体密度不变时说明该反应建立化学平衡 |
C.其它条件不变,向平衡后的容器中再加入少量N2O4, 的值变大 的值变大 |
| D.增大体系的压强能提高N2O4的反应速率和转化率 |
您最近一年使用:0次
3 . 某化学反应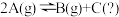 在三种不同条件下进行,
在三种不同条件下进行, 、
、 起始的物质的量为
起始的物质的量为 。反应物
。反应物 的浓度(
的浓度( )随反应时间的变化情况见下表,下列说法不正确的是
)随反应时间的变化情况见下表,下列说法不正确的是
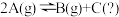 在三种不同条件下进行,
在三种不同条件下进行, 、
、 起始的物质的量为
起始的物质的量为 。反应物
。反应物 的浓度(
的浓度( )随反应时间的变化情况见下表,下列说法不正确的是
)随反应时间的变化情况见下表,下列说法不正确的是| 实验序号 |  |
|
|
|
|
|
|
 |  |
|
|
|
|
|
|
 |  |
|
|
|
|
|
|
 |  |
|
|
|
|
|
|
A.实验1中,前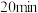 中A的平均反应速率为 中A的平均反应速率为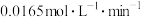 |
| B.实验1、2中,实验2可能使用了催化剂也可能压缩了体积 |
C.该反应的 |
D.实验3中,在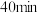 时加入一定量的C物质,平衡可能不移动 时加入一定量的C物质,平衡可能不移动 |
您最近一年使用:0次
4 . 在平衡体系: CaCO3(s) CaO(s) +CO2(g)中仅含有CaCO3、CaO及CO2气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。 若固体所占体积可忽略,且温度维持不变,测得此体系中压强(P纵坐标)跟时间(t横坐标)的关系如图所示,下列说法不正确的是
CaO(s) +CO2(g)中仅含有CaCO3、CaO及CO2气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。 若固体所占体积可忽略,且温度维持不变,测得此体系中压强(P纵坐标)跟时间(t横坐标)的关系如图所示,下列说法不正确的是

 CaO(s) +CO2(g)中仅含有CaCO3、CaO及CO2气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。 若固体所占体积可忽略,且温度维持不变,测得此体系中压强(P纵坐标)跟时间(t横坐标)的关系如图所示,下列说法不正确的是
CaO(s) +CO2(g)中仅含有CaCO3、CaO及CO2气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。 若固体所占体积可忽略,且温度维持不变,测得此体系中压强(P纵坐标)跟时间(t横坐标)的关系如图所示,下列说法不正确的是
| A.该反应的平衡常数Kp=p (CO2) |
| B.容器体积缩小,CO2浓度增大,平衡向左移动 |
| C.t1时,CaO反应完全 |
| D.t1时,若再加入足量的CaO,达到新平衡时体系的压强大于P |
您最近一年使用:0次
名校
5 . T1时,在1L恒容密闭容器中充入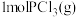 和
和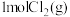 ,发生反应:
,发生反应: ,
, ,达平衡时升温至T2,实验测得:
,达平衡时升温至T2,实验测得: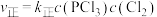 、
、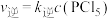 ,
, ,
, 为速率常数,只与温度有关。下列说法不正确的是
为速率常数,只与温度有关。下列说法不正确的是
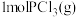 和
和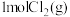 ,发生反应:
,发生反应: ,
, ,达平衡时升温至T2,实验测得:
,达平衡时升温至T2,实验测得: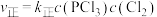 、
、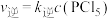 ,
, ,
, 为速率常数,只与温度有关。下列说法不正确的是
为速率常数,只与温度有关。下列说法不正确的是A.当 且不变时,该反应达到平衡状态 且不变时,该反应达到平衡状态 |
B.该反应的平衡常数可表示为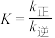 , ,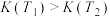 |
C.向T1温度下的平衡体系再充入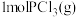 ,平衡正向移动,产物 ,平衡正向移动,产物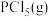 的体积分数变大 的体积分数变大 |
D.T1时,在一恒压密闭容器中充入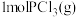 和 和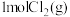 ,发生上述反应, ,发生上述反应, 的转化率变大 的转化率变大 |
您最近一年使用:0次
2023-08-23更新
|
476次组卷
|
4卷引用:云南省保山市2020-2021学年高二下学期期末考试化学试题
6 . 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ⇌2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列见表,下列说法错误的是
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3 mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大 |
| B.当混合气体平均相对分子质量为26时说明该反应已达平衡 |
| C.根据表中数据,计算25.0 ℃时分解的浓度平衡常数约为1.6×10-8 mol3/L3 |
| D.若保持温度和容器体积不变,平衡后再充入n(NH3)∶n(CO2)=2∶1,则再次达到平衡时c(NH3)不变 |
您最近一年使用:0次
2021-04-07更新
|
440次组卷
|
3卷引用:广西南宁市第三中学2020-2021学年高二下学期第一次月考化学(理)试题
名校
解题方法
7 . 正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
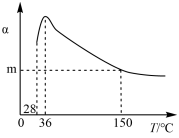
下列说法不正确 的是

名称 | 熔点/℃ | 沸点/℃ | 燃烧热 ∆H /kJ•mol-1 |
正戊烷 | -130 | 36 | –3506.1 |
异戊烷 | -159.4 | 27.8 | –3504.1 |
| A.25 ℃,101 kPa时,正戊烷异构化成异戊烷的热化学反应方程式为:CH3CH2CH2CH2CH3(l) = (CH3)2CHCH2CH3(l) ∆H = –2.0 kJ/mol |
| B.28~36 ℃时,随温度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动 |
| C.36~150 ℃时,随温度升高,正戊烷异构化反应的平衡常数增大 |
| D.150 ℃时,体系压强从100 kPa升高到500 kPa,正戊烷的平衡转化率基本不变 |
您最近一年使用:0次
2021-04-05更新
|
1203次组卷
|
12卷引用:北京市石景山区2021届高三一模化学试题
北京市石景山区2021届高三一模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(01)湖南省长沙市第一中学2021届高三第一次模拟考试化学试题广东省汕头市金山中学2021届高三下学期第三次模拟考试化学试题重庆市西南大学附属中学2020-2021学年高三下学期第六次月考化学试题(已下线)第22讲 化学平衡常数及转化率的计算(精练)-2022年高考化学一轮复习讲练测天津市宁河区芦台第一中学2022届高三下学期线上模拟(一)化学试题湖北省武汉市第一中学2023届高三上学期第一次月考化学试题北京市朝阳区2023届高三下学期三模化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题辽宁省沈阳市东北育才双语学校2023-2024学年高二上学期自主测评化学试题
8 . 已知反应: 。当反应达平衡时,
。当反应达平衡时,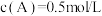 ,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得
,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得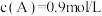 ,下列说法错误的是
,下列说法错误的是
 。当反应达平衡时,
。当反应达平衡时,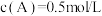 ,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得
,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得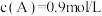 ,下列说法错误的是
,下列说法错误的是A. 的状态一定是气体 的状态一定是气体 | B.平衡常数不变 |
| C.平衡向逆反应方向移动 | D. |
您最近一年使用:0次
2021-02-06更新
|
208次组卷
|
2卷引用:四川省内江市2020-2021学年度第一学期高二期末检测化学试题
9 . NO与CO是燃油汽车尾气中的两种有害气体,已知:CO(g)+ NO(g)  CO2(g)+
CO2(g)+ N2(g) ΔH= -374.3 kJ·mol-1,平衡常数K为2.5×1060.有关该反应的说法不正确的是
N2(g) ΔH= -374.3 kJ·mol-1,平衡常数K为2.5×1060.有关该反应的说法不正确的是
 CO2(g)+
CO2(g)+ N2(g) ΔH= -374.3 kJ·mol-1,平衡常数K为2.5×1060.有关该反应的说法不正确的是
N2(g) ΔH= -374.3 kJ·mol-1,平衡常数K为2.5×1060.有关该反应的说法不正确的是| A.K很大,表明NO与CO能迅速反应 |
| B.在汽车排气管上安装”催化转化器”能够减小尾气对空气的污染 |
| C.升高温度,反应速率增大但K减小 |
| D.增大压强,平衡将向右移动 |
您最近一年使用:0次
10 . 反应2SO2(g)+O2(g)  2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是
2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是
 2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是
2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是| A.反应物的总能量高于生成物的总能量 |
| B.催化剂可以降低硫氧键键能 |
| C.加压有利于SO3生成,所以工业上压强越高越好 |
| D.升高温度可以增大正反应速率,降低逆反应速率 |
您最近一年使用:0次