名校
1 . 利用传感技术可探究压强对2NO2(g) N2O4(g)化学平衡移动的影响。在常温、100 kPa条件下,往注射器中充入适量NO2气体,当活塞位置不变时,分别在t1、t2s时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是
N2O4(g)化学平衡移动的影响。在常温、100 kPa条件下,往注射器中充入适量NO2气体,当活塞位置不变时,分别在t1、t2s时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是
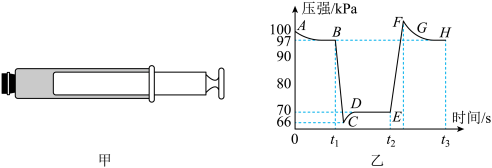
 N2O4(g)化学平衡移动的影响。在常温、100 kPa条件下,往注射器中充入适量NO2气体,当活塞位置不变时,分别在t1、t2s时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是
N2O4(g)化学平衡移动的影响。在常温、100 kPa条件下,往注射器中充入适量NO2气体,当活塞位置不变时,分别在t1、t2s时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是
| A.由B点到D点观察到注射器内气体颜色先变浅后逐渐变深 |
| B.由E点到F点注射器内气体颜色加深是平衡移动所致 |
| C.B、H两点对应的正反应速率vB= vH |
| D.B点处NO2的转化率为6% |
您最近一年使用:0次
2021-10-19更新
|
583次组卷
|
10卷引用:山西省怀仁市第一中学2021-2022学年高二上学期第二次月考理科综合化学试题
山西省怀仁市第一中学2021-2022学年高二上学期第二次月考理科综合化学试题四川省成都外国语学校2021-2022学年高二上学期10月月考化学试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)浙江省宁波效实中学2021-2022学年高二上学期期中考试化学试题福建省厦门第一中学2022-2023学年高二上学期第一次月考化学试题甘肃省平凉市第一中学2022-2023学年高二上学期第一次月考化学试题河北省石家庄市第四十一中学2023-2024学年高二上学期第一次月考化学试题(已下线)第13讲 第二章《化学反应速率与化学平衡》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)浙江省杭州第四中学2022-2023学年高二上学期期中考试 化学试题广东省佛山市顺德区罗定邦中学2023-2024学年高二上学期期中考试化学试题
2 . 利用合成气(主要成分为CO、CO2和H2)制备甲醇的主要反应有
①CO(g) +2H2(g) CH3OH(g) ΔH1 =-116 kJ/mol
CH3OH(g) ΔH1 =-116 kJ/mol
②CO2(g)+ H2(g) CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
向一固定体积的容器中充入合成气,已知起始时c(CO)=0.1 mol/L、c(H2)=0.3 mol/L,平衡时c(CO)=0.05 mol/L,c(H2O)=0.02 mol/L,则下列说法错误的是
①CO(g) +2H2(g)
 CH3OH(g) ΔH1 =-116 kJ/mol
CH3OH(g) ΔH1 =-116 kJ/mol②CO2(g)+ H2(g)
 CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol向一固定体积的容器中充入合成气,已知起始时c(CO)=0.1 mol/L、c(H2)=0.3 mol/L,平衡时c(CO)=0.05 mol/L,c(H2O)=0.02 mol/L,则下列说法错误的是
| A.增大CO2的浓度,有利于提高甲醇的产量 |
| B.升高温度,①和②反应速率都加快 |
| C.压缩体积,反应②平衡不移动 |
| D.平衡时c(CH3OH)为0.07 mol/L |
您最近一年使用:0次
2021-12-03更新
|
175次组卷
|
2卷引用:河北省百师联盟2022届高三上学期一轮复习联考(三)化学试题
名校
解题方法
3 . X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是
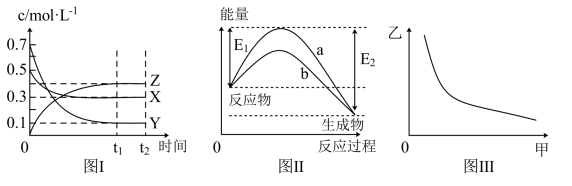

A.该反应的热化学方程式为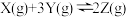 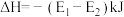 |
B.该温度下,反应的平衡常数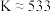 ,且若升高温度,K值减小 ,且若升高温度,K值减小 |
| C.图Ⅱ曲线b表示加入催化剂使反应活化能减小,焓变减小 |
| D.若图Ⅲ中甲表示压强,乙表示Z的含量,则其变化符合图Ⅲ中曲线 |
您最近一年使用:0次
4 . 甲醇水蒸气重整制氢具有能耗低、产物组成简单、副产物易分离等优点,是未来制氢技术的重要发展方向。该重整反应体系主要涉及以下反应:
I.CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H1
CO2(g)+3H2(g) △H1
II.CH3OH(g) CO(g)+2H2(g) △H2=+90kJ•mol-1
CO(g)+2H2(g) △H2=+90kJ•mol-1
(1)已知CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41kJ•mol-1
CO(g)+H2O(g) △H3=+41kJ•mol-1
反应I的△H1=___ kJ•mol-1。
(2)将组成(物质的量分数)为25%CH3OH(g)、35%H2O(g)和40%N2(g)(N2不参与反应)的气体通入恒容容器中反应相同时间,测得CH3OH转化率和产物的物质的量分数随温度变化关系如图所示。
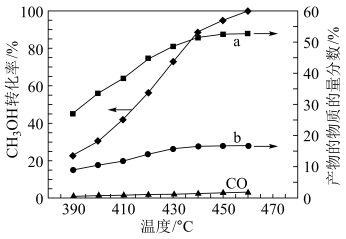
①曲线a和b分别代表产物___ 和___ 。
②下列对甲醇水蒸气重整制氢反应体系的说法合理的有___ 。
A.增大N2的浓度,反应I、II的正反应速率都增加
B.移除CO2能提高CH3OH的平衡转化率
C.升高温度,N2的物质的量分数保持不变
D.440℃~460℃时,升高温度,H2的产率增大
③反应I活化能小于反应II,结合图中信息解释判断依据___ 。
(3)一定条件下,向2L的恒容密闭容器中通入1molCH3OH(g)和1molH2O(g)发生上述反应,达到平衡时,容器中CO2为0.8mol,CO为0.1mol,此时H2的浓度为___ mol•L-1,反应I的平衡常数K=___ (写出计算式)。
(4)研究发现以铜作催化剂时,反应I经历三步:
①CH3OH→HCHO+H2,
②HCHO+H2O→HCOOH+H2,
③___ 。
I.CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) △H1
CO2(g)+3H2(g) △H1II.CH3OH(g)
 CO(g)+2H2(g) △H2=+90kJ•mol-1
CO(g)+2H2(g) △H2=+90kJ•mol-1(1)已知CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=+41kJ•mol-1
CO(g)+H2O(g) △H3=+41kJ•mol-1反应I的△H1=
(2)将组成(物质的量分数)为25%CH3OH(g)、35%H2O(g)和40%N2(g)(N2不参与反应)的气体通入恒容容器中反应相同时间,测得CH3OH转化率和产物的物质的量分数随温度变化关系如图所示。

①曲线a和b分别代表产物
②下列对甲醇水蒸气重整制氢反应体系的说法合理的有
A.增大N2的浓度,反应I、II的正反应速率都增加
B.移除CO2能提高CH3OH的平衡转化率
C.升高温度,N2的物质的量分数保持不变
D.440℃~460℃时,升高温度,H2的产率增大
③反应I活化能小于反应II,结合图中信息解释判断依据
(3)一定条件下,向2L的恒容密闭容器中通入1molCH3OH(g)和1molH2O(g)发生上述反应,达到平衡时,容器中CO2为0.8mol,CO为0.1mol,此时H2的浓度为
(4)研究发现以铜作催化剂时,反应I经历三步:
①CH3OH→HCHO+H2,
②HCHO+H2O→HCOOH+H2,
③
您最近一年使用:0次
2021-12-22更新
|
430次组卷
|
3卷引用:广东省广州市2021-2022学年高三上学期12月调研考试化学试题
广东省广州市2021-2022学年高三上学期12月调研考试化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)广东省茂名高州市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
5 .  与
与 重整生成
重整生成 和CO的过程中主要发生下列反应:
和CO的过程中主要发生下列反应:
CH4(g)+CO2(g)=2H2(g)+2CO(g) ∆H =+247.1kJ /mol;
H2(g)+CO2(g)=H2O(g)+CO(g) ∆H =+41.2kJ /mol
在恒压、反应物起始物质的量比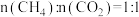 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列说法不正确的是
的平衡转化率随温度变化的曲线如图所示。下列说法不正确的是
 与
与 重整生成
重整生成 和CO的过程中主要发生下列反应:
和CO的过程中主要发生下列反应:CH4(g)+CO2(g)=2H2(g)+2CO(g) ∆H =+247.1kJ /mol;
H2(g)+CO2(g)=H2O(g)+CO(g) ∆H =+41.2kJ /mol
在恒压、反应物起始物质的量比
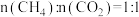 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列说法不正确的是
的平衡转化率随温度变化的曲线如图所示。下列说法不正确的是
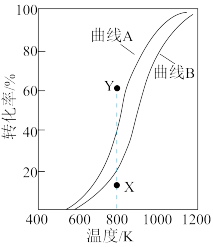
A.曲线A表示 的平衡转化率随温度的变化 的平衡转化率随温度的变化 |
| B.3CO2(g)+CH4(g)=2 H2O(g)+4CO(g) ∆H =+329.5kJ/mol |
C.升高温度、减小压强均有利于提高 的平衡转化率 的平衡转化率 |
D.恒压、800K、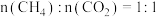 条件下,可通过改变 条件下,可通过改变 的量或使用高效催化剂等特定条件继续反应,使 的量或使用高效催化剂等特定条件继续反应,使 转化率从X点变为Y点 转化率从X点变为Y点 |
您最近一年使用:0次
名校
6 . 2NO2(红棕色)⇌N204∆H<0. 将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示。已知气体颜色越深,透光率越小,下列说法不正确的是
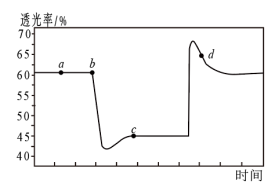

| A.a点达到了平衡状态 |
| B.b点改变的条件是将注射器的活塞向外拉 |
| C.d点:v(正) <v(逆) |
| D.若在c点将温度降低,其透光率将增大 |
您最近一年使用:0次
2021-10-12更新
|
195次组卷
|
2卷引用:四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题
7 . 一定压强下,向 10 L 密闭容器中充入 1 mol S2Cl2和 1 mol Cl2,发生反应 S2Cl2(g)+Cl2(g) 2SCl2(g)。Cl2与 SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是
2SCl2(g)。Cl2与 SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是
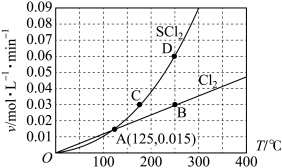
 2SCl2(g)。Cl2与 SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是
2SCl2(g)。Cl2与 SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是
| A.正反应的活化能大于逆反应的活化能 |
| B.达到平衡后再加热,平衡向逆反应方向移动 |
| C.A、B、C、D 四点对应状态下,达到平衡状态的为 B、D |
| D.一定温度下,在恒容密闭容器中,达到平衡后缩小容器体积,重新达到平衡后,Cl2的平衡转化率不变 |
您最近一年使用:0次
2021-03-26更新
|
158次组卷
|
4卷引用:浙江省温州市苍南县金乡卫城中学2020-2021学年高二下学期第一次月考化学试题
名校
解题方法
8 . 反应C(s)+H2O(g) CO(g)+H2(g)在某恒温密闭容器中进行,则下列说法或结论中,能够成立的是
CO(g)+H2(g)在某恒温密闭容器中进行,则下列说法或结论中,能够成立的是
 CO(g)+H2(g)在某恒温密闭容器中进行,则下列说法或结论中,能够成立的是
CO(g)+H2(g)在某恒温密闭容器中进行,则下列说法或结论中,能够成立的是A.其他条件不变,仅将容器的容积为原来的 ,反应速率加快 ,反应速率加快 |
| B.保持容器容积不变,充入少量He使体系压强增大,反应速率一定增大 |
| C.反应达到平衡状态时:v(CO)=v(H2O) |
| D.其他条件不变,适当增加C(s)的质量会使反应速率增大 |
您最近一年使用:0次
2021-01-08更新
|
107次组卷
|
3卷引用:河南省汤阴县五一中学2019-2020学年高一下学期第四次月考化学试题
9 . 在体积可变的密闭容器中投入0.5 molO2和1 mol SO2,不同条件下发生反应:O2(g)+2SO2(g) 2SO3(g)ΔH。实验测得平衡时SO2的转化率[α(SO2 )]随温度、压强的变化如图所示。下列说法错误的是
2SO3(g)ΔH。实验测得平衡时SO2的转化率[α(SO2 )]随温度、压强的变化如图所示。下列说法错误的是
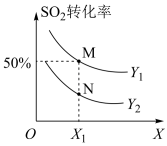
 2SO3(g)ΔH。实验测得平衡时SO2的转化率[α(SO2 )]随温度、压强的变化如图所示。下列说法错误的是
2SO3(g)ΔH。实验测得平衡时SO2的转化率[α(SO2 )]随温度、压强的变化如图所示。下列说法错误的是
| A.Y代表压强,且Y1> Y2;X代表温度,且ΔH <0 |
| B.M点反应物转化率之比α(O2) :α (SO2)=1:1,N点该比例减小 |
| C.若M、N两点对应的容器体积均为5 L,则N点的平衡常数K= 20 |
| D.M、N两点对应的平均摩尔质量:M(M)<M(N) |
您最近一年使用:0次
2021-12-03更新
|
230次组卷
|
2卷引用:河北省百师联盟2022届高三上学期一轮复习联考(三)化学试题
10 . 煤的液化是获得清洁燃料的一种方式,有人设想先用煤与水蒸气反应生成CO,再通过反应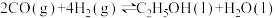
 实现煤的液化,若要利用这个反应进行乙醇的工业化生产,下列说法错误的是
实现煤的液化,若要利用这个反应进行乙醇的工业化生产,下列说法错误的是
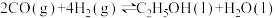
 实现煤的液化,若要利用这个反应进行乙醇的工业化生产,下列说法错误的是
实现煤的液化,若要利用这个反应进行乙醇的工业化生产,下列说法错误的是| A.其他条件不变,增大反应体系的压强,既有利于提高CO和H2的平衡转化率,又有利于加快化学反应速率 |
| B.其他条件不变,升高反应体系的温度,能够加快反应逃率,但CO和H2的平衡转化率降低 |
| C.其他条件不变,增大CO的浓度,CO和H2的平衡转化率均升高 |
| D.其他条件不变,使用高效催化剂,能够加快反应速率。但不能提高CO和H2的平衡转化率 |
您最近一年使用:0次
2021-11-17更新
|
135次组卷
|
2卷引用:江苏省省级联测2021-2022学年高二上学期第二次联考化学试题



