名校
1 . 在某温度下,反应:N2(g)+3H2(g)⇌2NH3(g)(正反应为放热反应)在密闭容器中达到平衡,下列说法中正确的是
| A.温度不变,缩小体积,N2的转化率增大 |
| B.温度不变,增大体积,NH3的产率提高 |
| C.升高温度,增大体积,有利于平衡向正反应方向移动 |
| D.降低温度,体积不变,H2的转化率降低 |
您最近一年使用:0次
2021-09-24更新
|
553次组卷
|
5卷引用:浙江省金华市第八中学2021-2022学年高二上学期9月月考化学试题
名校
2 . 对于平衡体系:mA(g)+nB(g) pC(g)+qD(g) △H<0,下列说法错误的是
pC(g)+qD(g) △H<0,下列说法错误的是
 pC(g)+qD(g) △H<0,下列说法错误的是
pC(g)+qD(g) △H<0,下列说法错误的是| A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.58倍,则m+n>p+q |
| B.若反应从正反应开始,达平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C.若m+n=p+q,则当容器内温度升高时,平衡逆向移动,容器中气体的压强不变 |
| D.若平衡体系中共有气体a mol,再向其中加入b mol B,当重新达到平衡时,气体的总物质的量等于(a+b) mol,则m+n=p+q |
您最近一年使用:0次
2020-09-15更新
|
94次组卷
|
3卷引用:黑龙江省双鸭山市第一中学2021-2022学年高二上学期第一次月考化学试题
名校
3 . 高温结构陶瓷氮化硅(Si3N4)可由石英与焦炭在高温的氮气流中通过以下反应制备: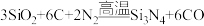 ,下列说法中错误的是
,下列说法中错误的是
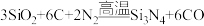 ,下列说法中错误的是
,下列说法中错误的是| A.氮化硅陶瓷是制造火箭发动机的理想材料 | B.氮气流的作用只是参与化学反应 |
| C.CO的沸点大于N2的沸点 | D.1molSi3N4中含有Si-N键数为12NA |
您最近一年使用:0次
2021-03-13更新
|
356次组卷
|
2卷引用:辽宁省沈阳市一二零中学2021-2022学年高三上学期教学质量检测一化学试题
名校
4 . 人体内的血红蛋白(Hb)可与O2结合形成HbO2,Hb(aq)也可以与CO结合,人体发生CO中毒的原理为:HbO2(aq)+CO(g) HbCO(aq)+O2(g) ΔH<0.下列说法
HbCO(aq)+O2(g) ΔH<0.下列说法不正确 的是
 HbCO(aq)+O2(g) ΔH<0.下列说法
HbCO(aq)+O2(g) ΔH<0.下列说法| A.海拔较高的地区由于气压较低,所以血红蛋白较难与O2结合,容易产生缺氧现象 |
| B.已知CO中毒为熵减过程,则理论上冬天比夏天可能更容易发生CO中毒现象 |
| C.把CO中毒的人转到高压氧仓中有助于缓解症状 |
D.此反应的平衡常数K=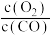 |
您最近一年使用:0次
2021-03-05更新
|
573次组卷
|
8卷引用:重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题
重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题重庆市石柱中学校2021-2022学年高二上学期第一次月考化学试题(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题浙江省金华十校2021届高三11月选考化学模拟试卷(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)
5 . 某温度下,在甲、乙、丙三个恒容密闭容器中进行反应CO2(g)+H2(g) CO(g)+H2O(g),起始时投料如下表,达到平衡状态时K=4.
CO(g)+H2O(g),起始时投料如下表,达到平衡状态时K=4.
下列有关说法正确的是
 CO(g)+H2O(g),起始时投料如下表,达到平衡状态时K=4.
CO(g)+H2O(g),起始时投料如下表,达到平衡状态时K=4. 起始浓度(mol·L-1) | 甲 | 乙 | 丙 |
c(CO2) | 0.01 | 0.02 | 0.02 |
c(H2) | 0.01 | 0.01 | 0.02 |
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为0.25 CO2(g)+H2(g)的平衡常数为0.25 |
| B.平衡的时间:t丙>t乙>t甲 |
| C.平衡时,CO2的转化率:乙<甲<丙 |
| D.平衡时,H2的转化率:甲=丙<乙 |
您最近一年使用:0次
2021-05-13更新
|
186次组卷
|
2卷引用:山东省济宁市邹城第一中学2021-2022学年高二上学期10月月考化学试卷
名校
解题方法
6 . 已知图一表示的是可逆反应C(s)+H2O(g) CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)
CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g) 2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
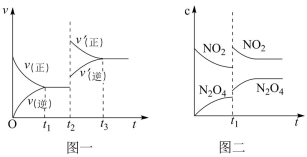
 CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)
CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g) 2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件是增大压强,则反应的△H增大 |
| C.图二t1时改变的条件可能是升高了温度 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
您最近一年使用:0次
2021-03-04更新
|
905次组卷
|
8卷引用:四川省成都市简阳市阳安中学2021-2022学年高二上学期9月月考化学试卷
四川省成都市简阳市阳安中学2021-2022学年高二上学期9月月考化学试卷广东省佛山市南海区桂城中学2021-2022学年高二上学期第一次月考化学试题新疆乌苏市第一中学2020-2021学年高二下学期入学检测化学(4-21班)试题(已下线)周末培优1 化学反应速率与化学平衡图像问题-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.4 化学反应的调控(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)广东省广州市四校联考2022-2023学年高二上学期第一次月考化学试题广东省徐闻县徐闻中学2022-2023学年高二上学期开学测试化学试题
名校
解题方法
7 . 下列说法不正确的是
| A.增大反应物浓度,活化分子百分数增大,有效碰撞次数增多 |
| B.增大压强,单位体积内气体的活化分子数增多,有效碰撞次数增多 |
| C.升高温度,活化分子百分数增加,分子运动速度加快,有效碰撞次数增多 |
| D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞次数增多 |
您最近一年使用:0次
2021-12-24更新
|
534次组卷
|
22卷引用:山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题
山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题浙江省山河联盟2021-2022学年高二上学期12月考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B河南省南阳一中2019-2020学年高二上期第二次月考化学试题辽宁省阜新市第二高级中学2020-2021学年高二上学期第二次月考化学试题浙江省宁波市咸祥中学2021-2022学年高二上学期期中考试化学试题云南省昆明市第十中学2021-2022学年高二下学期3月月考化学试题浙江省玉环市玉城中学2022-2023学年高二上学期第一次月考化学试题 新疆维吾尔自治区喀什第六中学2022-2023学年高二上学期第一次月考化学试题吉林市第二中学2022-2023学年高二上学期9月月考化学试题浙江省龙泉浙大中学2022-2023学年高二上学期12月教学质量检测化学试题新疆奎屯市第一高级中学2023-2024学年高二上学期9月月考化学试题(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡内蒙古集宁一中(西校区)2018-2019学年高一下学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2019-2020学年高二上学期第二次考试化学试题云南省迪庆州维西县第二中学2019-2020学年上学期高二期末考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题天津市红桥区2021-2022学年高二上学期期末考试化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期末检测化学试题广东省台山市某校2023-2024学年高二上学期期中考试化学试题
名校
8 . 在一定温度下的密闭容器中,A与B在一定条件下发生反应:A(s)+B(g) ⇌C(g)ΔH<0,改变B的物质的量并使之达到平衡,得到如图所示的平衡曲线,下列说法不正确的是( )


| A.增加少量A物质,平衡不移动 |
| B.斜率(tanθ)为平衡常数,且随温度升高而减小 |
| C.恒温恒容时,加入少量B,B的平衡转化率变小 |
| D.缩小容器体积,气体平均相对分子质量不变 |
您最近一年使用:0次
2020-08-23更新
|
56次组卷
|
2卷引用:湖南省临澧县第一中学2021-2022学年高二上学期第一次阶段性考试化学试题
9 . 氨基甲酸铵发生分解的化学方程式为NH2COONH4(s) 2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1
(Ⅱ)关闭K2,缓慢开启K3至U形管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0kPa、17.1kPa。下列说法错误的是
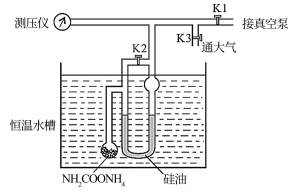
 2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1
(Ⅱ)关闭K2,缓慢开启K3至U形管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0kPa、17.1kPa。下列说法错误的是

| A.若保持温度和容器体积不变,平衡后再充入n(NH3):n(CO2)=2:1,再次达到平衡时c(NH3)不变 |
| B.气体平均分子量不变不能作为判断反应达到平衡状态的依据 |
| C.该反应25℃时的化学平衡常数Kp=2.56×1011Pa3 |
| D.步骤Ⅱ中读数时U形管左侧液面偏低,Kp测量值偏大 |
您最近一年使用:0次
10 . 利用合成气(主要成分为CO、CO2和H2)制备甲醇的主要反应有
①CO(g) +2H2(g) CH3OH(g) ΔH1 =-116 kJ/mol
CH3OH(g) ΔH1 =-116 kJ/mol
②CO2(g)+ H2(g) CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
向一固定体积的容器中充入合成气,已知起始时c(CO)=0.1 mol/L、c(H2)=0.3 mol/L,平衡时c(CO)=0.05 mol/L,c(H2O)=0.02 mol/L,则下列说法错误的是
①CO(g) +2H2(g)
 CH3OH(g) ΔH1 =-116 kJ/mol
CH3OH(g) ΔH1 =-116 kJ/mol②CO2(g)+ H2(g)
 CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol向一固定体积的容器中充入合成气,已知起始时c(CO)=0.1 mol/L、c(H2)=0.3 mol/L,平衡时c(CO)=0.05 mol/L,c(H2O)=0.02 mol/L,则下列说法错误的是
| A.增大CO2的浓度,有利于提高甲醇的产量 |
| B.升高温度,①和②反应速率都加快 |
| C.压缩体积,反应②平衡不移动 |
| D.平衡时c(CH3OH)为0.07 mol/L |
您最近一年使用:0次
2021-12-03更新
|
175次组卷
|
2卷引用:河北省百师联盟2022届高三上学期一轮复习联考(三)化学试题



