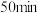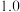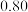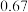1 . 下列有关反应M(g)+2N(g) 3G(g)+H(s)的说法正确的是
3G(g)+H(s)的说法正确的是
 3G(g)+H(s)的说法正确的是
3G(g)+H(s)的说法正确的是| A.在体积可变的密闭容器中,该反应达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量变大、混合气体密度变大 |
| B.若T℃时该反应的平衡常数K=1.0,则在T ℃时在使用催化剂后该反应的K值将大于1.0 |
| C.某温度下,若向已达平衡的该反应体系中加入1molM(g)和2molN(g),则平衡不移动 |
| D.如果该反应在容积不变的密闭容器中进行,当反应达到平衡时v正(N)∶v逆(G)=2∶3 |
您最近一年使用:0次
2 . 下列关于2SO2(g)+O2(g)⇌2SO3(g) ∆H=-197kJ∙mol-1的说法正确的是
| A.该反应的∆S>0 |
| B.该反应中,反应物的总能量小于生成物的总能量 |
| C.生产过程中将SO3分离出去,逆反应速率减慢 |
| D.其他条件不变,增大压强,平衡右移,平衡常数增大 |
您最近一年使用:0次
2021-12-14更新
|
531次组卷
|
5卷引用:江苏省南通市海门区2021-2022学年高三第二次诊断测试化学试题
江苏省南通市海门区2021-2022学年高三第二次诊断测试化学试题(已下线)第22讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期末考试化学试题 江苏省苏州市重点中学2022-2023学年高三上学期10月月考化学试题江苏省灌南高级中学2023-2024学年高三上学期第一次月考化学试题
3 . 氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业;合成氨反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol。实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气。下列有关合成氨反应的说法正确的是
2NH3(g) ΔH=-92.4kJ/mol。实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气。下列有关合成氨反应的说法正确的是
 2NH3(g) ΔH=-92.4kJ/mol。实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气。下列有关合成氨反应的说法正确的是
2NH3(g) ΔH=-92.4kJ/mol。实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气。下列有关合成氨反应的说法正确的是 | A.反应的ΔS>0 |
| B.反应的ΔH=E(N-N)+3E(H-H)-6E(N-H) (E表示键能) |
| C.反应中每消耗1mol H2转移电子的数目约等于2×6.02×1023 |
| D.反应在高温、高压和催化剂条件下进行可提高H2的平衡转化率 |
您最近一年使用:0次
名校
4 . NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g)ΔH=57kJ·mol-1,下列有关说法正确的是
| A.升高体系温度正反应速率增大,逆反应速率也增大 |
| B.若容器体积不变,气体密度不变时说明该反应建立化学平衡 |
C.其它条件不变,向平衡后的容器中再加入少量N2O4, 的值变大 的值变大 |
| D.增大体系的压强能提高N2O4的反应速率和转化率 |
您最近一年使用:0次
5 . 某化学反应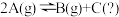 在三种不同条件下进行,
在三种不同条件下进行, 、
、 起始的物质的量为
起始的物质的量为 。反应物
。反应物 的浓度(
的浓度( )随反应时间的变化情况见下表,下列说法不正确的是
)随反应时间的变化情况见下表,下列说法不正确的是
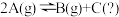 在三种不同条件下进行,
在三种不同条件下进行, 、
、 起始的物质的量为
起始的物质的量为 。反应物
。反应物 的浓度(
的浓度( )随反应时间的变化情况见下表,下列说法不正确的是
)随反应时间的变化情况见下表,下列说法不正确的是| 实验序号 |  |
|
|
|
|
|
|
 |  |
|
|
|
|
|
|
 |  |
|
|
|
|
|
|
 |  |
|
|
|
|
|
|
A.实验1中,前 中A的平均反应速率为 中A的平均反应速率为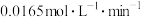 |
| B.实验1、2中,实验2可能使用了催化剂也可能压缩了体积 |
C.该反应的 |
D.实验3中,在 时加入一定量的C物质,平衡可能不移动 时加入一定量的C物质,平衡可能不移动 |
您最近一年使用:0次
名校
6 . 在某温度下,反应:N2(g)+3H2(g)⇌2NH3(g)(正反应为放热反应)在密闭容器中达到平衡,下列说法中正确的是
| A.温度不变,缩小体积,N2的转化率增大 |
| B.温度不变,增大体积,NH3的产率提高 |
| C.升高温度,增大体积,有利于平衡向正反应方向移动 |
| D.降低温度,体积不变,H2的转化率降低 |
您最近一年使用:0次
2021-09-24更新
|
553次组卷
|
5卷引用:2021年辽宁高考化学试题变式题11-19
名校
解题方法
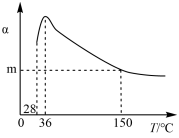
7 . 正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
下列说法不正确 的是

名称 | 熔点/℃ | 沸点/℃ | 燃烧热 ∆H /kJ•mol-1 |
正戊烷 | -130 | 36 | –3506.1 |
异戊烷 | -159.4 | 27.8 | –3504.1 |
| A.25 ℃,101 kPa时,正戊烷异构化成异戊烷的热化学反应方程式为:CH3CH2CH2CH2CH3(l) = (CH3)2CHCH2CH3(l) ∆H = –2.0 kJ/mol |
| B.28~36 ℃时,随温度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动 |
| C.36~150 ℃时,随温度升高,正戊烷异构化反应的平衡常数增大 |
| D.150 ℃时,体系压强从100 kPa升高到500 kPa,正戊烷的平衡转化率基本不变 |
您最近一年使用:0次
2021-04-05更新
|
1197次组卷
|
12卷引用:北京市石景山区2021届高三一模化学试题
北京市石景山区2021届高三一模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(01)湖南省长沙市第一中学2021届高三第一次模拟考试化学试题广东省汕头市金山中学2021届高三下学期第三次模拟考试化学试题重庆市西南大学附属中学2020-2021学年高三下学期第六次月考化学试题(已下线)第22讲 化学平衡常数及转化率的计算(精练)-2022年高考化学一轮复习讲练测天津市宁河区芦台第一中学2022届高三下学期线上模拟(一)化学试题北京市朝阳区2023届高三下学期三模化学试题湖北省武汉市第一中学2023届高三上学期第一次月考化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题辽宁省沈阳市东北育才双语学校2023-2024学年高二上学期自主测评化学试题
名校
解题方法
8 . 一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2,发生反应: S2Cl2(g)+Cl2(g) 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
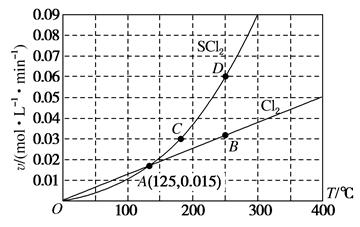
 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
| A.正反应的活化能大于逆反应的活化能 |
| B.A、B、C、D四点对应状态下,达到平衡状态的为A点 |
| C.一定温度下,在密闭容器中达到平衡后缩小容器体积,重新达到平衡后,S2Cl2的平衡转化率不变 |
| D.达到平衡后再加热,平衡向逆反应方向移动 |
您最近一年使用:0次
2021-03-29更新
|
326次组卷
|
3卷引用:2021年湖南省高考化学试卷变式题11-19
名校
9 . 工业上利用炭和水蒸气反应:C(s)+H2O(g)  CO(g)+H2(g)、CO(g)+H2O(g)
CO(g)+H2(g)、CO(g)+H2O(g)  CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO
CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO 能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。下列有关说法正确的是
能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。下列有关说法正确的是
 CO(g)+H2(g)、CO(g)+H2O(g)
CO(g)+H2(g)、CO(g)+H2O(g)  CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO
CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO 能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。下列有关说法正确的是
能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。下列有关说法正确的是| A.增大压强有利于提高上述反应中焦炭的利用率 |
B.NaHCO3溶液中,HCO 能形成多聚体是因为氢键的作用 能形成多聚体是因为氢键的作用 |
| C.若反应体系中,c(CO)=a mol·L-1,c(CO2)=b mol·L-1,则c(H2)=(a+b) mol·L-1 |
| D.析出NaHCO3的反应属于氧化还原反应 |
您最近一年使用:0次
名校
10 . 自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g) SiF4(g)+2H2O(g) △H=-148.9 kJ·mol-1。下列说法错误的是
SiF4(g)+2H2O(g) △H=-148.9 kJ·mol-1。下列说法错误的是
 SiF4(g)+2H2O(g) △H=-148.9 kJ·mol-1。下列说法错误的是
SiF4(g)+2H2O(g) △H=-148.9 kJ·mol-1。下列说法错误的是| A.在地壳浅处容易有SiO2固体沉积 |
| B.如果上述反应的平衡常数K值变大,该反应在平衡移动时逆反应速率先减小后增大 |
| C.如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,v(H2O)=2v(SiF4) |
| D.若该反应的容器容积为2.0 L,反应时间8.0 min,容器内气体的质量增加了0.24 g,在这段时间内HF的平均反应速率为0.0020 mol·L-1·min-1 |
您最近一年使用:0次
2020-09-28更新
|
256次组卷
|
3卷引用:湖南省2021届新高考化学考前押题《最后一卷》化学试题