1 . 乙醇是一种清洁的替代能源,催化加氢制备乙醇技术是当前的研究热点。
(1) 催化加氢制备乙醇的反应为
催化加氢制备乙醇的反应为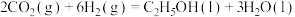 。
。
①若要计算上述反应的 ,须查阅的两个数据是
,须查阅的两个数据是 的燃烧热和
的燃烧热和___________ 。
②某金属有机骨架负载的铜基催化剂上, 加氢生成
加氢生成 的部分反应机理如图所示。
的部分反应机理如图所示。 过程中两个
过程中两个 均参与反应,画出
均参与反应,画出 的结构式(注明电荷)
的结构式(注明电荷)___________ 。
(2)乙酸甲酯催化加氢制备乙醇主要涉及如下反应:
反应Ⅰ:

反应Ⅱ:
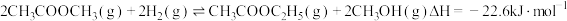
在其他条件不变时,将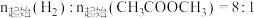 的混合气体以一定流速通入装有铜基催化剂的反应管,测得
的混合气体以一定流速通入装有铜基催化剂的反应管,测得 转化率、
转化率、 选择性
选择性 选择性
选择性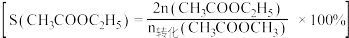 ]随温度的变化如图所示。
]随温度的变化如图所示。 与
与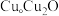 的晶胞如图所示(立方体),
的晶胞如图所示(立方体), 晶体的密度可表示为
晶体的密度可表示为___________  (用含
(用含 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。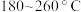 下均有
下均有 ,其原因是
,其原因是___________ 。
③ 范围内,
范围内, 转化率随温度升高而迅速增大的主要原因是
转化率随温度升高而迅速增大的主要原因是___________ 。
④温度高于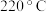 时,催化剂的催化活性下降,其原因可能是
时,催化剂的催化活性下降,其原因可能是___________ 。
(1)
 催化加氢制备乙醇的反应为
催化加氢制备乙醇的反应为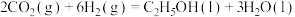 。
。①若要计算上述反应的
 ,须查阅的两个数据是
,须查阅的两个数据是 的燃烧热和
的燃烧热和②某金属有机骨架负载的铜基催化剂上,
 加氢生成
加氢生成 的部分反应机理如图所示。
的部分反应机理如图所示。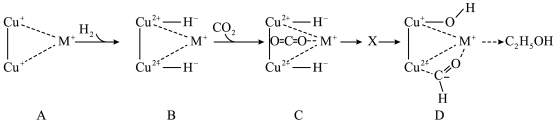
 过程中两个
过程中两个 均参与反应,画出
均参与反应,画出 的结构式(注明电荷)
的结构式(注明电荷)(2)乙酸甲酯催化加氢制备乙醇主要涉及如下反应:
反应Ⅰ:

反应Ⅱ:
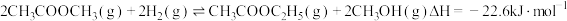
在其他条件不变时,将
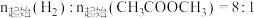 的混合气体以一定流速通入装有铜基催化剂的反应管,测得
的混合气体以一定流速通入装有铜基催化剂的反应管,测得 转化率、
转化率、 选择性
选择性 选择性
选择性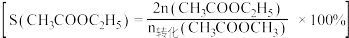 ]随温度的变化如图所示。
]随温度的变化如图所示。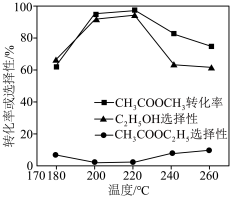
 与
与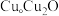 的晶胞如图所示(立方体),
的晶胞如图所示(立方体), 晶体的密度可表示为
晶体的密度可表示为 (用含
(用含 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。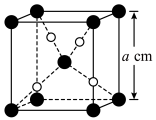
 下均有
下均有 ,其原因是
,其原因是③
 范围内,
范围内, 转化率随温度升高而迅速增大的主要原因是
转化率随温度升高而迅速增大的主要原因是④温度高于
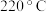 时,催化剂的催化活性下降,其原因可能是
时,催化剂的催化活性下降,其原因可能是
您最近一年使用:0次
名校
解题方法
2 . 磷资源流失到水环境中会造成水体富营养化。已知: 基磁性纳米复合材料,由
基磁性纳米复合材料,由 和纳米
和纳米 经过超声分散制得。能通过纳米
经过超声分散制得。能通过纳米 物理吸附和
物理吸附和 溶出后通过化学反应等去除水体磷。已知:纳米
溶出后通过化学反应等去除水体磷。已知:纳米 颗粒表面带正电荷;部分物质的溶解性如下表。
颗粒表面带正电荷;部分物质的溶解性如下表。
(1)制备复合材料所需的纳米 :一定条件下,先将
:一定条件下,先将 和
和 晶体配制成混合溶液,再与氨水反应可制得纳米
晶体配制成混合溶液,再与氨水反应可制得纳米 ,实验装置如下:
,实验装置如下:
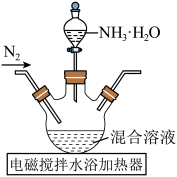
①氨水缓慢滴入,开始一段时间内未出现浑浊,原因是___________ 。
②制备纳米 需控温在50~60°℃之间,写出该反应的化学方程式:
需控温在50~60°℃之间,写出该反应的化学方程式:___________ 。
③配制混合溶液时按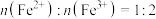 进行投料:实验中需不断通入
进行投料:实验中需不断通入 。通
。通 的目的是
的目的是___________ 。
(2)研究不同pH下向含磷(V)废水中加入 纳米复合材料的除磷效果:
纳米复合材料的除磷效果:
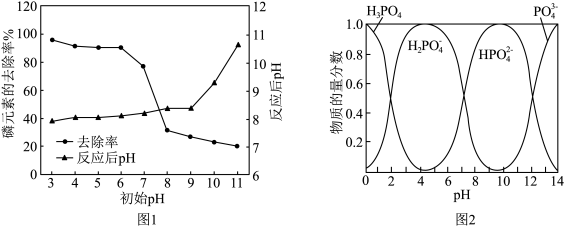
①从图1中可以看出初始pH为3~6时,磷的去除率较高且反应后pH均有一定的上升,反应过程中无气体生成。结合图2,写出对应的离子方程式:___________ 。
②当初始pH为9~10时,磷的去除率明显小于初始pH为3~6的去除率,是因为___________ 。
(3)除磷后续处理
除磷回收得到的磷矿物 ,可进一步转化为
,可进一步转化为 ,作为钾磷复合肥使用。设计由
,作为钾磷复合肥使用。设计由 浆料制备
浆料制备 晶体的实验方案:向含
晶体的实验方案:向含 的浆料中
的浆料中___________ ,干燥。[已知: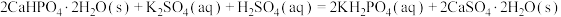 ;室温下从
;室温下从 饱和溶液中可结晶析出
饱和溶液中可结晶析出 晶体;实验中
晶体;实验中须选用 的试剂: 溶液、
溶液、 溶液,pH试纸,无水乙醇]
溶液,pH试纸,无水乙醇]
 基磁性纳米复合材料,由
基磁性纳米复合材料,由 和纳米
和纳米 经过超声分散制得。能通过纳米
经过超声分散制得。能通过纳米 物理吸附和
物理吸附和 溶出后通过化学反应等去除水体磷。已知:纳米
溶出后通过化学反应等去除水体磷。已知:纳米 颗粒表面带正电荷;部分物质的溶解性如下表。
颗粒表面带正电荷;部分物质的溶解性如下表。| 物质 |  |  |  |  |
| 溶解性 | 难溶 | 微溶 | 可溶 | 易溶 |
(1)制备复合材料所需的纳米
 :一定条件下,先将
:一定条件下,先将 和
和 晶体配制成混合溶液,再与氨水反应可制得纳米
晶体配制成混合溶液,再与氨水反应可制得纳米 ,实验装置如下:
,实验装置如下:
①氨水缓慢滴入,开始一段时间内未出现浑浊,原因是
②制备纳米
 需控温在50~60°℃之间,写出该反应的化学方程式:
需控温在50~60°℃之间,写出该反应的化学方程式:③配制混合溶液时按
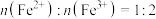 进行投料:实验中需不断通入
进行投料:实验中需不断通入 。通
。通 的目的是
的目的是(2)研究不同pH下向含磷(V)废水中加入
 纳米复合材料的除磷效果:
纳米复合材料的除磷效果:
①从图1中可以看出初始pH为3~6时,磷的去除率较高且反应后pH均有一定的上升,反应过程中无气体生成。结合图2,写出对应的离子方程式:
②当初始pH为9~10时,磷的去除率明显小于初始pH为3~6的去除率,是因为
(3)除磷后续处理
除磷回收得到的磷矿物
 ,可进一步转化为
,可进一步转化为 ,作为钾磷复合肥使用。设计由
,作为钾磷复合肥使用。设计由 浆料制备
浆料制备 晶体的实验方案:向含
晶体的实验方案:向含 的浆料中
的浆料中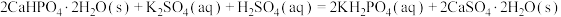 ;室温下从
;室温下从 饱和溶液中可结晶析出
饱和溶液中可结晶析出 晶体;实验中
晶体;实验中 溶液、
溶液、 溶液,pH试纸,无水乙醇]
溶液,pH试纸,无水乙醇]
您最近一年使用:0次
名校
解题方法
3 . 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应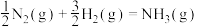 的
的
___________  。
。

(2)合成氮的原料混合气体的进料组成为 ;
;
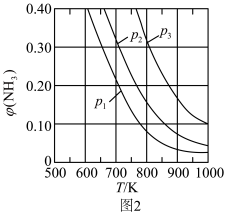
①在不同压强下反应达平衡时,氨的体积分数 与温度的关系如图2所示,其中压强(
与温度的关系如图2所示,其中压强( 、
、 、
、 )
)由小到大 的顺序为___________ 。
②将混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中 的体积分数
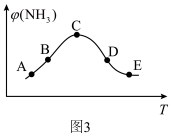
的体积分数 关系如图3所示,图3中各点表示的状态一定
关系如图3所示,图3中各点表示的状态一定未达到 平衡的是___________ (填字母)。
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是___________(填字母)。
(4)氮氧化物会造成环境污染,SCR技术利用 选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
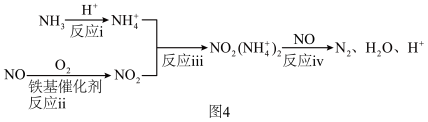
①对于反应ii: ,用
,用 表示的速率方程为
表示的速率方程为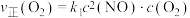 ;用
;用 表示的速率方程为
表示的速率方程为 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则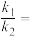
___________ (填数值)。
②根据上述机理,等物质的量的 、NO在有氧条件下完全转化为
、NO在有氧条件下完全转化为 的总反应化学方程式为
的总反应化学方程式为___________ 。
(1)根据图1数据计算反应
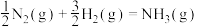 的
的
 。
。
(2)合成氮的原料混合气体的进料组成为
 ;
;①在不同压强下反应达平衡时,氨的体积分数
 与温度的关系如图2所示,其中压强(
与温度的关系如图2所示,其中压强( 、
、 、
、 )
)
②将混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中
 的体积分数
的体积分数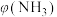 关系如图3所示,图3中各点表示的状态一定
关系如图3所示,图3中各点表示的状态一定
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是___________(填字母)。
| A.采用较高温度(400~500℃) | B.将生成的氨液化并及时从体系中分离出来 |
| C.用铁触媒加快化学反应速率 | D.采用较高压强(20~50MPa) |
(4)氮氧化物会造成环境污染,SCR技术利用
 选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
①对于反应ii:
 ,用
,用 表示的速率方程为
表示的速率方程为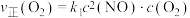 ;用
;用 表示的速率方程为
表示的速率方程为 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则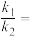
②根据上述机理,等物质的量的
 、NO在有氧条件下完全转化为
、NO在有氧条件下完全转化为 的总反应化学方程式为
的总反应化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 烟气中的NOx是大气的主要污染物之一,NOx的吸收处理是当前研究的热点。
(1)还原吸收法
方法1:直接使用尿素[CO(NH2)2]溶液吸收烟气中的NOx。
方法2:先用合适的氧化剂将NOx中的NO氧化为NO2,再用CO(NH2)2溶液去还原吸收。
还原吸收等量的NOx,消耗尿素较多的是___________ (填“方法1”或“方法2”)。工业上选择方法2处理NOx的原因是___________ 。
(2)水吸收法
NO2和N2O4均能被水吸收,不同初始压强下,NO2和N2O4的混合气体被水吸收前和吸收达平衡后,气体中NO2和N2O4的体积分数如图所示。混合气体中与水反应的主要成分是___________ 。达平衡后,气体中的NO2和N2O4的体积分数之和远小于100%,原因是___________ 。

(3)配合物吸收法
钴氨配合物吸收NO的主要原理如下。 对NO的配合能力很强,而
对NO的配合能力很强,而 对NO的配合能力极低。
对NO的配合能力极低。

①与NO反应的 和与
和与 反应的
反应的 物质的量之比为
物质的量之比为___________ 。
②钴氨溶液经过多次循环吸收NO后,其吸收NO的能力会降低,为了恢复钴氨溶液吸收NO的能力,需采取的方法是___________ 。
(4)NO与 在某催化剂表面反应生成
在某催化剂表面反应生成 的过程中,
的过程中, 在催化剂表面能形成被吸附的O(用O-Site表示),接下来的机理可能有两种:
在催化剂表面能形成被吸附的O(用O-Site表示),接下来的机理可能有两种:
机理1: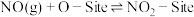
机理2: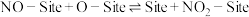
上述两个反应均为基元反应。保持温度和NO的浓度不变,测得NO与 在该催化剂作用下反应的初始速率与
在该催化剂作用下反应的初始速率与 浓度的关系如图所示。能合理解释图中曲线变化的机理为
浓度的关系如图所示。能合理解释图中曲线变化的机理为___________ (填“机理1”或“机理2”);判断的依据是___________ 。

(1)还原吸收法
方法1:直接使用尿素[CO(NH2)2]溶液吸收烟气中的NOx。
方法2:先用合适的氧化剂将NOx中的NO氧化为NO2,再用CO(NH2)2溶液去还原吸收。
还原吸收等量的NOx,消耗尿素较多的是
(2)水吸收法
NO2和N2O4均能被水吸收,不同初始压强下,NO2和N2O4的混合气体被水吸收前和吸收达平衡后,气体中NO2和N2O4的体积分数如图所示。混合气体中与水反应的主要成分是

(3)配合物吸收法
钴氨配合物吸收NO的主要原理如下。
 对NO的配合能力很强,而
对NO的配合能力很强,而 对NO的配合能力极低。
对NO的配合能力极低。
①与NO反应的
 和与
和与 反应的
反应的 物质的量之比为
物质的量之比为②钴氨溶液经过多次循环吸收NO后,其吸收NO的能力会降低,为了恢复钴氨溶液吸收NO的能力,需采取的方法是
(4)NO与
 在某催化剂表面反应生成
在某催化剂表面反应生成 的过程中,
的过程中, 在催化剂表面能形成被吸附的O(用O-Site表示),接下来的机理可能有两种:
在催化剂表面能形成被吸附的O(用O-Site表示),接下来的机理可能有两种:机理1:
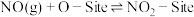
机理2:
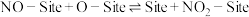
上述两个反应均为基元反应。保持温度和NO的浓度不变,测得NO与
 在该催化剂作用下反应的初始速率与
在该催化剂作用下反应的初始速率与 浓度的关系如图所示。能合理解释图中曲线变化的机理为
浓度的关系如图所示。能合理解释图中曲线变化的机理为
您最近一年使用:0次
2023-06-02更新
|
618次组卷
|
3卷引用:江苏省扬州市2023届高三下学期三模化学试题
名校
5 . 碳热还原氧化锌反应可用于循环制氢。碳热还原氧化锌的主要反应如下:
反应I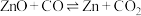 ;
;
反应Ⅱ
在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中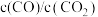 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是
反应I
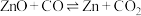 ;
;反应Ⅱ

在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中
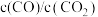 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是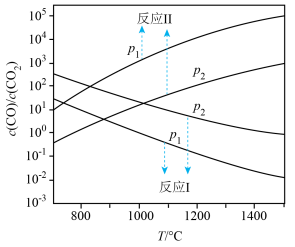
A.压强大小: |
B.在如图所示条件下,反应I可表示为  |
C.选择反应Ⅱ的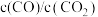 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 |
D.一定条件下将C与ZnO置于同一密闭容器中反应,当 时,增大 时,增大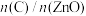 的值,可减少平衡时气体中 的值,可减少平衡时气体中 的含量 的含量 |
您最近一年使用:0次
2023-06-02更新
|
678次组卷
|
3卷引用:江苏省扬州市2023届高三下学期三模化学试题
解题方法
6 . 脱除沼气中的 具有重要意义,脱除
具有重要意义,脱除 有多种方法。
有多种方法。
(1)受热分解法。将 和
和 混合气导入热解器,反应分两步进行。
混合气导入热解器,反应分两步进行。
反应Ⅰ:
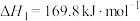
反应Ⅱ: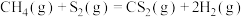
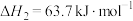
现将硫化氢和甲烷按照2:1体积比投料,并用 稀释。在常压和不同温度下,反应相同时间后,
稀释。在常压和不同温度下,反应相同时间后, 、
、 和
和 的体积分数随温度的变化关系如图所示。
的体积分数随温度的变化关系如图所示。

___________ 。
②1050℃时, 的体积分数为
的体积分数为___________ 。
③在950℃~1150℃范围内,其他条件不变,随着温度的升高, (g)的体积分数先增大而后减小,其原因可能是
(g)的体积分数先增大而后减小,其原因可能是___________ 。
(2)光电催化法。某光电催化法脱除 的原理如图所示。
的原理如图所示。 的离子方程式为
的离子方程式为___________ 。
②与受热分解法相比,光电催化法的优点是___________ 。
(3)催化重整法。Fe2O3可以用作脱除 的催化剂,脱除过程如图所示。
的催化剂,脱除过程如图所示。 时需先进行吸附。利用如图乙进行吸附,比如图甲吸附能力强的原因是
时需先进行吸附。利用如图乙进行吸附,比如图甲吸附能力强的原因是______ 。
②脱除一段时间后,催化剂的活性降低,原因是___________ 。
 具有重要意义,脱除
具有重要意义,脱除 有多种方法。
有多种方法。(1)受热分解法。将
 和
和 混合气导入热解器,反应分两步进行。
混合气导入热解器,反应分两步进行。反应Ⅰ:

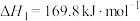
反应Ⅱ:
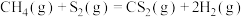
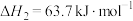
现将硫化氢和甲烷按照2:1体积比投料,并用
 稀释。在常压和不同温度下,反应相同时间后,
稀释。在常压和不同温度下,反应相同时间后, 、
、 和
和 的体积分数随温度的变化关系如图所示。
的体积分数随温度的变化关系如图所示。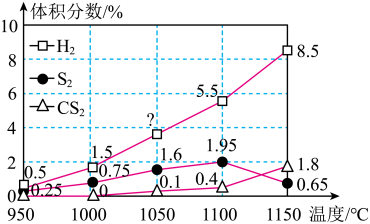


②1050℃时,
 的体积分数为
的体积分数为③在950℃~1150℃范围内,其他条件不变,随着温度的升高,
 (g)的体积分数先增大而后减小,其原因可能是
(g)的体积分数先增大而后减小,其原因可能是(2)光电催化法。某光电催化法脱除
 的原理如图所示。
的原理如图所示。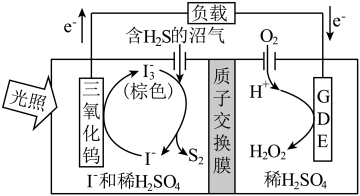
 的离子方程式为
的离子方程式为②与受热分解法相比,光电催化法的优点是
(3)催化重整法。Fe2O3可以用作脱除
 的催化剂,脱除过程如图所示。
的催化剂,脱除过程如图所示。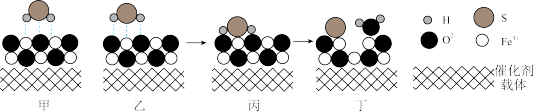
 时需先进行吸附。利用如图乙进行吸附,比如图甲吸附能力强的原因是
时需先进行吸附。利用如图乙进行吸附,比如图甲吸附能力强的原因是②脱除一段时间后,催化剂的活性降低,原因是
您最近一年使用:0次
名校
解题方法
7 . 工业上制备Ti,采用碳氯化法将 转化成
转化成 。在1000℃时发生如下:
。在1000℃时发生如下:
①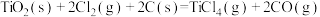
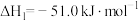
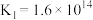
②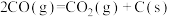
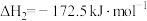
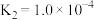
③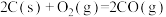
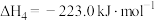
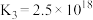 。
。
在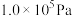 ,将
,将 、C、
、C、 以物质的量比1:2.2:2进行碳氯化,平衡时体系中
以物质的量比1:2.2:2进行碳氯化,平衡时体系中 、CO、
、CO、 和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
 转化成
转化成 。在1000℃时发生如下:
。在1000℃时发生如下:①
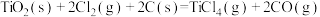
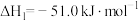
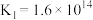
②
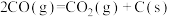
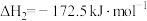
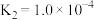
③
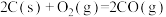
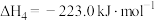
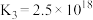 。
。在
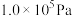 ,将
,将 、C、
、C、 以物质的量比1:2.2:2进行碳氯化,平衡时体系中
以物质的量比1:2.2:2进行碳氯化,平衡时体系中 、CO、
、CO、 和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是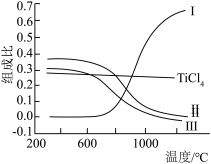
A.1000℃时,反应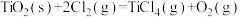 的平衡常数 的平衡常数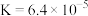 |
B.曲线III表示平衡时 的物质的量分数随温度的变化 的物质的量分数随温度的变化 |
| C.高于600℃,升高温度,主要对反应②的平衡产生影响 |
D.为保证 的平衡产率,选择反应温度应高于1000℃ 的平衡产率,选择反应温度应高于1000℃ |
您最近一年使用:0次
2023-03-23更新
|
1514次组卷
|
5卷引用:江苏省苏锡常镇四市2022-2023学年高三下学期教学情况调研(一)(3月)化学试题
江苏省苏锡常镇四市2022-2023学年高三下学期教学情况调研(一)(3月)化学试题江苏省郑梁梅高级中学2022-2023学年高二下学期4月月考化学试题(已下线)专题14 化学反应速率和化学平衡河北省衡水中学2023-2024学年高三上学期四调考试 化学试题(已下线)FHgkyldyjhx08
名校
解题方法
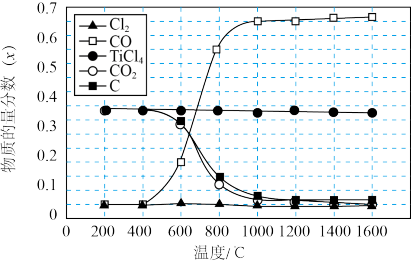
8 . 将金红石(TiO2)转化为TiCl4是生产金属钛的关键步骤。在1.0×105Pa,将TiO2、C、Cl2以物质的量比1:2:2进行反应,平衡体系中主要物质的物质的量分数(x)随温度变化理论计算结果如图所示。
下列说法不 正确的是

下列说法
| A.200~1600℃反应达到平衡时,TiO2的转化率均已接近100% |
B.将400℃时的平衡体系加热至800℃,平衡C(s)+CO2(g) 2CO(g)向正反应方向移动 2CO(g)向正反应方向移动 |
| C.1000℃时,测得某时刻x(TiCl4)=0.2.其他条件不变,延长反应时间能使x(TiCl4)超过该温度下平衡时的x(TiCl4) |
| D.实际生产时反应温度选择900℃而不选择200℃,其主要原因是:900℃比200℃时化学反应速率更快,生产效益更高 |
您最近一年使用:0次
2022-09-08更新
|
1142次组卷
|
8卷引用:江苏省南京市2023届高三9月学情调研化学试题
江苏省南京市2023届高三9月学情调研化学试题江苏省南京师范大学附属中学江宁分校2022-2023学年高三上学期期末检测化学试题江苏省常州市2022-2023学年高二下学期3月联合调研考试化学试题江苏省无锡市第一中学2023-2024学年高三上学期综合练习(三)化学试题浙江省舟山市舟山中学2022-2023学年国庆返校检测高三化学试题(已下线)2022年北京高考真题化学试题变式题(选择题11-14)(已下线)题型23 平衡常数、平衡转化率图象(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建
名校
解题方法
9 . 以Cu/ZnO/Al2O3为催化剂,乙醇直接合成乙酸乙酯过程中发生的可逆反应如下:
C2H5OH(g)=CH3CHO(g)+H2(g);ΔH=59kJ·mol-1
2CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);ΔH=-86kJ·mol-1
CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);ΔH=-25kJ·mol-1
2C2H5OH(g)=C2H5OC2H5(g)+H2O(g);ΔH=-44kJ·mol-1
其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。下列说法正确的是

C2H5OH(g)=CH3CHO(g)+H2(g);ΔH=59kJ·mol-1
2CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);ΔH=-86kJ·mol-1
CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);ΔH=-25kJ·mol-1
2C2H5OH(g)=C2H5OC2H5(g)+H2O(g);ΔH=-44kJ·mol-1
其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。下列说法正确的是

| A.在250~300℃范围,乙醇的转化率随温度的升高而减小 |
| B.在200~325℃范围,乙醇生成乙醚的反应均已到达平衡 |
| C.在300~325℃范围,出口处氢气的量随温度的升高而减小 |
| D.研发使用催化活性高的催化剂有利于提高乙酸乙酯的平衡产率 |
您最近一年使用:0次
2022-03-29更新
|
584次组卷
|
4卷引用:江苏省2022届高三下学期3月第一次调研测试化学试题
江苏省2022届高三下学期3月第一次调研测试化学试题江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)第七章 化学反应速率和化学平衡(测)-2023年高考化学一轮复习讲练测(全国通用)
10 . 铬是电镀、制革和颜料等工业废水中的主要重金属污染物。在水溶液中,Cr(III)以Cr3+形态存在;Cr(VI)主要以 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
(1)“NaBH4”可用于直接还原去除废水中的 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。

①废水初始pH=2.5时, 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式___________ 。
②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是___________ 。
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是______ 。
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的 。
。
①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是___________ 。
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是___________ 。
 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。(1)“NaBH4”可用于直接还原去除废水中的
 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
①废水初始pH=2.5时,
 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的
 。
。①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是
您最近一年使用:0次



