名校
1 . 在某密闭容器中,可逆反应:A(g) + B(g) ⇌xC(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图像(Ⅱ)说法不正确的是( )


| A.p3>p4,Y轴表示A的转化率 |
| B.p3>p4,Y轴表示B的质量分数 |
| C.p3>p4,Y轴表示B的转化率 |
| D.p3>p4,Y轴表示混合气体的平均相对分子质量 |
您最近半年使用:0次
2020-02-04更新
|
889次组卷
|
22卷引用:新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题
新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题2016-2017学年西藏拉萨中学高二上月考三化学卷2018-2019学年人教版高中化学选修四章化学反应速率和化学平衡末综合测评(二)甘肃省靖远县第四中学2018-2019学年高二上学期第二次月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高二上学期第二次月考化学试题2020届高考化学二轮复习提升练习《 化学反应反应速率与反应平衡》(已下线)第02章 化学反应速率与化学平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)山东省临沂市沂水一中2020-2021学年高二9月月考化学试题辽宁省铁岭市开原市第二高级中学2020-2021学年高二上学期期初考试化学试题(已下线)专题讲座(五)反应速率、平衡图像题解题策略(练) — 2022年高考化学一轮复习讲练测(新教材新高考)山东省济宁曲阜市第一中学2021-2022学年高二10月月考化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期中考试化学(理)试题内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题黑龙江省牡丹江市第二中学2022-2023学年高二上学期期中考试化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题(已下线)第七章 化学反应速率与化学平衡 第44练 化学反应速率、平衡的常规图像吉林省长春市九台区营城第一高级中学2022-2023学年高二上学期第一次月考化学试题广东省江门市开平市2022-2023学年高二上学期10月期中考试化学试题河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题云南省保山第一中学2022-2023学年高二下学期期末考试化学试题云南省文山州广南县第十中学校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 . 课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g) 2NH3(g)△H<0,△S<0。
2NH3(g)△H<0,△S<0。
(1)下列关于工业合成氨的说法不正确的是___
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是___ 。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3 v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:
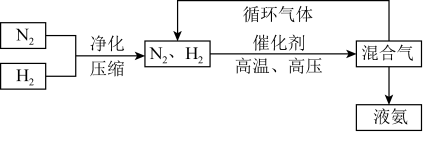
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2__ T1(填“>,<或=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是__ (填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①此条件下该反应的化学平衡常数K=__ 。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向___ 反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g) 2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为__ mol。
(6)已知:N2(g)+3H2(g) 2NH3(g)△H=-92kJ/mol
2NH3(g)△H=-92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式__ 。
 2NH3(g)△H<0,△S<0。
2NH3(g)△H<0,△S<0。(1)下列关于工业合成氨的说法不正确的是
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3 v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向
③N2(g)+3H2(g)
 2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为(6)已知:N2(g)+3H2(g)
 2NH3(g)△H=-92kJ/mol
2NH3(g)△H=-92kJ/molN2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式
您最近半年使用:0次
3 . 对可逆反应A(g)+B(g) C(g)(正反应为吸热反应),下列图像正确的是
C(g)(正反应为吸热反应),下列图像正确的是
 C(g)(正反应为吸热反应),下列图像正确的是
C(g)(正反应为吸热反应),下列图像正确的是A. | B. | C.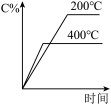 | D.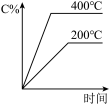 |
您最近半年使用:0次
2019-11-05更新
|
68次组卷
|
2卷引用:新疆克孜勒苏柯尔克孜自治州阿克陶县2022-2023学年高二上学期11月期中考试化学试题
名校
4 . 对于可逆反应2AB3(g) A2(g)+3B2(g)△H>0下列图像不正确的是()
A2(g)+3B2(g)△H>0下列图像不正确的是()
 A2(g)+3B2(g)△H>0下列图像不正确的是()
A2(g)+3B2(g)△H>0下列图像不正确的是()A. | B.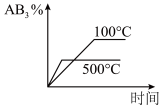 |
C. | D. |
您最近半年使用:0次
2019-10-13更新
|
217次组卷
|
17卷引用:新疆巴州焉耆县第三中学2018-2019学年高二上学期期末考试化学试题
新疆巴州焉耆县第三中学2018-2019学年高二上学期期末考试化学试题(已下线)2010年福建省师大附中高二上学期期中考试化学卷(已下线)2011-2012学年福建省福州文博中学高二下学期期中考试化学试卷(已下线)2011-2012学年江西省南昌三中高二上学期期中考试化学试卷(已下线)2012-2013年江苏南京学大教育专修学校高二3月月考化学试卷(已下线)2013-2014学年湖北省武汉市部分学校高二上学期期末考试化学试卷(已下线)2014-2015学年湖北鄂州市泽林镇泽林中学高二上第一次月考化学试卷2015-2016学年四川省宜宾市第三中学高二上学期期中测试化学试卷2015-2016学年安徽省铜陵一中高二上期中测试化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷2016届内蒙古鄂尔多斯市第三中学高三上学期第四次考试化学试卷2016-2017学年河北冀州市中学高二上开学调研化学卷2016-2017学年西藏拉萨中学高二上第一次月考化学试卷2016-2017学年辽宁省盘锦高中高二上期中化学卷【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期期中考试化学试题河南省洛阳市2018-2019学年高二第一学期期中考试化学试题湖北省荆门市龙泉中学、巴东一中2019-2020学年高二10月联考化学试题
名校
5 . 在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是A.图 表示温度对平衡的影响,且甲温度较高 表示温度对平衡的影响,且甲温度较高 |
B.图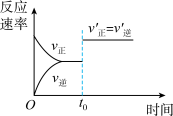 表示t0时刻恒容充入He(g) 表示t0时刻恒容充入He(g) |
C.图 表示t0时刻增大O2的浓度对反应速率的影响 表示t0时刻增大O2的浓度对反应速率的影响 |
D.图 中a点v正 > v逆 中a点v正 > v逆 |
您最近半年使用:0次
2019-10-12更新
|
978次组卷
|
11卷引用:新疆奎屯市第一高级中学2023-2024学年高二上学期期中考试化学试题
新疆奎屯市第一高级中学2023-2024学年高二上学期期中考试化学试题甘肃省兰州市第一中学2019-2020学年高二9月月考化学试题黑龙江省宾县一中2019-2020学年高二上学期第二次月考化学试题河北省衡水市深州市中学2019-2020学年高二下学期期中考试化学试题江西省奉新县第一中学2020-2021学年高二上学期第二次月考化学试题湖南省常德市二中2020-2021学年高二上学期期中考试化学试题吉林省白山市抚松县第五中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨市德强学校2022-2023学年高二上学期期末考试化学试题黑龙江省鹤岗市第一中学2022-2023学年高二上学期11月期中考试化学试题河南省信阳市第二高级中学2023-2024学年高二上学期10月阶段测试化学试题黑龙江省哈尔滨市第四中学校2023-2024学年高二上学期11月月考化学试题
名校
6 . 在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g) 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )

 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
| A.由图可知:T1>T2 |
| B.a、b两点的反应速率:b>a |
| C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法 |
| D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
您最近半年使用:0次
2019-08-25更新
|
422次组卷
|
4卷引用:新疆乌鲁木齐市第八中学2018-2019学年高二上学期期中考试化学试题
名校
解题方法
7 . 在一定体积的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g) xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴是指
xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴是指
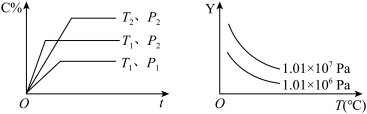
①反应物A的转化率,②平衡混合气中物质B的百分含量,
③平衡混合气的密度,④平衡混合气的平均摩尔质量
 xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴是指
xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴是指
①反应物A的转化率,②平衡混合气中物质B的百分含量,
③平衡混合气的密度,④平衡混合气的平均摩尔质量
| A.①③ | B.②③ | C.③④ | D.①④ |
您最近半年使用:0次
2019-01-30更新
|
487次组卷
|
6卷引用:新疆维吾尔自治区喀什第二中学2022-2023学年高二上学期1月期末考试化学试题
名校
8 . T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
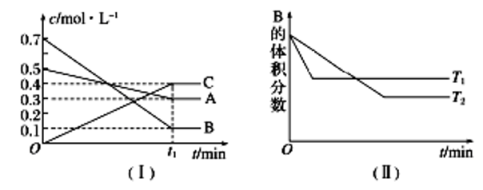
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为________ ,正反应为_____ (填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有______ (填字母序号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度

根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
您最近半年使用:0次
2018-10-27更新
|
197次组卷
|
9卷引用:新疆自治区阿克苏地区库车县伊西哈拉镇中学2018-2019学年高二上学期期中考试化学试题
新疆自治区阿克苏地区库车县伊西哈拉镇中学2018-2019学年高二上学期期中考试化学试题(已下线)2013-2014学年天津市和平区高二上学期期末考试化学试卷湖南省娄底市第四中学2018-2019学年高二上学期10月月考化学试题安徽省砀山县第二中学2019-2020学年高二10月月考化学试题湖南省株洲市茶陵县第三中学2019-2020学年高二上学期期中考试化学(选考)试题重庆市北碚区2019-2020学年高二11月联合性测试化学试题(已下线)第10单元 化学反应速率与化学平衡(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷四川省苍溪实验中学校2020-2021学年高二上学期期中质量检测化学试题湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题
名校
9 . 在一定温度下的可逆反应:mA(g)+nB(g) pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是
pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是
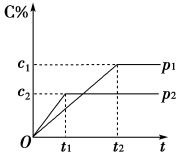
①p1>p2 ②p1<p2 ③m+n>p+q ④m+n=p+q ⑤m+n<p+q
 pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是
pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是
①p1>p2 ②p1<p2 ③m+n>p+q ④m+n=p+q ⑤m+n<p+q
| A.②③ | B.①③ | C.②⑤ | D.①④ |
您最近半年使用:0次
2018-09-30更新
|
738次组卷
|
13卷引用:新疆哈密市第八中学2022-2023学年高二上学期期中考试化学试题
新疆哈密市第八中学2022-2023学年高二上学期期中考试化学试题(已下线)2018年9月16日 《每日一题》人教选修4-每周一测【全国百强校】内蒙古自治区集宁一中2018-2019学年高二上学期第一次阶段测试化学试题黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期9月月考化学试题【全国百强校】吉林省实验中学2018-2019学年高二上学期期中考试化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡 教材帮江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题广东省揭阳市揭西县河婆中学2020-2021学年高二上学期第二次月考化学试题吉林省长岭县第三中学2021-2022学年高二上学期第一次考试化学试题上海市七宝中学2022-2023学年高二上学期10月阶段测试化学试题
名校
10 . 对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,如图所示
pC(g)+qD(g),A的百分含量与温度(T)的变化情况,如图所示
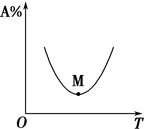
下列说法不正确的是
 pC(g)+qD(g),A的百分含量与温度(T)的变化情况,如图所示
pC(g)+qD(g),A的百分含量与温度(T)的变化情况,如图所示
下列说法不正确的是
| A.M点前速率v正>v逆 |
| B.该反应为吸热反应 |
| C.M点速率v正=v逆 |
| D.M点以后均为平衡状态 |
您最近半年使用:0次
2018-04-09更新
|
252次组卷
|
3卷引用:新疆自治区生产建设兵团第一师高级中学2018-2019学年高二上学期第二次月考化学试题



