名校
解题方法
1 . 研究含有一个碳原子物质的化学称为“一碳”化学。
(1)已知:HCHO(g)+H2(g)=CH3OH(g) ΔH1= - 84kJ·mol-1
CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2= - 49.5 kJ·mol-1
则反应CO2(g)+2H2(g)=HCHO(g)+H2O(g) ΔH3=___________ kJ·mol-1
(2)工业上合成甲醇的反应: CO(g)+ 2H2(g) CH3OH(g) ΔH4,在一个密闭容器中,充入lmolCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图1所示。
CH3OH(g) ΔH4,在一个密闭容器中,充入lmolCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图1所示。
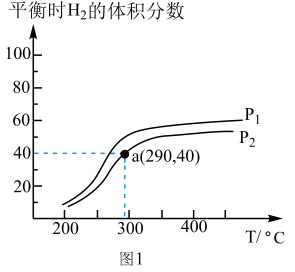
①压强P1___________ P2(填“大于”或“小于”)。
②a点条件下,H2的平衡转化率为___________ ,该温度下达到平衡后,在容积不变的条件下再充入 mol CO和
mol CO和 mol CH3OH,平衡
mol CH3OH,平衡___________ (填“正向” “逆向”或“不”)移动,新平衡时的逆反应速率___________ (填“大于” “等于”或“小于”)原平衡。
(3)由甲醇制烯烃:主反应(2CH3OH C2H4+2H2O、3CH3OH
C2H4+2H2O、3CH3OH C3H6+3H2O)、 副反应:2CH3OH
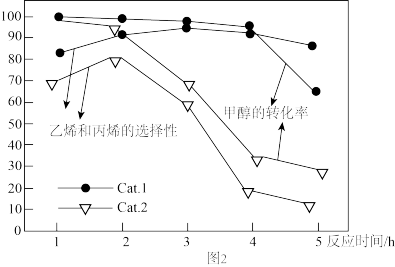
C3H6+3H2O)、 副反应:2CH3OH CH3OCH3+H2O。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat。1和Cat。2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到有关实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比) 如图2所示。结果较好的是
CH3OCH3+H2O。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat。1和Cat。2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到有关实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比) 如图2所示。结果较好的是___________ (填“Cat.1”、或“Cat.2”)。使用Cat。2反应2h后甲醇的转化率与乙烯和丙烯的选择性均明显下降,可能的原因是___________ (结合碰撞理论解释)。
(4)工业上用甲醇可以制备甲胺(CH3NH2),甲胺与氨相似。则甲胺在水中的电离方程式为___________ ,常温下,反应CH3NH2·H2O(aq)+H+(aq) CH3NH
CH3NH (aq)+ H2O(1)的平衡常数K=2.5×104,该温度下,甲胺的电离常数Kb=
(aq)+ H2O(1)的平衡常数K=2.5×104,该温度下,甲胺的电离常数Kb=___________ (填数值)。
(1)已知:HCHO(g)+H2(g)=CH3OH(g) ΔH1= - 84kJ·mol-1
CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2= - 49.5 kJ·mol-1
则反应CO2(g)+2H2(g)=HCHO(g)+H2O(g) ΔH3=
(2)工业上合成甲醇的反应: CO(g)+ 2H2(g)
 CH3OH(g) ΔH4,在一个密闭容器中,充入lmolCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图1所示。
CH3OH(g) ΔH4,在一个密闭容器中,充入lmolCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图1所示。
①压强P1
②a点条件下,H2的平衡转化率为
 mol CO和
mol CO和 mol CH3OH,平衡
mol CH3OH,平衡(3)由甲醇制烯烃:主反应(2CH3OH
 C2H4+2H2O、3CH3OH
C2H4+2H2O、3CH3OH C3H6+3H2O)、 副反应:2CH3OH
C3H6+3H2O)、 副反应:2CH3OH CH3OCH3+H2O。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat。1和Cat。2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到有关实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比) 如图2所示。结果较好的是
CH3OCH3+H2O。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat。1和Cat。2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到有关实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比) 如图2所示。结果较好的是
(4)工业上用甲醇可以制备甲胺(CH3NH2),甲胺与氨相似。则甲胺在水中的电离方程式为
 CH3NH
CH3NH (aq)+ H2O(1)的平衡常数K=2.5×104,该温度下,甲胺的电离常数Kb=
(aq)+ H2O(1)的平衡常数K=2.5×104,该温度下,甲胺的电离常数Kb=
您最近半年使用:0次
2023-05-18更新
|
211次组卷
|
2卷引用:天津市和平区2023届高三下学期三模化学试题
名校
2 . 在体积为2L的恒容密闭容器中发生反应 ,图Ⅰ表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
,图Ⅰ表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
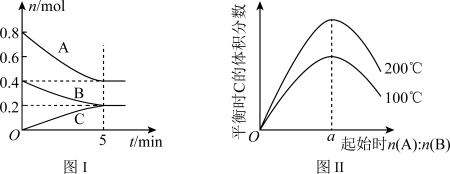
 ,图Ⅰ表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
,图Ⅰ表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
A.200℃时,反应从开始到平衡的平均速率 |
B.图Ⅱ所知反应 的△H>0,且a=2 的△H>0,且a=2 |
| C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| D.200℃时,向容器中充入2molA和1molB,达到平衡时,A的体积分数小于0.5 |
您最近半年使用:0次
2023-02-22更新
|
294次组卷
|
2卷引用:天津西青区2022-2023学年高三上学期期末考试化学试题
名校
解题方法
3 . 根据下列图像填空
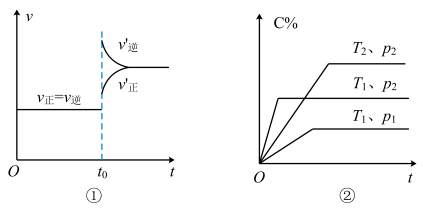
(1)图①反应为: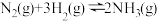 △H<0,t0时改变的条件是
△H<0,t0时改变的条件是_______
(2)图②反应为: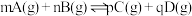 则,T1
则,T1_______ T2,ΔH_______ 0,P1_______ P2,m+n_______ p+q(填“>”、“<”或“=”)

(1)图①反应为:
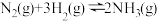 △H<0,t0时改变的条件是
△H<0,t0时改变的条件是(2)图②反应为:
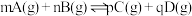 则,T1
则,T1
您最近半年使用:0次
名校
4 . 已知某可逆反应mA(g)+ nB(g) p C(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
p C(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是

 p C(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
p C(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
| A.T1<T2、P1>P2、m+n>P,ΔH <0 |
| B.T1>T2、P1<P2、m+n<P,ΔH >0 |
| C.T1<T2、P1>P2、m+n<P,ΔH <0 |
| D.T1>T2、P1<P2、m+n>P,ΔH >0 |
您最近半年使用:0次
2022-12-21更新
|
1060次组卷
|
34卷引用:天津市南仓中学2022-2023学年高二上学期1月期末考试化学试题
天津市南仓中学2022-2023学年高二上学期1月期末考试化学试题广东省阳东广雅学校2017-2018学年高二11月月考化学试题广西壮族自治区百色市田阳高中2019-2020学年高二上学期12月月考理科综合化学试题四川省资阳市2019-2020学年高二上学期期末质量检测化学试题黑龙江省鹤岗市第一中学2019-2020学年高一下学期期末考试化学试题(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练(已下线)第2章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河南省洛阳市孟津县第二高级中学2020-2021学年高二上学期9月月考化学试题(已下线)【南昌新东方】6. 南昌十七中 颜毅吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题西藏自治区拉萨市第二高级中学2019-2020学年高二上学期期末考试化学试题甘肃省会宁县第一中学2020-2021学年高二上学期期中考试化学(理)试题河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题广东省梅州市2020-2021学年高二上学期第二次质检考试化学试题四川省射洪中学校2020-2021学年高二上学期第三次月考化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题山西省沁源县第一中学2020-2021学年高二下学期开学考试化学试题河南省许昌市第三中学2020-2021学年高二3月月考化学试题江西省赣州市信丰中学2020-2021学年高二上学期入学考试化学试题(已下线)专题讲座(五)反应速率、平衡图像题解题策略(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题湖北省襄阳市南漳县第二中学2021-2022学年高二上学期10月考化学试题广东省执信中学番禺附属学校2021-2022学年高二上学期期中考试化学试题吉林省辉南县第一中学2021-2022学年高二上学期第三次月考化学试题江西省丰城市第九中学2022-2023学年高二上学期入学质量检测化学试题河南省洛阳市新安县第一高级中学2021-2022学年高二上学期10月月考化学试题陕西省安康市汉滨区五里高级中学2021-2022学年高二上学期期中考试化学试题河南宏力学校2021-2022学年高二上学期期中考试化学试题广西贺州市钟山县钟山中学2020-2021学年高二下学期第三次月考理科化学试题新疆阿克苏市实验中学2022-2023学年高二上学期期末考试化学试题(已下线)第七章 化学反应速率与化学平衡 第44讲 化学反应速率、平衡的常规图像四川省青神中学校2022-2023学年高二下学期3月月考化学试题江西省抚州市2023-2024学年高二上学期学生学业质量监测化学试题江西省新余市第一中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
5 . 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间t(单位为分钟)变化的曲线如图,下列描述正确的是
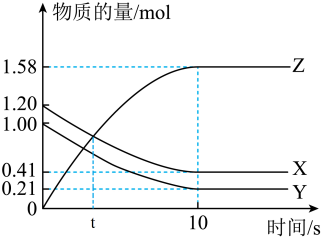

| A.t分钟时该反应达到化学平衡状态 |
B.反应开始到10分钟,用X表示的反应速率为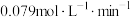 |
| C.反应开始到10分钟时,Y的转化率为79.0% |
D.反应的化学方程式为: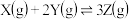 |
您最近半年使用:0次
2022-10-08更新
|
513次组卷
|
6卷引用:天津汇文中学2022-2023学年高二上学期第一次阶段性测试化学试题
名校
解题方法
6 . 某可逆反应:mA(气)+nB(气) pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是
pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是
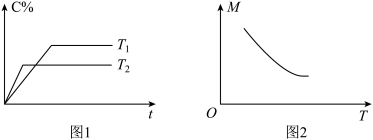
 pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是
pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是
A. , , | B. , , |
C. , , | D. , , |
您最近半年使用:0次
2022-10-08更新
|
535次组卷
|
2卷引用:天津汇文中学2022-2023学年高二上学期第一次阶段性测试化学试题
名校
7 . 某化学小组研究在其他条件不变,改变密闭容器中某一条件对A2(g)+3B2(g)⇌2AB3(g)反应平衡状态的影响,得到下图所示的曲线(图中T表示温度,n表示物质的量),下列说法正确的是
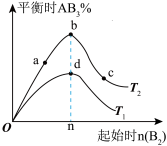

| A.a、b、c三点的平衡状态中,A2的转化率最高的是b点 |
| B.T2温度下,该反应在起始n(A2)一定时达到平衡,AB3的物质的量大小为b > a > c |
| C.T2时,若容器容积为1 L,且只加入反应物,当图中n=3 mol时,反应达到平衡时B2、A2的转化率均为60%,此条件下,反应的平衡常数约为2.08 |
| D.若T2 > T1,则正反应为放热反应 |
您最近半年使用:0次
2022-09-19更新
|
348次组卷
|
2卷引用:天津市实验中学滨海学校2021-2022学年高二上学期期中质量监测化学试题
解题方法
8 . 利用甲烷还原SO2可以减轻环境污染,实现硫的回收。
已知:①甲烷的燃烧热为890kJ•mol﹣1;
②S(s)+O2(g)=SO2(g)△H=﹣216kJ•mol﹣1
③H2O(1)=H2O(g)△H=+44kJ•mol﹣1
(1)CH4(g)+2SO2(g) 2S(s)+CO2(g)+2H2O(g) △H=
2S(s)+CO2(g)+2H2O(g) △H=___________ 。
(2)某温度下,向容积为2L的密闭容器中充入1.0molCH4和2.0molSO2,发生反应CH4(g)+2SO2(g) 2S(s)+CO2(g)+2H2O(g),CH4、CO2、SO2的物质的量随反应时间的变化情况如图所示。
2S(s)+CO2(g)+2H2O(g),CH4、CO2、SO2的物质的量随反应时间的变化情况如图所示。
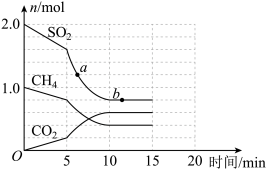
①反应开始至达到平衡时,平均反应速率v(H2O)=___________ ;该温度下,该反应的平衡常数K=___________ 。
②5min时,改变的外界条件可能是___________ (填字母)。
A.升高温度 B.降低温度 C.加入催化剂 D.充入CH4(g)
③a、b点的逆反应速率:V逆(a)___________ (填“大于”、“小于”或“等于”)V逆(b),原因是 ___________ 。
(3)一定温度下,向某密容器中充入一定量的CH4和SO2发生反应CH4(g)+2SO2(g) 2S(s)+CO2(g)+2H2O(g)。
2S(s)+CO2(g)+2H2O(g)。
①若该容器容积恒定,则下列物理量不再改变时,一定能说明反应达到平衡状态的是___________ (填字母)。
A.m(S) B. C.CH4和CO2的浓度之和 D.容器中气体的密度
C.CH4和CO2的浓度之和 D.容器中气体的密度
②该温度下,欲提高SO2的平衡转化率,可采取的措施有___________ (任答两条,下同);欲缩短反应达到平衡所需的时间,可采取的措施有 ___________ 。
已知:①甲烷的燃烧热为890kJ•mol﹣1;
②S(s)+O2(g)=SO2(g)△H=﹣216kJ•mol﹣1
③H2O(1)=H2O(g)△H=+44kJ•mol﹣1
(1)CH4(g)+2SO2(g)
 2S(s)+CO2(g)+2H2O(g) △H=
2S(s)+CO2(g)+2H2O(g) △H=(2)某温度下,向容积为2L的密闭容器中充入1.0molCH4和2.0molSO2,发生反应CH4(g)+2SO2(g)
 2S(s)+CO2(g)+2H2O(g),CH4、CO2、SO2的物质的量随反应时间的变化情况如图所示。
2S(s)+CO2(g)+2H2O(g),CH4、CO2、SO2的物质的量随反应时间的变化情况如图所示。
①反应开始至达到平衡时,平均反应速率v(H2O)=
②5min时,改变的外界条件可能是
A.升高温度 B.降低温度 C.加入催化剂 D.充入CH4(g)
③a、b点的逆反应速率:V逆(a)
(3)一定温度下,向某密容器中充入一定量的CH4和SO2发生反应CH4(g)+2SO2(g)
 2S(s)+CO2(g)+2H2O(g)。
2S(s)+CO2(g)+2H2O(g)。①若该容器容积恒定,则下列物理量不再改变时,一定能说明反应达到平衡状态的是
A.m(S) B.
 C.CH4和CO2的浓度之和 D.容器中气体的密度
C.CH4和CO2的浓度之和 D.容器中气体的密度②该温度下,欲提高SO2的平衡转化率,可采取的措施有
您最近半年使用:0次
名校
解题方法
9 . 2022年2月在北京举办了冬季奥运会,冬奥会奖牌是金镶玉材料,而玉的成分是硅酸盐和二氧化硅,回答下面问题:
(1)向硅酸钠溶液中通入少量CO2,生成一种凝胶硅酸,写出反应的离子方程式:_______ 。
(2)工业上可以用CO2来生产甲醇(CH3OH)燃料。在体积为2 L的密闭容器中,充入1 molCO2和3 mol H2,一定条件下发生反应CO2(g) +3H2(g) CH3OH(g) +H2O(g)。测得CH3OH和CO2的物质的量随时间变化如图所示:
CH3OH(g) +H2O(g)。测得CH3OH和CO2的物质的量随时间变化如图所示:
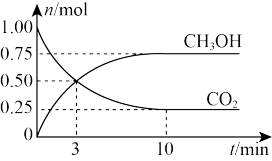
①反应开始到10 min, 用CO2表示的反应速率为。_______
②达到平衡时,H2的转化率为_______
③达到平衡后,下列措施中,能使正反应速率增大的有_______ (填字母)。
A.充入一定量CO2 B.充入一定量的Ar
C.改用催化效率更高的催化剂 D.容器体积扩大至原来2倍
(3)北京冬奥会基本实现100%绿电供应和碳中和,利用CO2和H2在光催化酶作用下可以高效合成甲醇。
①写出甲醇燃烧的化学方程式:_______ ;
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:

a电极是_______ 极,将上图中的H2改为甲醇就构成了碱性甲醇燃料电池,a电极发生的电极反应式是_______ 。
(1)向硅酸钠溶液中通入少量CO2,生成一种凝胶硅酸,写出反应的离子方程式:
(2)工业上可以用CO2来生产甲醇(CH3OH)燃料。在体积为2 L的密闭容器中,充入1 molCO2和3 mol H2,一定条件下发生反应CO2(g) +3H2(g)
 CH3OH(g) +H2O(g)。测得CH3OH和CO2的物质的量随时间变化如图所示:
CH3OH(g) +H2O(g)。测得CH3OH和CO2的物质的量随时间变化如图所示:
①反应开始到10 min, 用CO2表示的反应速率为。
②达到平衡时,H2的转化率为
③达到平衡后,下列措施中,能使正反应速率增大的有
A.充入一定量CO2 B.充入一定量的Ar
C.改用催化效率更高的催化剂 D.容器体积扩大至原来2倍
(3)北京冬奥会基本实现100%绿电供应和碳中和,利用CO2和H2在光催化酶作用下可以高效合成甲醇。
①写出甲醇燃烧的化学方程式:
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:

a电极是
您最近半年使用:0次
2022-05-24更新
|
132次组卷
|
2卷引用:天津市宝坻区第一中学2022-2023学年高一下学期阶段练习四化学试题
解题方法
10 . 由环境保护部、国家质检总局发布的《轻型汽车污染物排放限值及测量方法(中国第六阶段)》,自2020年7月1日起实施,也就是大家熟知的国Ⅵ汽车排放标准。在我国汽车产能过剩的背景下,可以起到淘汰落后产能、引领产业升级的作用,同时能够满足重点地区为加快改善环境空气质量而提高汽车排放标准的要求。回答以下问题:
(1)已知在20℃时:
① 正、逆反应的活化能分别为m kJ/mol、n kJ/mol;
正、逆反应的活化能分别为m kJ/mol、n kJ/mol;
② 正、逆反应的活化能分别为p kJ/mol、q kJ/mol。
正、逆反应的活化能分别为p kJ/mol、q kJ/mol。
用NH3处理汽车尾气中的NO的反应为: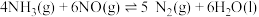 ,该反应的△H=
,该反应的△H=_______ 。
(2)模拟汽车的“催化转化器”,将4 mol NO(g)和4 mol CO(g)充入1 L的密闭容器中,在不同温度和压强下发生反应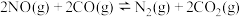 ,测得CO的平衡转化率α随温度T变化曲线如图所示。图象中C点逆反应速率
,测得CO的平衡转化率α随温度T变化曲线如图所示。图象中C点逆反应速率_______ B点正反应速率(填“>”“=”或“<”,下同);反应的平衡常数:A点_______ D点。实验测得: ,
,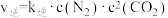 ,k正、k逆分别是正、逆反应速率常数。则T1℃时C点处对应的v正:v逆=
,k正、k逆分别是正、逆反应速率常数。则T1℃时C点处对应的v正:v逆=_______ 。

(3)汽车排气管装有三元催化装置,在催化剂表面发生吸附、解吸消除CO、NO等大气污染物。反应机理如下(Pt是催化剂,右上角带“*”表示吸附状态):
Ⅰ.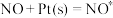 Ⅱ.
Ⅱ.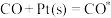 Ⅲ.
Ⅲ.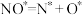
Ⅳ. Ⅴ.
Ⅴ. Ⅵ.
Ⅵ.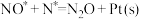
经测定汽车尾气中生成物及反应物浓度随温度变化关系如图1和图2所示:
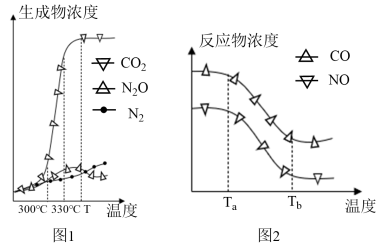
①图1中,温度为330℃时反应V的活化能_______ 反应VI的活化能(填“<”、“>”或“=”),反应VI的焓变△H_______ 0(“<”或“>”)。
②图2中,温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是_______ 。
(1)已知在20℃时:
①
 正、逆反应的活化能分别为m kJ/mol、n kJ/mol;
正、逆反应的活化能分别为m kJ/mol、n kJ/mol;②
 正、逆反应的活化能分别为p kJ/mol、q kJ/mol。
正、逆反应的活化能分别为p kJ/mol、q kJ/mol。用NH3处理汽车尾气中的NO的反应为:
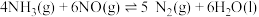 ,该反应的△H=
,该反应的△H=(2)模拟汽车的“催化转化器”,将4 mol NO(g)和4 mol CO(g)充入1 L的密闭容器中,在不同温度和压强下发生反应
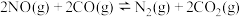 ,测得CO的平衡转化率α随温度T变化曲线如图所示。图象中C点逆反应速率
,测得CO的平衡转化率α随温度T变化曲线如图所示。图象中C点逆反应速率 ,
,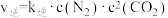 ,k正、k逆分别是正、逆反应速率常数。则T1℃时C点处对应的v正:v逆=
,k正、k逆分别是正、逆反应速率常数。则T1℃时C点处对应的v正:v逆=
(3)汽车排气管装有三元催化装置,在催化剂表面发生吸附、解吸消除CO、NO等大气污染物。反应机理如下(Pt是催化剂,右上角带“*”表示吸附状态):
Ⅰ.
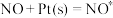 Ⅱ.
Ⅱ.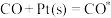 Ⅲ.
Ⅲ.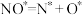
Ⅳ.
 Ⅴ.
Ⅴ. Ⅵ.
Ⅵ.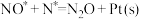
经测定汽车尾气中生成物及反应物浓度随温度变化关系如图1和图2所示:

①图1中,温度为330℃时反应V的活化能
②图2中,温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是
您最近半年使用:0次
2022-05-18更新
|
192次组卷
|
2卷引用:天津市和平区2023-2024学年高三上学期期末质量调查化学试卷



