解题方法
1 . 聚丙烯是生产N95口罩和医用无纺布口罩防护服材料,而丙烯是制造聚丙烯的单体。工业上,生成丙烯的方法有多种。
Ⅰ.以异丙醇为原料制备丙烯。已知:
①
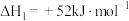 ;
;
②
 ;
;
③
 。
。
(1) 为
为___________  。
。
(2)反应③在___________ (填“较高”“较低”或“任意”)温度下能自发进行。
Ⅱ.近日,中国石油大学(华东)代鹏程副教授课题组开发富含硼氧活性位点的热稳定层柱状框架类材料助力丙烷氧化脱氢。有关反应如下:
反应1: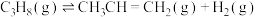

反应2: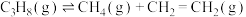
 。
。
(3)向密闭反应器中充入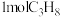 ,发生上述反应1,测得平衡时的丙烯的体积分数与温度、压强的关系如图1所示。
,发生上述反应1,测得平衡时的丙烯的体积分数与温度、压强的关系如图1所示。
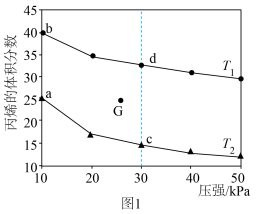
①其他条件相同,增大压强,丙烯体积分数减小的原因是___________ 。
②已知G点为某条件下的平衡状态,若将G点对应反应容器降温同时缩小容器体积使体系压强增大,重新达到平衡状态可能是图中a、b、c、d中的___________ 点。
③下列物理量中,图中c点大于d点的是___________ (填字母)。
A.正反应速率 B.对应温度的平衡常数 C.逆反应速率 D.平均摩尔质量
(4)一定温度下,若向密闭反应器中充入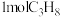 ,发生上述两个反应,达到平衡时,丙烯的体积分数为
,发生上述两个反应,达到平衡时,丙烯的体积分数为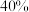 ,丙烯、乙烯体积之比为
,丙烯、乙烯体积之比为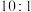 ,丙烷的平衡转化率为
,丙烷的平衡转化率为___________ (用百分数表示,结果保留3位有效数字)。
(5)一定温度下,总压保持为 时,向反应器中充入
时,向反应器中充入 和
和 ,发生上述两个反应。测得丙烷平衡转化率与投料比
,发生上述两个反应。测得丙烷平衡转化率与投料比 的关系如图2所示。
的关系如图2所示。
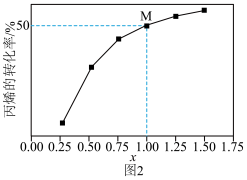
①向反应器充入 的目的是
的目的是___________ 。
②该温度下, 点丙烯的选择性为
点丙烯的选择性为 ,此时反应1的平衡常数
,此时反应1的平衡常数 为
为___________ 。
提示:(i)用分压计算的平衡常数为 ,分压
,分压 总压
总压 物质的量分数;(ii)丙烯的选择性
物质的量分数;(ii)丙烯的选择性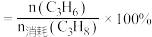 。
。
Ⅰ.以异丙醇为原料制备丙烯。已知:
①

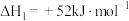 ;
;②

 ;
;③

 。
。(1)
 为
为 。
。(2)反应③在
Ⅱ.近日,中国石油大学(华东)代鹏程副教授课题组开发富含硼氧活性位点的热稳定层柱状框架类材料助力丙烷氧化脱氢。有关反应如下:
反应1:
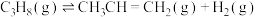

反应2:
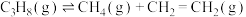
 。
。(3)向密闭反应器中充入
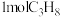 ,发生上述反应1,测得平衡时的丙烯的体积分数与温度、压强的关系如图1所示。
,发生上述反应1,测得平衡时的丙烯的体积分数与温度、压强的关系如图1所示。
①其他条件相同,增大压强,丙烯体积分数减小的原因是
②已知G点为某条件下的平衡状态,若将G点对应反应容器降温同时缩小容器体积使体系压强增大,重新达到平衡状态可能是图中a、b、c、d中的
③下列物理量中,图中c点大于d点的是
A.正反应速率 B.对应温度的平衡常数 C.逆反应速率 D.平均摩尔质量
(4)一定温度下,若向密闭反应器中充入
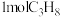 ,发生上述两个反应,达到平衡时,丙烯的体积分数为
,发生上述两个反应,达到平衡时,丙烯的体积分数为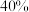 ,丙烯、乙烯体积之比为
,丙烯、乙烯体积之比为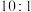 ,丙烷的平衡转化率为
,丙烷的平衡转化率为(5)一定温度下,总压保持为
 时,向反应器中充入
时,向反应器中充入 和
和 ,发生上述两个反应。测得丙烷平衡转化率与投料比
,发生上述两个反应。测得丙烷平衡转化率与投料比 的关系如图2所示。
的关系如图2所示。
①向反应器充入
 的目的是
的目的是②该温度下,
 点丙烯的选择性为
点丙烯的选择性为 ,此时反应1的平衡常数
,此时反应1的平衡常数 为
为提示:(i)用分压计算的平衡常数为
 ,分压
,分压 总压
总压 物质的量分数;(ii)丙烯的选择性
物质的量分数;(ii)丙烯的选择性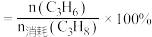 。
。
您最近半年使用:0次
名校
解题方法
2 . 反应
 ,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
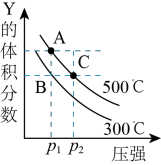

 ,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是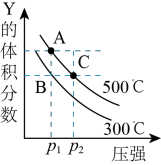
A.该反应的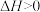 | B.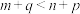 |
C.B、C两点化学平衡常数: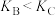 | D.A、C两点的反应速率 |
您最近半年使用:0次
2024-03-07更新
|
178次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
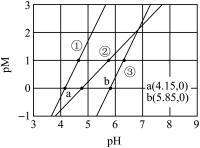
3 . 常温下,向含有CH3COOH、CuSO4、FeSO4的工业废水中逐滴加入NaOH溶液,pM随pH变化关系如图所示[pM表示 或
或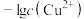 或
或 ],曲线①③斜率相同。已知:
],曲线①③斜率相同。已知: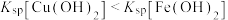 ;当离子浓度
;当离子浓度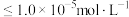 时,可认为该离子沉淀完全。下列说法不正确的是
时,可认为该离子沉淀完全。下列说法不正确的是
 或
或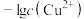 或
或 ],曲线①③斜率相同。已知:
],曲线①③斜率相同。已知: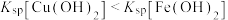 ;当离子浓度
;当离子浓度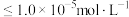 时,可认为该离子沉淀完全。下列说法不正确的是
时,可认为该离子沉淀完全。下列说法不正确的是
A.曲线①表示 与pH的关系 与pH的关系 |
B.pH=6时,溶液中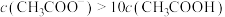 |
C.pH=7时,可认为 沉淀完全 沉淀完全 |
D.pH=8时 |
您最近半年使用:0次
2023-12-01更新
|
417次组卷
|
5卷引用:江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题
江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题河北省沧州市部分高中2023-2024学年高三上学期11月期中考试化学试题(已下线)寒假作业07 沉淀溶解平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)(已下线)选择题11-15安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题
4 . 下列图示与对应的叙述相符的是
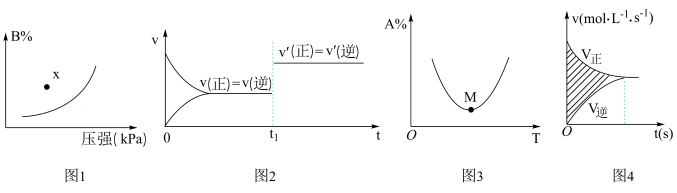

A.图1表示反应;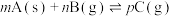 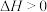 ,在一定温度下B的百分含量与压强变化的关系,则x点正反应速率小于逆反应速率 ,在一定温度下B的百分含量与压强变化的关系,则x点正反应速率小于逆反应速率 |
B.图2是可逆反应 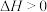 的速率-时间图像,则在 的速率-时间图像,则在 时刻改变的条件只能是加入催化剂 时刻改变的条件只能是加入催化剂 |
C.图3表示反应 ,A的百分含量与温度(T)的变化情况,则该反应的 ,A的百分含量与温度(T)的变化情况,则该反应的 |
| D.图4所示阴影部分面积的含义是该物质物质的量的变化量 |
您最近半年使用:0次
2023-11-28更新
|
132次组卷
|
2卷引用:江西省上饶市广信二中2023-2024学年高二上学期期中考试化学试卷
名校
5 . 对于可逆反应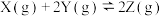
 ,下列图像中正确的是
,下列图像中正确的是
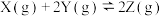
 ,下列图像中正确的是
,下列图像中正确的是 | 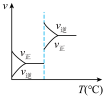 |  | 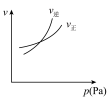 |
| A.反应体系中X的体积分数与时间的关系图 | B.正逆反应速率与温度的关系图 | C.不同温度下X的转化率与时间的关系图 | D.正逆反应速率与压强的关系图 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-11-12更新
|
193次组卷
|
3卷引用:江西省上饶市第一中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
6 . Ⅰ.工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
请回答下列问题:
(1)反应①是___________ (填“吸热”或“放热”)反应
(2)据反应①与反应②可推导出K1、K2与K3之间的关系,则K3=___________ (用K1、K2表示)
(3)某温度下反应①式中各物质的平衡浓度符合下式: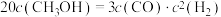 ,试判断此时的温度为
,试判断此时的温度为___________ 。
(4)若500℃时,在2L密闭容器中加入2molH2和amolCO2进行②的反应,反应5min后达到平衡,平衡时CO2的转化率为40%,求a=___________ mol,用H2表示该反应达到平衡时的平均反应速率v(H2)=___________ ,平衡时CO在混合气体中的体积分数为___________ 。
Ⅱ.工业合成氨是人类科学技术的一项重大突破。其合成原理为:
(5)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:
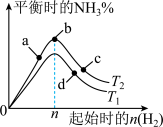
①图像中T1和T2的关系是:T1___________ T2(填“>”、“<”或“=”)。
②a、b、c三点所处的平衡状态中,反应物N2的转化率最高的点是:___________ 。
③图像中最高点b对应的起始时投入的H2和N2的物质的量之比为:___________ 。
④合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是___________ 。(答出一条即可)
(6)在一定温度和催化剂的条件下,将0.1molNH3通入3L的密闭容器中进行反应 (此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
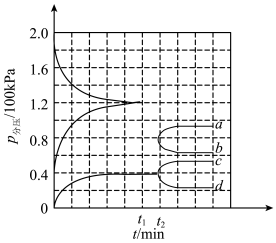
t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示)。
| 化学反应 | 平衡常数 | 温度 | ||
| 500℃ | 700℃ | 800℃ | ||
① | K1 | 2.5 | 0.34 | 0.15 |
② | K2 | 1 | 1.7 | 2.52 |
③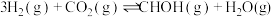 | K3 | |||
(1)反应①是
(2)据反应①与反应②可推导出K1、K2与K3之间的关系,则K3=
(3)某温度下反应①式中各物质的平衡浓度符合下式:
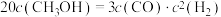 ,试判断此时的温度为
,试判断此时的温度为(4)若500℃时,在2L密闭容器中加入2molH2和amolCO2进行②的反应,反应5min后达到平衡,平衡时CO2的转化率为40%,求a=
Ⅱ.工业合成氨是人类科学技术的一项重大突破。其合成原理为:
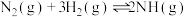
(5)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:

①图像中T1和T2的关系是:T1
②a、b、c三点所处的平衡状态中,反应物N2的转化率最高的点是:
③图像中最高点b对应的起始时投入的H2和N2的物质的量之比为:
④合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是
(6)在一定温度和催化剂的条件下,将0.1molNH3通入3L的密闭容器中进行反应
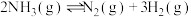 (此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
您最近半年使用:0次
2023-11-11更新
|
0次组卷
|
2卷引用:江西省广丰中学2023-2024学年高二上学期10月月考化学试题
解题方法
7 . 下列叙述与对应的图示相符合的是
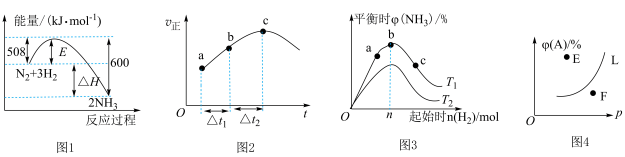

A.图1为 反应过程中的能量变化图,利用勒夏特列原理能解释工业上选择 反应过程中的能量变化图,利用勒夏特列原理能解释工业上选择 左右合成氨比室温更有利 左右合成氨比室温更有利 |
B.图2为在绝热恒容密闭容器中通入 和 和 ,反应 ,反应 的 的 图,由图可知该反应为放热反应 图,由图可知该反应为放热反应 |
C.图3为合成氨反应中,保持其他条件不变,起始时 用量、反应温度对反应的影响图,则图中温度 用量、反应温度对反应的影响图,则图中温度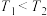 , , 、 、 、 、 三点均处于平衡状态,反应物 三点均处于平衡状态,反应物 的平衡转化率: 的平衡转化率: |
D.图4为反应 平衡时 平衡时 的体积分数与反应压强的关系图,则 的体积分数与反应压强的关系图,则 点: 点: |
您最近半年使用:0次
名校
解题方法
8 . 在起始时向1.0 L恒容密闭容器中加入0.1 mol  、0.2 mol
、0.2 mol  及0.2 mol
及0.2 mol  ,发生反应:
,发生反应: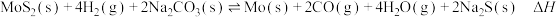 ,测得平衡时气体体积分数与温度的关系如图所示(假设固体物质所占体积忽略不计)。下列说法正确的是
,测得平衡时气体体积分数与温度的关系如图所示(假设固体物质所占体积忽略不计)。下列说法正确的是
 、0.2 mol
、0.2 mol  及0.2 mol
及0.2 mol  ,发生反应:
,发生反应: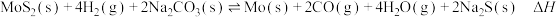 ,测得平衡时气体体积分数与温度的关系如图所示(假设固体物质所占体积忽略不计)。下列说法正确的是
,测得平衡时气体体积分数与温度的关系如图所示(假设固体物质所占体积忽略不计)。下列说法正确的是
A.该反应的 |
| B.曲线b代表生成物CO |
| C.M点与N点的压强之比为15:16 |
D.若保持M点条件不变,再充入 、CO及 、CO及 各0.1 mol,则达平衡前v(正)<v(逆) 各0.1 mol,则达平衡前v(正)<v(逆) |
您最近半年使用:0次
2023-10-12更新
|
280次组卷
|
2卷引用:江西省部分学校2023-2024学年高二上学期10月月考化学试题
名校
解题方法
9 . 利用水煤气合成甲醇的反应原理为: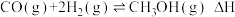 ,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是
,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是

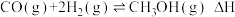 ,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是
,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是
| A.该反应△H<0 |
| B.图中压强的大小关系是a<b<c<d |
| C.CH3OH的体积分数越大,平衡常数越大 |
| D.恒温恒压时,往平衡体系中再充入1mol甲醇,重新平衡后甲醇的体积分数不变 |
您最近半年使用:0次
2023-09-17更新
|
375次组卷
|
4卷引用:江西省宜春市宜丰中学创新部2023-2024学年高三上学期期中考试化学试题
江西省宜春市宜丰中学创新部2023-2024学年高三上学期期中考试化学试题浙江省海宁市高级中学2022-2023学年高二上学期10月月考化学试题2024届河南省郑州市宇华实验学校高三一模化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
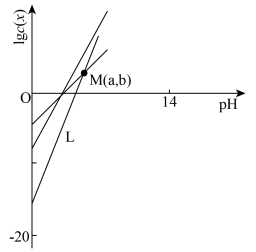
10 . 柠檬酸(H3Cit)是一种重要的三元有机中强酸。常温下,一定pH范围内,存在以下平衡: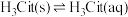 ;
; ;
; ;
;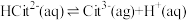 。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
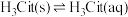 ;
; ;
; ;
;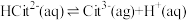 。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
| A.随pH增大,H3Cit(aq)的浓度保持不变 |
| B.直线L表示lgc(H2Cit-)的变化情况 |
C.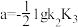 |
| D.pH<a时的某一pH范围内,存在c(HCit2-)>c(H2Cit-)>c(Cit3-) |
您最近半年使用:0次



