23-24高三上·河北沧州·期中
名校
解题方法
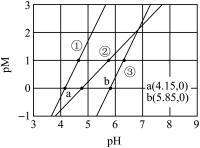
1 . 常温下,向含有CH3COOH、CuSO4、FeSO4的工业废水中逐滴加入NaOH溶液,pM随pH变化关系如图所示[pM表示 或
或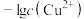 或
或 ],曲线①③斜率相同。已知:
],曲线①③斜率相同。已知: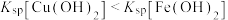 ;当离子浓度
;当离子浓度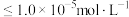 时,可认为该离子沉淀完全。下列说法不正确的是
时,可认为该离子沉淀完全。下列说法不正确的是
 或
或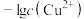 或
或 ],曲线①③斜率相同。已知:
],曲线①③斜率相同。已知: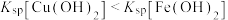 ;当离子浓度
;当离子浓度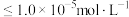 时,可认为该离子沉淀完全。下列说法不正确的是
时,可认为该离子沉淀完全。下列说法不正确的是
A.曲线①表示 与pH的关系 与pH的关系 |
B.pH=6时,溶液中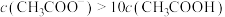 |
C.pH=7时,可认为 沉淀完全 沉淀完全 |
D.pH=8时 |
您最近半年使用:0次
2023-12-01更新
|
417次组卷
|
5卷引用:选择题11-15
(已下线)选择题11-15河北省沧州市部分高中2023-2024学年高三上学期11月期中考试化学试题(已下线)寒假作业07 沉淀溶解平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题
2023·四川巴中·模拟预测
2 . 综合利用含碳资源、促进碳中和在保护生态环境等方面具有重要意义。回答下列问题:
(1)中国科学院在国际上宣布首次实现CO2到淀粉的全合成,其中前两步涉及的反应如图1所示。
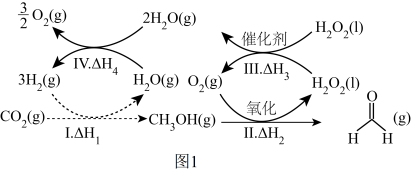
①反应:CO2(g)+2H2(g)=HCHO(g)+H2O(g)△H=_______ (用△H1、△H2、△H3、△H4表示)。
②反应I进行时,同时发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=
C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=_______ 。CH3OH物质的量分数为_______ %(计算结果保留1位小数)。
(2)乙烯是合成工业的重要原料,一定条件下可发生反应:3C2H4(g) 2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
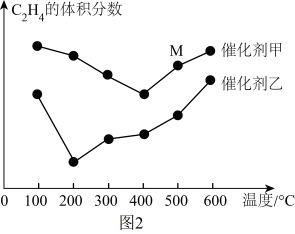
在催化剂甲作用下,图2中M点的速率V正_______ V逆(填“>”“<”或“=”),根据图中所给信息,应选择的反应条件为_______ 。
(3)CO2氧化1-丁烯脱氢生产1,3-丁二烯,其反应原理为:CH2=CHCH2CH3(g)+CO2(g)→CH2=CHCH=CH2(g)+H2O(g)+CO(g)氧化脱氢反应可能的反应路径有两种,如图3所示:
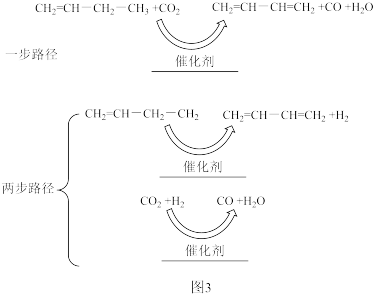
①为确定反应路径,可检测反应体系中的物质是_______ (填化学式)。
②若为“两步路径”,在温度和总压相同时,1-丁烯氧化脱氢的平衡转化率高于直接脱氢的原因是_______ 。
(1)中国科学院在国际上宣布首次实现CO2到淀粉的全合成,其中前两步涉及的反应如图1所示。

①反应:CO2(g)+2H2(g)=HCHO(g)+H2O(g)△H=
②反应I进行时,同时发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=
C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=(2)乙烯是合成工业的重要原料,一定条件下可发生反应:3C2H4(g)
 2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
在催化剂甲作用下,图2中M点的速率V正
(3)CO2氧化1-丁烯脱氢生产1,3-丁二烯,其反应原理为:CH2=CHCH2CH3(g)+CO2(g)→CH2=CHCH=CH2(g)+H2O(g)+CO(g)氧化脱氢反应可能的反应路径有两种,如图3所示:

①为确定反应路径,可检测反应体系中的物质是
②若为“两步路径”,在温度和总压相同时,1-丁烯氧化脱氢的平衡转化率高于直接脱氢的原因是
您最近半年使用:0次
名校
3 . 一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时一定达到平衡状态的是
2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时一定达到平衡状态的是
 2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时一定达到平衡状态的是
2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时一定达到平衡状态的是A. | B.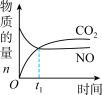 |
C.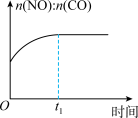 | D. |
您最近半年使用:0次
2023-08-28更新
|
262次组卷
|
4卷引用:吉林省长春市朝阳区长春外国语学校2022-2023学年高二上学期11月期中化学试题
名校
解题方法
4 . 在容积不变的密闭容器中, 和
和 发生反应:
发生反应: 。温度分别为
。温度分别为 和
和 时,
时, 的体积分数
的体积分数 随时间的变化如图所示,下列说法正确的是
随时间的变化如图所示,下列说法正确的是

 和
和 发生反应:
发生反应: 。温度分别为
。温度分别为 和
和 时,
时, 的体积分数
的体积分数 随时间的变化如图所示,下列说法正确的是
随时间的变化如图所示,下列说法正确的是
A.该反应的 |
B.温度为 时, 时, 的平衡转化率为80% 的平衡转化率为80% |
C.加入适当的催化剂,目的是加快反应速率,提高 的产率 的产率 |
D.温度为 时的化学平衡常数 时的化学平衡常数 大于 大于 时的化学平衡常数 时的化学平衡常数 |
您最近半年使用:0次
2023-02-18更新
|
582次组卷
|
13卷引用:吉林省长春市农安县教师进修学校2022-2023学年高二上学期期末考试化学试题
吉林省长春市农安县教师进修学校2022-2023学年高二上学期期末考试化学试题湖南省湖湘名校联盟2021-2022学年高二上学期期末考试化学试题湖南省湘潭县2021-2022学年高二上学期期末考试化学试题(已下线)专题25 关于化学平衡的计算-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)广西玉林市普通高中2021-2022学年高二上学期期末考试理科综合化学试题(已下线)2.2.3 化学反应速率与平衡图像专题 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)广东省江门市培英高级中学2022-2023学年高二上学期期中考试化学试题浙江省金华市横店高中2022-2023学年高二上学期10月份检测化学试题广东省汕尾市2022-2023学年高二上学期期末考试化学试题广东省华南师范大学附属中学2022-2023学年高二上学期期中考试化学试题广东省广州市实验外语学校2023-2024学年高二上学期11月期中考试化学试题广东省广州市第四十一中学2023-2024学年高二上学期期中考试化学试题江西省抚州市2022-2023学年高二上学期学生学业质量监测化学试题
5 . 回答下列问题:
Ⅰ.一定条件下,在容积为 的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
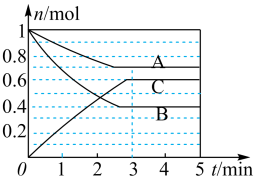
(1)达到平衡后加压,C的含量_______ (填写“变大”“变小”或“不变”)。
(2)该反应的反应速率v随时间t的关系如图所示。
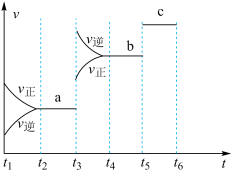
①根据图判断,在 时刻改变的外界条件是
时刻改变的外界条件是_______ 。
②a、b、c对应的平衡状态中,A的转化率最大的是状态_______ 。
Ⅱ.在密闭容器中充入一定量的 ,发生反应
,发生反应
 。如图所示为
。如图所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。

(3)该反应的逆反应是_______ (填“吸热反应”或“放热反应”)。
(4)N点 的体积分数是
的体积分数是_______ 。
(5)M点对应的平衡常数
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅰ.一定条件下,在容积为
 的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
(1)达到平衡后加压,C的含量
(2)该反应的反应速率v随时间t的关系如图所示。

①根据图判断,在
 时刻改变的外界条件是
时刻改变的外界条件是②a、b、c对应的平衡状态中,A的转化率最大的是状态
Ⅱ.在密闭容器中充入一定量的
 ,发生反应
,发生反应
 。如图所示为
。如图所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
(3)该反应的逆反应是
(4)N点
 的体积分数是
的体积分数是(5)M点对应的平衡常数

 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近半年使用:0次
6 . Ⅰ、776年,法国化学家拉瓦锡首次确认了硫元素。自然界天然的硫单质主要存在于火山区,
已知:
ⅰ、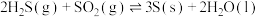
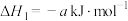
ⅱ、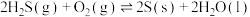
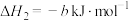 (a、b均大于0)
(a、b均大于0)
(1)根据上述信息,

___________  ;
;
Ⅱ、硫化氢的转化是资源利用和环境保护的重要研究课题。
ⅰ高温热分解法: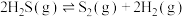

在总压强为120kPa恒压条件下,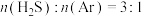 的混合气在不同温度下反应相同时间,测得
的混合气在不同温度下反应相同时间,测得 的体积分数及
的体积分数及 在不同温度下的平衡体积分数如下图所示:
在不同温度下的平衡体积分数如下图所示:
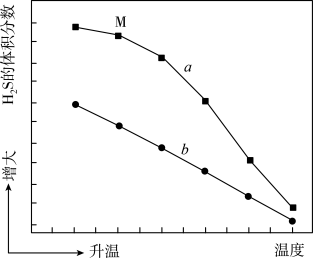
(2)图中表示平衡状态的曲线为___________ (填“a”或“b”)。
(3)下列关于高温热分解法的说法正确的有___________(填标号)。
(4)某温度下,平衡时 的体积分数为20%,则此时Ar的分压是
的体积分数为20%,则此时Ar的分压是___________ kPa;该反应的平衡常数
___________ 。
(5)随温度升高,图中a、b两条曲线逐渐靠近的原因是___________ 。
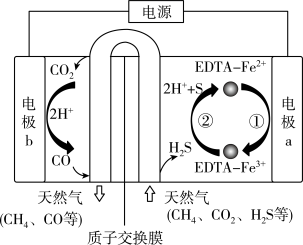
ⅱ电化学法:
(6)我国科学家设计了一种 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,工作原理如图所示。写出在电极b区发生的反应:
的高效去除,工作原理如图所示。写出在电极b区发生的反应:___________ 。
已知:
ⅰ、
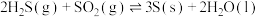
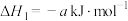
ⅱ、
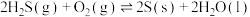
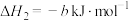 (a、b均大于0)
(a、b均大于0)(1)根据上述信息,


 ;
;Ⅱ、硫化氢的转化是资源利用和环境保护的重要研究课题。
ⅰ高温热分解法:
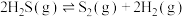

在总压强为120kPa恒压条件下,
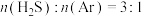 的混合气在不同温度下反应相同时间,测得
的混合气在不同温度下反应相同时间,测得 的体积分数及
的体积分数及 在不同温度下的平衡体积分数如下图所示:
在不同温度下的平衡体积分数如下图所示:
(2)图中表示平衡状态的曲线为
(3)下列关于高温热分解法的说法正确的有___________(填标号)。
| A.图中M点正反应速率大于逆反应速率 |
| B.该反应平衡常数K随温度升高而减小 |
C.该反应平衡常数K随投料比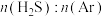 增大而增大 增大而增大 |
D.恒温恒压下,增加Ar的体积分数, 的平衡转化率增大 的平衡转化率增大 |
 的体积分数为20%,则此时Ar的分压是
的体积分数为20%,则此时Ar的分压是
(5)随温度升高,图中a、b两条曲线逐渐靠近的原因是
ⅱ电化学法:
(6)我国科学家设计了一种
 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,工作原理如图所示。写出在电极b区发生的反应:
的高效去除,工作原理如图所示。写出在电极b区发生的反应:
您最近半年使用:0次
名校
7 . NO和 混合后可发生反应:①
混合后可发生反应:① 、②
、② ,反应体系中含氮物质的物质的量浓度c随着时间t的变化曲线如图所示。下列说法正确的是
,反应体系中含氮物质的物质的量浓度c随着时间t的变化曲线如图所示。下列说法正确的是

 混合后可发生反应:①
混合后可发生反应:① 、②
、② ,反应体系中含氮物质的物质的量浓度c随着时间t的变化曲线如图所示。下列说法正确的是
,反应体系中含氮物质的物质的量浓度c随着时间t的变化曲线如图所示。下列说法正确的是
A.c为 随t的变化曲线 随t的变化曲线 |
B. 时, 时, |
C. 时刻, 时刻, 的消耗速率大于生成速率 的消耗速率大于生成速率 |
D. 时,反应①和②均达到化学平衡状态 时,反应①和②均达到化学平衡状态 |
您最近半年使用:0次
名校
8 . 已知某可逆反应mA(g)+ nB(g) p C(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
p C(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是

 p C(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
p C(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
| A.T1<T2、P1>P2、m+n>P,ΔH <0 |
| B.T1>T2、P1<P2、m+n<P,ΔH >0 |
| C.T1<T2、P1>P2、m+n<P,ΔH <0 |
| D.T1>T2、P1<P2、m+n>P,ΔH >0 |
您最近半年使用:0次
2022-12-21更新
|
1060次组卷
|
34卷引用:吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题
吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题吉林省辉南县第一中学2021-2022学年高二上学期第三次月考化学试题广东省阳东广雅学校2017-2018学年高二11月月考化学试题广西壮族自治区百色市田阳高中2019-2020学年高二上学期12月月考理科综合化学试题四川省资阳市2019-2020学年高二上学期期末质量检测化学试题黑龙江省鹤岗市第一中学2019-2020学年高一下学期期末考试化学试题(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练(已下线)第2章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河南省洛阳市孟津县第二高级中学2020-2021学年高二上学期9月月考化学试题(已下线)【南昌新东方】6. 南昌十七中 颜毅西藏自治区拉萨市第二高级中学2019-2020学年高二上学期期末考试化学试题甘肃省会宁县第一中学2020-2021学年高二上学期期中考试化学(理)试题河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题广东省梅州市2020-2021学年高二上学期第二次质检考试化学试题四川省射洪中学校2020-2021学年高二上学期第三次月考化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题山西省沁源县第一中学2020-2021学年高二下学期开学考试化学试题河南省许昌市第三中学2020-2021学年高二3月月考化学试题江西省赣州市信丰中学2020-2021学年高二上学期入学考试化学试题(已下线)专题讲座(五)反应速率、平衡图像题解题策略(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题湖北省襄阳市南漳县第二中学2021-2022学年高二上学期10月考化学试题广东省执信中学番禺附属学校2021-2022学年高二上学期期中考试化学试题江西省丰城市第九中学2022-2023学年高二上学期入学质量检测化学试题河南省洛阳市新安县第一高级中学2021-2022学年高二上学期10月月考化学试题陕西省安康市汉滨区五里高级中学2021-2022学年高二上学期期中考试化学试题河南宏力学校2021-2022学年高二上学期期中考试化学试题广西贺州市钟山县钟山中学2020-2021学年高二下学期第三次月考理科化学试题天津市南仓中学2022-2023学年高二上学期1月期末考试化学试题新疆阿克苏市实验中学2022-2023学年高二上学期期末考试化学试题(已下线)第七章 化学反应速率与化学平衡 第44讲 化学反应速率、平衡的常规图像四川省青神中学校2022-2023学年高二下学期3月月考化学试题江西省抚州市2023-2024学年高二上学期学生学业质量监测化学试题江西省新余市第一中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
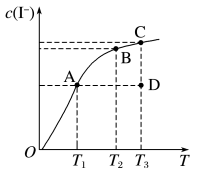
9 .  在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:
 。某
。某 、KI混合溶液中,
、KI混合溶液中, 的物质的量浓度
的物质的量浓度 与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
 在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:
 。某
。某 、KI混合溶液中,
、KI混合溶液中, 的物质的量浓度
的物质的量浓度 与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
A.该反应 |
B.若在 、 、 温度下,反应的平衡常数分别为 温度下,反应的平衡常数分别为 、 、 ,则 ,则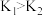 |
C.若反应进行到状态D时,一定有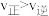 |
D.状态A与状态B相比,状态A的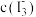 大 大 |
您最近半年使用:0次
2022-11-27更新
|
262次组卷
|
9卷引用:吉林省延边第二中学2022-2023学年高二上学期期末考试化学试题
吉林省延边第二中学2022-2023学年高二上学期期末考试化学试题【市级联考】山东省烟台市2019届高三上学期期末考试化学试题【全国百强校】福建省厦门市双十中学2018-2019学年高二下学期第一次月考化学试题黑龙江省牡丹江市东宁市第一中学2020-2021学年高二上学期第一次月考化学试题河北省衡水市第十四中学2020-2021学年高二上学期三调考试(校内)化学试题黑龙江省实验中学2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市第二十四中学2022-2023学年高二10月月考化学试题四川省成都市树德中学2022-2023学年高二上学期11月阶段性测试化学试题新疆阿克苏市实验中学2022-2023学年高二上学期期末考试化学试题
解题方法
10 . 合成氨工业对国民经济和社会发展具有重要的意义。其原理为: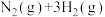

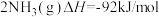 ;据此回答以下问题:
;据此回答以下问题:
(1)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值_______ 。(填“越大”、“越小”或“不变”)
(2)某温度下,若把 与
与 置于体积为
置于体积为 的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的
的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的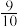 ,则平衡时氢气的转化率
,则平衡时氢气的转化率 =
=_______ (用百分数表示 。能说明该反应达到化学平衡状态的是
。能说明该反应达到化学平衡状态的是_______  填字母
填字母 。
。
a.容器内的密度保持不变b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
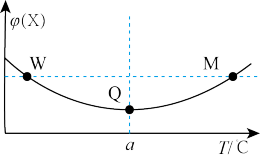
(3)某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)⇌3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,△H______ 0
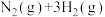

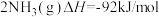 ;据此回答以下问题:
;据此回答以下问题:(1)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值
(2)某温度下,若把
 与
与 置于体积为
置于体积为 的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的
的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的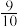 ,则平衡时氢气的转化率
,则平衡时氢气的转化率 =
= 。能说明该反应达到化学平衡状态的是
。能说明该反应达到化学平衡状态的是 填字母
填字母 。
。a.容器内的密度保持不变b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)⇌3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,△H

您最近半年使用:0次



