名校
解题方法
1 . 汞及其化合物广泛应用于医药、冶金及其他精密高新科技领域。
(1)干燥的 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为___________ 。该反应中氧化产物是___________ 。
(2)富氧燃烧烟气中 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为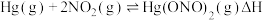
根据实验结果,有研究组提出了 与
与 的可能反应机理:
的可能反应机理:

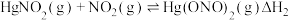

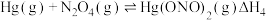
①根据盖斯定律,
___________ (写出一个代数式即可)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的是___________ 。
A.增大 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率
B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入 ,可提高原料的平衡转化率
,可提高原料的平衡转化率
D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为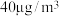 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。 的平均脱除反应速率为
的平均脱除反应速率为___________ 
ⅱ)
___________ 0(填“>”或“<”)
④富氧燃烧烟气中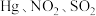 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于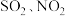 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是___________ 。 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:

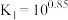
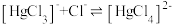
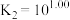
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随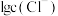 的变化如图所示
的变化如图所示 ]。
]。
①熔融状态的 不能导电,
不能导电, 是
是___________ (填“共价”或“离子”)化合物。
②A点溶液中
___________  。
。
③A点溶液中 的转化率为
的转化率为___________ (列出计算式)。
(1)干燥的
 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为(2)富氧燃烧烟气中
 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为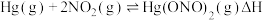
根据实验结果,有研究组提出了
 与
与 的可能反应机理:
的可能反应机理:
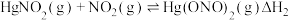

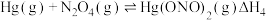
①根据盖斯定律,

②上述反应体系在一定条件下建立平衡后,下列说法正确的是
A.增大
 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入
 ,可提高原料的平衡转化率
,可提高原料的平衡转化率D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为
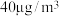 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
 的平均脱除反应速率为
的平均脱除反应速率为
ⅱ)

④富氧燃烧烟气中
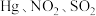 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于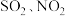 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是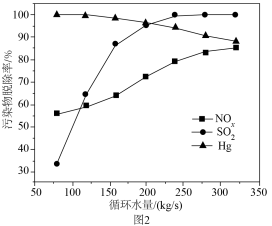
 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:
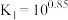
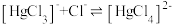
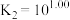
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随 的变化如图所示
的变化如图所示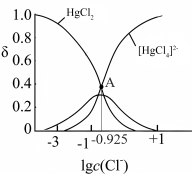
 ]。
]。①熔融状态的
 不能导电,
不能导电, 是
是②A点溶液中

 。
。③A点溶液中
 的转化率为
的转化率为
您最近一年使用:0次
2024-03-01更新
|
511次组卷
|
3卷引用:广东省广州市第二中学2023-2024学年高三上学期期末化学试卷
广东省广州市第二中学2023-2024学年高三上学期期末化学试卷(已下线)大题04 化学反应原理综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题
名校
解题方法
2 . 合成氨反应 是目前最有效的工业固氮方法,解决数亿人口生存问题。
是目前最有效的工业固氮方法,解决数亿人口生存问题。
(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。
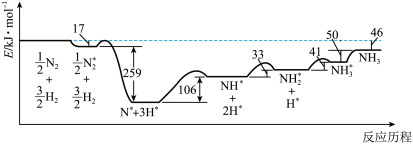
该反应在___________ (填“任何”“较低温”“较高温”)条件下可以自发进行;上述历程中反应速率最慢的步骤的方程式为___________ 。
(2)在T℃、压强为0.9MPa条件下,向一恒压密闭容器中通入 的混合气体,体系中各气体的含量与时间变化关系如图所示。已知:分压=总压×体积分数。
的混合气体,体系中各气体的含量与时间变化关系如图所示。已知:分压=总压×体积分数。
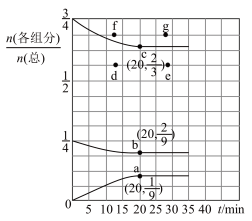
①以下叙述不能 说明该条件下反应达到平衡状态的是___________ (填字母)。
A.氨气的体积分数保持不变 B.容器中 保持不变
保持不变
C.气体平均相对分子质量保持不变 D.气体密度保持不变
E.
②反应20min时达到平衡,则0~20min内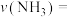
________  ,
,
_________ 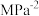 。(
。( 为以分压表示的平衡常数,代入数据列出计算式,不必化简)
为以分压表示的平衡常数,代入数据列出计算式,不必化简)
③若起始条件相同,在恒容容器中发生反应,则达到平衡时 的含量符合图中
的含量符合图中___________ 点(填“d”“e”“f”或“g”)。
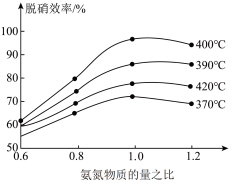
(3)氨化脱硝过程发生反应
 ,请根据下图分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
,请根据下图分析420℃的脱硝效率低于390℃的脱硝效率可能的原因___________ 。
 是目前最有效的工业固氮方法,解决数亿人口生存问题。
是目前最有效的工业固氮方法,解决数亿人口生存问题。(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。

该反应在
(2)在T℃、压强为0.9MPa条件下,向一恒压密闭容器中通入
 的混合气体,体系中各气体的含量与时间变化关系如图所示。已知:分压=总压×体积分数。
的混合气体,体系中各气体的含量与时间变化关系如图所示。已知:分压=总压×体积分数。
①以下叙述
A.氨气的体积分数保持不变 B.容器中
 保持不变
保持不变C.气体平均相对分子质量保持不变 D.气体密度保持不变
E.

②反应20min时达到平衡,则0~20min内
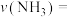
 ,
,
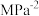 。(
。( 为以分压表示的平衡常数,代入数据列出计算式,不必化简)
为以分压表示的平衡常数,代入数据列出计算式,不必化简)③若起始条件相同,在恒容容器中发生反应,则达到平衡时
 的含量符合图中
的含量符合图中(3)氨化脱硝过程发生反应

 ,请根据下图分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
,请根据下图分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
您最近一年使用:0次
名校
解题方法
3 . 甲烷、甲醇(CH3OH)、甲醛(HCHO)等含有一个碳原子的物质称为“一碳”化合物, 广泛应用于化工、 医药、 能源等方面, 研究“一碳”化合物的化学称为“一碳”化学。
(1)已知: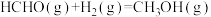
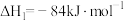 ,
,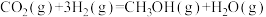
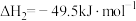 ,则反应
,则反应
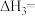
_________ kJ∙mol−1。
(2)工业上合成甲醇的反应:
 ,在一个密闭容器中,充入1molCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图所示。
,在一个密闭容器中,充入1molCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图所示。
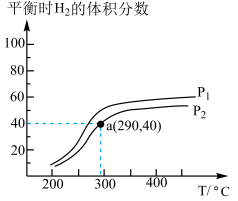
①压强P1_________ P2(填“大于”或“小于”), 该反应达到平衡的标志是_________ (填标号)。
A.反应速率υ正(H2)=2υ逆(CH3OH) B.容器内 CO 和H2物质的量之比为1:2
C.混合气体的质量不再变化 D.混合气体的平均摩尔质量不再变化
②a点条件下,H2的平衡转化率为_________ ,该温度下达到平衡后,在容积不变的条件下再充入 和
和 ,平衡
,平衡_________ (填“正向”“逆向”或“不”)移动。
(3)工业上用甲醇可以制备甲胺(CH3NH2),甲胺与氨在水中的电离方式相似。则甲胺在水中的电离方程式为___________ 。
(1)已知:
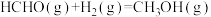
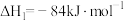 ,
,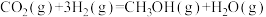
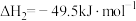 ,则反应
,则反应
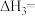
(2)工业上合成甲醇的反应:

 ,在一个密闭容器中,充入1molCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图所示。
,在一个密闭容器中,充入1molCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图所示。
①压强P1
A.反应速率υ正(H2)=2υ逆(CH3OH) B.容器内 CO 和H2物质的量之比为1:2
C.混合气体的质量不再变化 D.混合气体的平均摩尔质量不再变化
②a点条件下,H2的平衡转化率为
 和
和 ,平衡
,平衡(3)工业上用甲醇可以制备甲胺(CH3NH2),甲胺与氨在水中的电离方式相似。则甲胺在水中的电离方程式为
您最近一年使用:0次
2023-11-27更新
|
78次组卷
|
2卷引用:广东省广州市真光中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
4 . 二甲醚催化制备乙醇主要涉及以下两个反应:
反应I: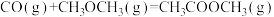

反应II: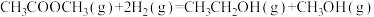
反应I、II的平衡常数的对数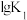 、
、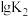 与温度的关系如图1所示:固定
与温度的关系如图1所示:固定 、
、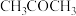 、
、 的原料比、体系压强不变的条件下,同时发生反应I、II,平衡时各物质的物质的量分数随温度的变化如图2所示。下列说法正确的是
的原料比、体系压强不变的条件下,同时发生反应I、II,平衡时各物质的物质的量分数随温度的变化如图2所示。下列说法正确的是
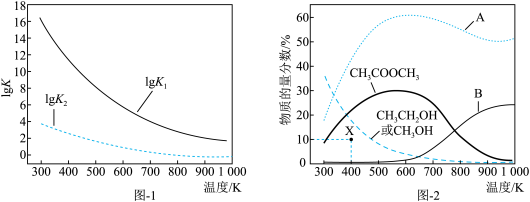
反应I:
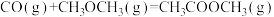

反应II:
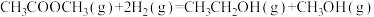
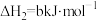
反应I、II的平衡常数的对数
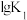 、
、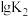 与温度的关系如图1所示:固定
与温度的关系如图1所示:固定 、
、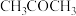 、
、 的原料比、体系压强不变的条件下,同时发生反应I、II,平衡时各物质的物质的量分数随温度的变化如图2所示。下列说法正确的是
的原料比、体系压强不变的条件下,同时发生反应I、II,平衡时各物质的物质的量分数随温度的变化如图2所示。下列说法正确的是
A. |
B.测得X点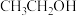 的物质的量分数是10%,则X点反应II有: 的物质的量分数是10%,则X点反应II有: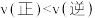 |
C.由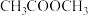 的曲线知,600K后升高温度对反应I的影响程度小于对反应II的影响程度 的曲线知,600K后升高温度对反应I的影响程度小于对反应II的影响程度 |
D.曲线A表示 的物质的量分数随温度的变化 的物质的量分数随温度的变化 |
您最近一年使用:0次
2022-10-11更新
|
579次组卷
|
3卷引用:广东省广州市三校(广附,铁一,广外)2022-2023学年高二上学期期末联考化学试题
名校
5 . 铁及铁的氧化物广泛应用于生产、生活、航天、科研等领域,利用Fe2O3与CH4可制备“纳米级”金属铁,回答下列问题:
①3H2(g)+Fe2O3(s)⇌2Fe(s)+3H2O(g) ΔH1=-26.5kJ·mol-1
②CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH2=-160kJ·mol-1
(1)恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+4Fe2O3(s)⇌8Fe(s)+6H2O(g)+3CO2(g)
①该反应的ΔH=_______ 。
②下列条件能判断该反应达到平衡状态的是_______ 。
a.消耗4molFe2O3的同时,消耗3molCO2
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2O)
(2)在T℃下,向某密闭容器中加入3molCH4(g)和2molFe2O3(s)发生反应:3CH4(g)+4Fe2O3(s)⇌8Fe(s)+6H2O(l)+3CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器中n(CH4)∶n(H2O)=1∶1,10min内用Fe2O3(s)表示的平均反应速率为_______ g·min-1;T℃下该反应的Kp=_______ (用分压表示,分压=总压×物质的量分数);T℃下若起始时向该容器中加入2molCH4(g)、4molFe2O3(s)、1molFe(s)、2molH2O(l)、2molCO2(g),则起始时v(正)_______ v(逆)(填“>”“<”或“=”)。
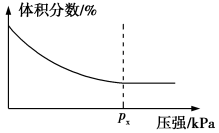
(3)一定温度下,密闭容器中进行反应3CH4(g)+4Fe2O3(s)⇌8Fe(s)+6H2O(g)+3CO2(g),测得平衡时混合物中某气体物质的体积分数随压强的变化如图所示,则纵坐标表示的含碳物质是_______ ,随着压强增大,纵坐标的体积分数变化的原因是_______
_______ 。
①3H2(g)+Fe2O3(s)⇌2Fe(s)+3H2O(g) ΔH1=-26.5kJ·mol-1
②CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH2=-160kJ·mol-1
(1)恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+4Fe2O3(s)⇌8Fe(s)+6H2O(g)+3CO2(g)
①该反应的ΔH=
②下列条件能判断该反应达到平衡状态的是
a.消耗4molFe2O3的同时,消耗3molCO2
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2O)
(2)在T℃下,向某密闭容器中加入3molCH4(g)和2molFe2O3(s)发生反应:3CH4(g)+4Fe2O3(s)⇌8Fe(s)+6H2O(l)+3CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器中n(CH4)∶n(H2O)=1∶1,10min内用Fe2O3(s)表示的平均反应速率为
(3)一定温度下,密闭容器中进行反应3CH4(g)+4Fe2O3(s)⇌8Fe(s)+6H2O(g)+3CO2(g),测得平衡时混合物中某气体物质的体积分数随压强的变化如图所示,则纵坐标表示的含碳物质是

您最近一年使用:0次
2022-10-05更新
|
239次组卷
|
2卷引用:广东省广州市育才中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
6 . 丙烯腈(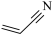 )是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯(
)是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯( )为原料合成丙烯腈,主要反应过程如下:
)为原料合成丙烯腈,主要反应过程如下:
反应I:

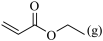

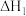 >0
>0
反应II: +NH3(g)
+NH3(g) 
 (g)+H2O(g)+
(g)+H2O(g)+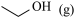
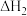 >0
>0
(1)已知部分化学键键能如下表所示:
据此计算ΔH1=___________ ;此反应自发进行的条件是___________ (填“高温易自发”“低温易自发”或“任何温度都能自发”)。
(2)在盛有催化剂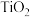 、压强为200kPa的恒压密闭容器中按体积比2∶15充入
、压强为200kPa的恒压密闭容器中按体积比2∶15充入 和
和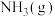 发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
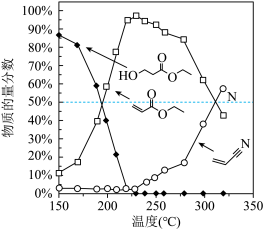
①随着温度的升高, (g)的平衡物质的量分数先增大后减小的原因为
(g)的平衡物质的量分数先增大后减小的原因为___________ 。
②N点对应反应II的平衡常数
___________ (x代表物质的量分数)。
③科学家通过DFT计算得出反应II的反应历程有两步,其中第一步反应的化学方程式为: +NH3(g)
+NH3(g)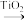
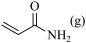 +
+ 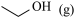 ,则第二步反应的化学方程式为
,则第二步反应的化学方程式为___________ ;实验过程中未检测到 的原因可能
的原因可能___________ 。
④实际生产中若充入一定量N2(不参与反应),可提高丙烯腈的平衡产率,原因为___________ 。
 )是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯(
)是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯( )为原料合成丙烯腈,主要反应过程如下:
)为原料合成丙烯腈,主要反应过程如下: 反应I:




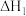 >0
>0反应II:
 +NH3(g)
+NH3(g) 
 (g)+H2O(g)+
(g)+H2O(g)+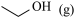
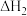 >0
>0(1)已知部分化学键键能如下表所示:
| 化学键 | C﹣O | C﹣C | C=C | C﹣H | O﹣H | C=O |
| 键能(kJ•mol ﹣1) | 351 | 348 | 615 | 413 | 463 | 745 |
据此计算ΔH1=
(2)在盛有催化剂
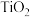 、压强为200kPa的恒压密闭容器中按体积比2∶15充入
、压强为200kPa的恒压密闭容器中按体积比2∶15充入 和
和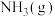 发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
①随着温度的升高,
 (g)的平衡物质的量分数先增大后减小的原因为
(g)的平衡物质的量分数先增大后减小的原因为②N点对应反应II的平衡常数

③科学家通过DFT计算得出反应II的反应历程有两步,其中第一步反应的化学方程式为:
 +NH3(g)
+NH3(g)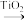
 +
+ 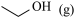 ,则第二步反应的化学方程式为
,则第二步反应的化学方程式为 的原因可能
的原因可能④实际生产中若充入一定量N2(不参与反应),可提高丙烯腈的平衡产率,原因为
您最近一年使用:0次
名校
7 . 一定量的 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: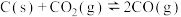 。平衡时,体系中气体体积分数与温度的关系如图所示:
。平衡时,体系中气体体积分数与温度的关系如图所示:
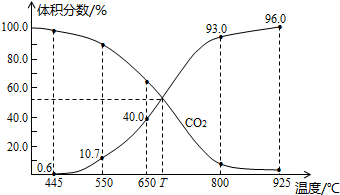
已知:气体分压(p分)=气体总压(p总)×体积分数
下列说法正确的是
 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: 。平衡时,体系中气体体积分数与温度的关系如图所示:
。平衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压(p分)=气体总压(p总)×体积分数
下列说法正确的是
A. 时,若充入惰性气体,V正,V逆均减小,平衡不移动 时,若充入惰性气体,V正,V逆均减小,平衡不移动 |
B. 时,反应达平衡后 时,反应达平衡后 的转化率为 的转化率为 |
C. 时,若充入等体积的 时,若充入等体积的 和 和 ,平衡向逆反应方向移动 ,平衡向逆反应方向移动 |
D. 时,化学平衡常数 时,化学平衡常数 |
您最近一年使用:0次
名校
解题方法
8 . 某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响,图象如下,下列判断正确的是()
pC(g)的速率和平衡的影响,图象如下,下列判断正确的是()
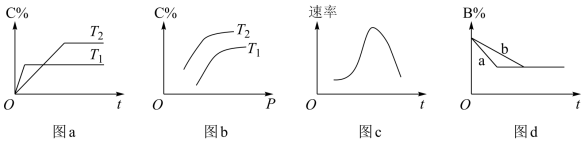
| A.由图a可知,T1>T2,该反应的逆反应为吸热反应 |
| B.由图b可知,该反应m+n<p |
| C.图c是绝热条件下速率和时间的图象,由此说明该反应吸热 |
| D.图d中,曲线a一定增加了催化剂 |
您最近一年使用:0次
2020-11-20更新
|
929次组卷
|
5卷引用:广东实验中学2023-2024学年高二上学期期中考试化学试题
解题方法
9 . 甲醇是重要的化工原料。利用合成气(主要成分为(CO,CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
ii:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
iii:CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应2中相关化学键键能数据如下:
由此计算ΔH2=___ kJ·mol-1。已知ΔH1=-63kJ·mol-1,则ΔH3=___ kJ·mol-1。
(2)对于反应1,不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,请回答下列问题:
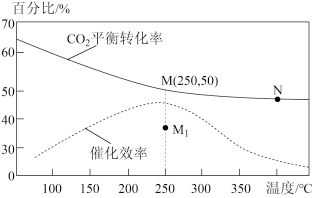
①下列说法不正确的是( )
A.M点时平衡常数比N点时平衡常数大
B.温度低于250℃时,随温度升高甲醇的平衡产率降低
C.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
②若在刚性容器中充入3molH2和1molCO2发生反应1,起始压强为4MPa,则图中M点CH3OH的体积分数为___ ,250℃时反应的平衡常数Kp=___ (MPa)-2(保留三位有效数字);
③若要进一步提高甲醇产率,可采取的措施有___ (写两条即可)
(3)相同条件下,一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率,结合反应1、2分析原因:___ 。
(4)以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g) CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
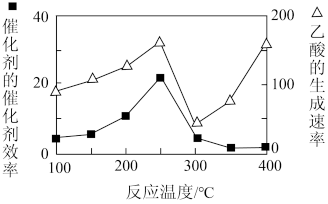
250~300℃时,乙酸的生成速率降低的主要原因是___ 。
300~400℃时,乙酸的生成速率升高的主要原因是___ 。
i:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1ii:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2iii:CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3回答下列问题:
(1)已知反应2中相关化学键键能数据如下:
| 化学键 | H—H | C=O | C≡O | H—O |
| E/KJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=
(2)对于反应1,不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,请回答下列问题:

①下列说法不正确的是
A.M点时平衡常数比N点时平衡常数大
B.温度低于250℃时,随温度升高甲醇的平衡产率降低
C.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
②若在刚性容器中充入3molH2和1molCO2发生反应1,起始压强为4MPa,则图中M点CH3OH的体积分数为
③若要进一步提高甲醇产率,可采取的措施有
(3)相同条件下,一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率,结合反应1、2分析原因:
(4)以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)
 CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
250~300℃时,乙酸的生成速率降低的主要原因是
300~400℃时,乙酸的生成速率升高的主要原因是
您最近一年使用:0次
名校
10 . 在恒容密闭容器中存在如下反应。2A(g)+B(g) 3C(g)+D(s) H<0,在其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是
3C(g)+D(s) H<0,在其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是
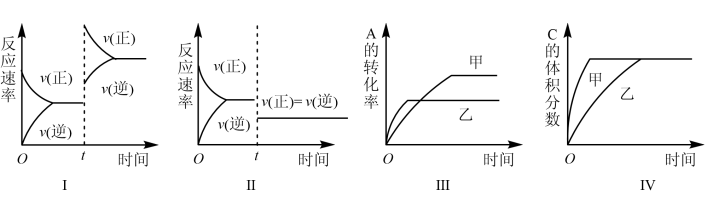
 3C(g)+D(s) H<0,在其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是
3C(g)+D(s) H<0,在其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是
| A.图Ⅰ表示增加生成物浓度对该平衡的影响 |
| B.图Ⅱ表示增大压强对该平衡的影响 |
| C.图Ⅲ表示温度对该平衡的影响,温度:乙>甲 |
| D.图Ⅳ表示催化剂对该平衡的影响,催化效率:乙>甲 |
您最近一年使用:0次
2019-12-15更新
|
949次组卷
|
5卷引用:广东省广州市真光中学2023-2024学年高二上学期12月月考化学试题



