解题方法
1 . 选择性催化还原法(SCR)技术是目前国际上主流高效去除尾气中NOx起始终点的技术路线,主要用于还原尾气中的NOx。在一定温度范围内,催化剂将NOx分解成无害的氮气(N2)和水(H2O),同时,在SCR催化剂的末端涂覆ASC(氨氧化催化剂),将未反应完全的氨气氧化,防止氨气泄露。其反应原理及主要方程式如图所示:
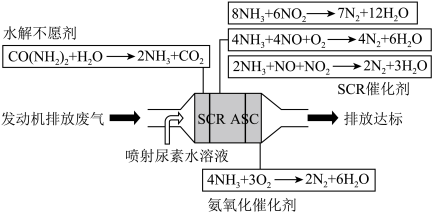
SCR标准主反应: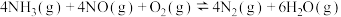

SCR辅助反应: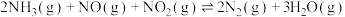

ASC反应:
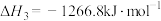
反应Ⅰ: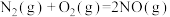
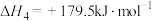
反应Ⅱ:

请回答下列问题:
(1)由上述反应可知,SCR标准主反应的△H1=_______ kJ∙mol-1,该反应在_______ (填“高温”、“低温”或“任意温度”)条件下能自发进行。
(2)在密闭容器中进行SCR标准主反应时,氨氮比[ ]与温度均会影响该反应的脱硝效率(单位时间内脱除的NOx量与未经脱硝前烟气中所含NOx量的百分比),其关系如图所示:
]与温度均会影响该反应的脱硝效率(单位时间内脱除的NOx量与未经脱硝前烟气中所含NOx量的百分比),其关系如图所示:
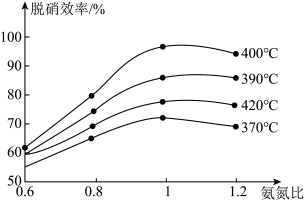
①根据图像信息判断,脱硝的最佳条件是_______ 。
②氨氮比一定时,在400℃脱硝效率最大,其可能的原因是_______ 。
③当 时,烟气中的NO含量反而增大,主要原因是
时,烟气中的NO含量反而增大,主要原因是_______ 。
(3)T℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,仅发生SCR辅助反应: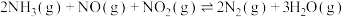 ,5min时反应达到平衡,测得N2的物质的量分数为
,5min时反应达到平衡,测得N2的物质的量分数为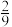 ,体系压强为
,体系压强为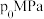 。
。
①在0~5min内,
_______  ,NO的平衡转化率为
,NO的平衡转化率为_______ 。
②T℃时,该反应的压强平衡常数Kp=_______ MPa(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。

SCR标准主反应:
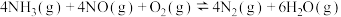

SCR辅助反应:
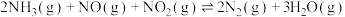

ASC反应:

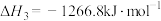
反应Ⅰ:
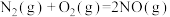
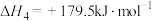
反应Ⅱ:


请回答下列问题:
(1)由上述反应可知,SCR标准主反应的△H1=
(2)在密闭容器中进行SCR标准主反应时,氨氮比[
 ]与温度均会影响该反应的脱硝效率(单位时间内脱除的NOx量与未经脱硝前烟气中所含NOx量的百分比),其关系如图所示:
]与温度均会影响该反应的脱硝效率(单位时间内脱除的NOx量与未经脱硝前烟气中所含NOx量的百分比),其关系如图所示:
①根据图像信息判断,脱硝的最佳条件是
②氨氮比一定时,在400℃脱硝效率最大,其可能的原因是
③当
 时,烟气中的NO含量反而增大,主要原因是
时,烟气中的NO含量反而增大,主要原因是(3)T℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,仅发生SCR辅助反应:
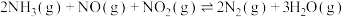 ,5min时反应达到平衡,测得N2的物质的量分数为
,5min时反应达到平衡,测得N2的物质的量分数为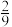 ,体系压强为
,体系压强为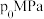 。
。①在0~5min内,

 ,NO的平衡转化率为
,NO的平衡转化率为②T℃时,该反应的压强平衡常数Kp=
您最近一年使用:0次
解题方法
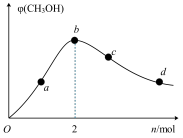
2 . 甲醇是一种可再生能源,由 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:
反应Ⅰ: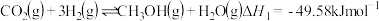
反应Ⅱ: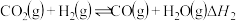
反应Ⅲ: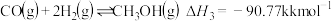
(1)反应Ⅱ的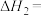
_______ 。反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为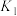 、
、 、
、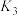 ,则
,则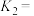
_______ (用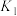 、
、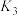 表示)。
表示)。
(2)反应Ⅰ能自发进行的条件是_______ (填“较低温度”“较高温度”或“任何温度”)。
(3)下表是反应Ⅲ: 在不同温度下化学平衡常数(K)
在不同温度下化学平衡常数(K)
某温度下,将 和
和 充入
充入 的密闭容器中,充分反应后达平衡时,
的密闭容器中,充分反应后达平衡时,
①测得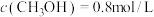 ,则
,则 的转化率是
的转化率是_______ ,此时的温度为_______ 。
②要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是_______ 。
A.适当升温 B.恒容充入 C.适当增大压强 D.恒容通入
C.适当增大压强 D.恒容通入
③在此条件下,不可作为判断反应Ⅲ达到平衡状态的标志是_______ 。
A.混合气体的压强不再变化
B. 、
、 和
和 的物质的量之比为1∶2∶1
的物质的量之比为1∶2∶1
C.混合气体的平均相对分子质量不再变化
D. 的百分含量不再变化
的百分含量不再变化
 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:反应Ⅰ:
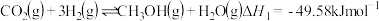
反应Ⅱ:
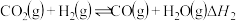
反应Ⅲ:
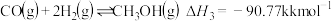
(1)反应Ⅱ的
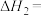
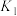 、
、 、
、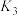 ,则
,则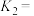
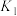 、
、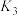 表示)。
表示)。(2)反应Ⅰ能自发进行的条件是
(3)下表是反应Ⅲ:
 在不同温度下化学平衡常数(K)
在不同温度下化学平衡常数(K)温度/ | 240 | 300 | 360 |
| 平衡常数(K) | 2.04 | 0.27 | 0.012 |
某温度下,将
 和
和 充入
充入 的密闭容器中,充分反应后达平衡时,
的密闭容器中,充分反应后达平衡时,①测得
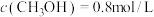 ,则
,则 的转化率是
的转化率是②要提高
 的转化率,可以采取的措施是
的转化率,可以采取的措施是A.适当升温 B.恒容充入
 C.适当增大压强 D.恒容通入
C.适当增大压强 D.恒容通入
③在此条件下,不可作为判断反应Ⅲ达到平衡状态的标志是
A.混合气体的压强不再变化
B.
 、
、 和
和 的物质的量之比为1∶2∶1
的物质的量之比为1∶2∶1C.混合气体的平均相对分子质量不再变化
D.
 的百分含量不再变化
的百分含量不再变化
您最近一年使用:0次
名校
解题方法
3 . 将X(s)和Y(g)加入密闭容器中,在一定条件下发生反应: 。已知该反应的平衡常数如表所示。下列说法正确的是
。已知该反应的平衡常数如表所示。下列说法正确的是
 。已知该反应的平衡常数如表所示。下列说法正确的是
。已知该反应的平衡常数如表所示。下列说法正确的是| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 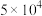 | 2 | 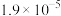 |
| A.上述反应是熵增反应 |
B.25℃时,反应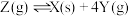 的平衡常数是0.5 的平衡常数是0.5 |
| C.恒温恒容下,向容器中再充入少量Z(g),达到新平衡时,Z的体积百分含量将增大 |
D.在80℃时,测得某时刻Y、Z的浓度均为0.5 ,则此时 ,则此时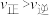 |
您最近一年使用:0次
2023-01-08更新
|
221次组卷
|
4卷引用:安徽省皖北2022~2023学年高二上学期12月联考化学试题
安徽省皖北2022~2023学年高二上学期12月联考化学试题河北省沧州运东七县2023-2024学年高二上学期10月期中考试化学试题黑龙江省黑河市第一中学2023-2024学年高二上学期期末考试化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(11-20)
解题方法
4 . 我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。研发CO2资源化利用技术,降低空气中CO2含量成为世界各国研究热点。
(1)CO2与CH4是典型的温室气体,CH4-CO2重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。
CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247kJ·mol-1
①该反应△S_____ 0。(填“>”或“<”)
②有传闻CH4-CO2重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?_____ 。(填“正确”或“错误”,并写出原因)
③若让此反应能自发进行,你认为应选择_____ 。(填“高温”或“低温”)
(2)乙醇作为清洁燃料已被在添加汽油中使用,下面是二甲醚催化制备乙醇的主要反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g)
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g)
固定CO、CH3OCH3、H2的起始原料比为1:1:2、体系压强不变的条件下发生反应Ⅰ、Ⅱ,平衡时部分物质的物质的量分数随温度变化如题所示。回答下列问题:
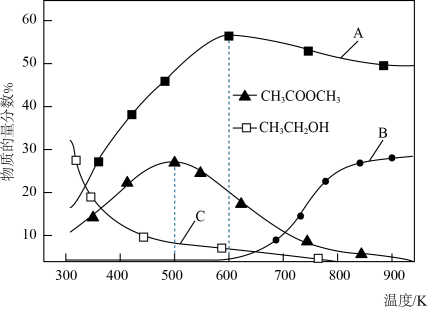
①反应Ⅱ为_____ 反应。(填“吸热”或“放热”)
②曲线C_____ 表示CH3OH的物质的量分数。(填“可以”或“不可以”)
③由500K上升至600K,温度对反应Ⅰ的影响_____ 对反应Ⅱ的影响。(填“大于”“等于”或“小于”)
(1)CO2与CH4是典型的温室气体,CH4-CO2重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。
CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247kJ·mol-1
①该反应△S
②有传闻CH4-CO2重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
③若让此反应能自发进行,你认为应选择
(2)乙醇作为清洁燃料已被在添加汽油中使用,下面是二甲醚催化制备乙醇的主要反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g)
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g)
固定CO、CH3OCH3、H2的起始原料比为1:1:2、体系压强不变的条件下发生反应Ⅰ、Ⅱ,平衡时部分物质的物质的量分数随温度变化如题所示。回答下列问题:

①反应Ⅱ为
②曲线C
③由500K上升至600K,温度对反应Ⅰ的影响
您最近一年使用:0次
5 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面方法由氨气得到氢气。
方法:氨热分解法制氢气
反应2NH3(g) N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
(1)已知该反应的ΔS=198.9 J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填字母);
(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=___________ mol·L-1·min-1(用含t1的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________ ;
③在该温度下,反应的标准平衡常数Kθ=___________ 。(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
方法:氨热分解法制氢气
反应2NH3(g)
 N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;(1)已知该反应的ΔS=198.9 J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填字母);
| A.25 ℃ | B.125 ℃ | C.225 ℃ | D.325 ℃ |

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
③在该温度下,反应的标准平衡常数Kθ=
 gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
您最近一年使用:0次
名校
6 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为: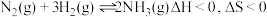 。
。
(1)下列关于工业合成氨的说法正确的是_______。
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______。
(3)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:
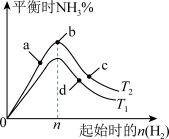
①图像中 和
和 的关系是:
的关系是:
_______  (填“>,<或=”)。
(填“>,<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是:
的转化率最高的是:_______ 。
③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是_______ 。
(4)恒温下,向一个4L的恒容密闭容器中充入 和
和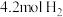 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测
①20min后,反应达平衡,氨气的浓度为 ,用
,用 表示的平均反应速率为
表示的平均反应速率为_______  。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
_______ [对于气相反应,用某组分B的平衡压强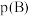 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如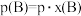 ,p为平衡总压强,
,p为平衡总压强,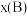 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。
②若维持容器体积不变,温度不变,向原平衡体系中再加入 和
和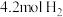 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度_______  (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
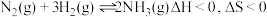 。
。(1)下列关于工业合成氨的说法正确的是_______。
A.因为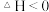 ,所以该反应一定能自发进行 ,所以该反应一定能自发进行 |
B.因为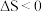 ,所以该反应一定不能自发进行 ,所以该反应一定不能自发进行 |
| C.在高温下进行是为了提高反应物的转化率 |
| D.该反应在低温下能自发进行 |
A.容器内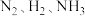 的浓度之比为1∶3∶2 的浓度之比为1∶3∶2 |
B. 百分含量保持不变 百分含量保持不变 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |

①图像中
 和
和 的关系是:
的关系是:
 (填“>,<或=”)。
(填“>,<或=”)。②a、b、c、d四点所处的平衡状态中,反应物
 的转化率最高的是:
的转化率最高的是:③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是
(4)恒温下,向一个4L的恒容密闭容器中充入
 和
和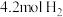 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测①20min后,反应达平衡,氨气的浓度为
 ,用
,用 表示的平均反应速率为
表示的平均反应速率为 。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
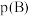 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如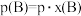 ,p为平衡总压强,
,p为平衡总压强,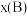 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。②若维持容器体积不变,温度不变,向原平衡体系中再加入
 和
和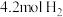 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度 (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
您最近一年使用:0次
2022-12-07更新
|
705次组卷
|
3卷引用:重庆市渝东六校共同体2022-2023学年高二上学期联合诊断考试化学试题
名校
解题方法
7 . 含氮污染物的有效去除和资源的充分利用是重要研究课题,回答下列问题:
(1)利用工业尾气NO2与O3反应制备新型硝化剂N2O5,过程涉及以下反应:
Ⅰ.2O3(g)=3O2(g)△H1 平衡常数为K1
Ⅱ.4NO2(g)+O2(g)=2N2O5(g)△H2 平衡常数为K2
Ⅲ.2NO2(g)+O3(g)=N2O5(g)+O2(g)△H3平衡常数为K3
平衡常数K与温度T的函数关系为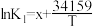 、
、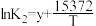 、
、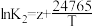 ,其中x、y、z为常数。
,其中x、y、z为常数。
①K1=________ (用含K2、K3的等式表示)。
②反应△H2________ 0 (填>或<),反应Ⅰ________ (填“高温“、“低温”或“任意温度”)下能自发进行。
③平衡常数与温度的函数关系式和②中一致,则 的取值范围是
的取值范围是________ 。(填序号)
A.<-2 B.-2~0 C.0~2 D.>2
(2)NH3与O2作用分别生成N2、NO和N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去,将一定比例的NH3和N2的混合气体以一定的流速通过装有催化剂的反应管,NH3的转化率、N2的选择性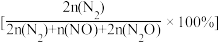 与温度的关系如图所示。
与温度的关系如图所示。
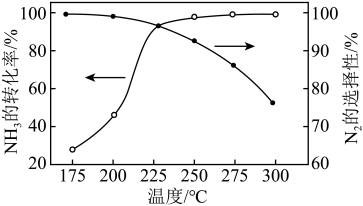
①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化合物的含量____ (填“增大”或“减小“)。
②综合上述信息,需研发________ (填“高温“或“低温“)下N2选择性和催化效果更高的催化剂,能更有效除去尾气中的NH3。
(3)在催化剂条件下发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始体系中气体分压p(CO)=p(NO)且p(CO2)=2p(N2),测得反应体系中CO和N2的分压随时间变化情况如表所示。
200℃时,该反应的化学平衡常数Kp=_______ (kPa)-1[Kp表示平衡常数计算表达式中用分压代替浓度计算所得的值],该反应的△H_________ 0(填“>“或“<“)。
(1)利用工业尾气NO2与O3反应制备新型硝化剂N2O5,过程涉及以下反应:
Ⅰ.2O3(g)=3O2(g)△H1 平衡常数为K1
Ⅱ.4NO2(g)+O2(g)=2N2O5(g)△H2 平衡常数为K2
Ⅲ.2NO2(g)+O3(g)=N2O5(g)+O2(g)△H3平衡常数为K3
平衡常数K与温度T的函数关系为
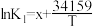 、
、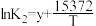 、
、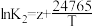 ,其中x、y、z为常数。
,其中x、y、z为常数。①K1=
②反应△H2
③平衡常数与温度的函数关系式和②中一致,则
 的取值范围是
的取值范围是A.<-2 B.-2~0 C.0~2 D.>2
(2)NH3与O2作用分别生成N2、NO和N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去,将一定比例的NH3和N2的混合气体以一定的流速通过装有催化剂的反应管,NH3的转化率、N2的选择性
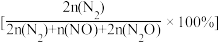 与温度的关系如图所示。
与温度的关系如图所示。
①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化合物的含量
②综合上述信息,需研发
(3)在催化剂条件下发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始体系中气体分压p(CO)=p(NO)且p(CO2)=2p(N2),测得反应体系中CO和N2的分压随时间变化情况如表所示。
| 时间/min | 0 | 30 | 60 | 120 | 180 | |
| 200℃ | CO的分压/kPa | 4 | 8.8 | 13 | 20 | 20 |
| N2的分压/kPa | 48 | 45.6 | 43.5 | 40 | 40 | |
| 300℃ | CO的分压/kPa | 100 | 69.0 | 48 | 48 | 48 |
| N2的分压/kPa | 10 | 25.5 | 36 | 36 | 36 | |
您最近一年使用:0次
名校
解题方法
8 . 处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理大气污染物 所发生的反应为
所发生的反应为
 。几种物质的相对能量如下:
。几种物质的相对能量如下:
①
___________  。改变下列“量”,不会引起
。改变下列“量”,不会引起 发生变化的是
发生变化的是___________ (填代号)。
A.温度 B.催化剂 C.化学计量数
②有人提出上述反应可以用“ ”作催化剂,其总反应分两步进行。
”作催化剂,其总反应分两步进行。
第一步: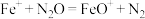 ,
,
第二步:___________ (写化学方程式)。
第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率___________ (填“大于”“小于”或“等于”)第一步反应速率。
(2)在实验室,采用 测定空气中CO的含量。在密闭容器中加入足量的
测定空气中CO的含量。在密闭容器中加入足量的 粉末和一定的CO,发生反应
粉末和一定的CO,发生反应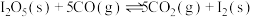 ,测得CO的转化率如图所示。
,测得CO的转化率如图所示。
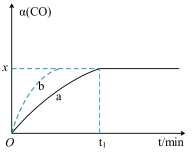
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是________________________ 。
②在此温度下,该可逆反应的平衡常数K=______ (用含x的代数式表示)。
(3)工业上用CO和 合成
合成 。在1L恒容密闭容器中充入1molCO(g)和
。在1L恒容密闭容器中充入1molCO(g)和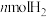 ,在250℃时发生反应
,在250℃时发生反应 ,测得混合气体中
,测得混合气体中 的体积分数与
的体积分数与 的物质的量的关系如图所示。在a、b、c、d点中,CO的平衡转化率最大的点是
的物质的量的关系如图所示。在a、b、c、d点中,CO的平衡转化率最大的点是______ 。
(4)有人提出利用 消除CO对环境的污染,你的评价是
消除CO对环境的污染,你的评价是______ (填“可行”或“不可行”)。
(1)CO用于处理大气污染物
 所发生的反应为
所发生的反应为
 。几种物质的相对能量如下:
。几种物质的相对能量如下:物质 |
|
|
|
|
相对能量/ | 475.5 | 283 | 0 | 393.5 |
①

 。改变下列“量”,不会引起
。改变下列“量”,不会引起 发生变化的是
发生变化的是A.温度 B.催化剂 C.化学计量数
②有人提出上述反应可以用“
 ”作催化剂,其总反应分两步进行。
”作催化剂,其总反应分两步进行。第一步:
 ,
,第二步:
第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率
(2)在实验室,采用
 测定空气中CO的含量。在密闭容器中加入足量的
测定空气中CO的含量。在密闭容器中加入足量的 粉末和一定的CO,发生反应
粉末和一定的CO,发生反应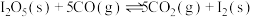 ,测得CO的转化率如图所示。
,测得CO的转化率如图所示。
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是
②在此温度下,该可逆反应的平衡常数K=
(3)工业上用CO和
 合成
合成 。在1L恒容密闭容器中充入1molCO(g)和
。在1L恒容密闭容器中充入1molCO(g)和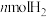 ,在250℃时发生反应
,在250℃时发生反应 ,测得混合气体中
,测得混合气体中 的体积分数与
的体积分数与 的物质的量的关系如图所示。在a、b、c、d点中,CO的平衡转化率最大的点是
的物质的量的关系如图所示。在a、b、c、d点中,CO的平衡转化率最大的点是
(4)有人提出利用
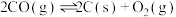 消除CO对环境的污染,你的评价是
消除CO对环境的污染,你的评价是
您最近一年使用:0次
名校
解题方法
9 . “绿水青山就是金山银山”,研究并消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
Ⅰ.已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ∙mol−1
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ∙mol−1
N2(g)+O2(g)=2NO(g) ΔH3=+181 kJ∙mol−1
(1)若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 _________ ,该反应自发进行的条件是_________ 。(填“高温”或“低温”或“任何温度”)
Ⅱ.为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中发生反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH1=-746.8 kJ∙mol−1
2CO2(g)+N2(g) ΔH1=-746.8 kJ∙mol−1
(2)T℃时,将体积比为1:1的CO和NO的混合气体充入刚性容器中发生上述反应,每隔一定时间测得容器内的压强如下表所示:
①反应开始10 min内,以CO的压强变化表示该反应的平均反应速率为_________ kPa/min,该反应的平衡常数Kp=_________ kPa-1 (用分数表示,Kp为用各气体分压表示的平衡常数。)
②反应达到平衡后,若再向容器中加入2 mol CO2(g)和1 mol N2,再次达到平衡时NO的百分含量将_________ (填“增大””减小”或”不变”)。
(3)实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________ (填“>”“<”或“ ” ) k逆增大的倍数。
” ) k逆增大的倍数。
②若在1 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
_________ 。
Ⅰ.已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ∙mol−1
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ∙mol−1
N2(g)+O2(g)=2NO(g) ΔH3=+181 kJ∙mol−1
(1)若某反应的平衡常数表达式为K=
 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 Ⅱ.为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中发生反应2NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH1=-746.8 kJ∙mol−1
2CO2(g)+N2(g) ΔH1=-746.8 kJ∙mol−1(2)T℃时,将体积比为1:1的CO和NO的混合气体充入刚性容器中发生上述反应,每隔一定时间测得容器内的压强如下表所示:
| 时间/min |  | 10 | 20 | 30 | 40 | 50 | 60 |
| kPa | 1.08 | 1.02 | 0.97 | 0.93 | 0.90 | 0.90 | 0.90 |
②反应达到平衡后,若再向容器中加入2 mol CO2(g)和1 mol N2,再次达到平衡时NO的百分含量将
(3)实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数
 ” ) k逆增大的倍数。
” ) k逆增大的倍数。②若在1 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则

您最近一年使用:0次
2022-11-22更新
|
211次组卷
|
2卷引用:四川省成都外国语学校2022-2023学年高二上学期期中考试化学试题
10 . 氮及其化合物在工农业生产中有着非常重要的地位。
I.已知①N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;②C(s)的燃烧热为△H=-393.5kJ/mol。
(1)反应C(s)+2NO(g)⇌N2(g)+CO2(g)的△H=___________ kJ/mol。
II.工业合成氨是人类科学技术的一项重大突破。其合成原理为:N2(g)+3H2(g)⇌2NH3(g) △H<0,△S<0。
(2)下列关于工业合成氨的说法正确的是___________(填标号)。
(3)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是____(填标号)。
(4)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:
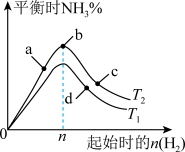
①图像中T2和T1的关系是:T1___________ T2(填“>、<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________ 。
(5)恒温下,向一个4L的恒容密闭容器中充入1.8molN2和4.2molH2,反应过程中对NH3的浓度进行检测。20min后,反应达平衡NH3的浓度为0.3mol/L,用N2表示的平均反应速率为___________ mol/(L·min)。且此时,混合气体的总压强为p,则该反应的化学平衡常数Kp=___________ (用含p的最简式表示)。[对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]
I.已知①N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;②C(s)的燃烧热为△H=-393.5kJ/mol。
(1)反应C(s)+2NO(g)⇌N2(g)+CO2(g)的△H=
II.工业合成氨是人类科学技术的一项重大突破。其合成原理为:N2(g)+3H2(g)⇌2NH3(g) △H<0,△S<0。
(2)下列关于工业合成氨的说法正确的是___________(填标号)。
| A.因为△H<0,所以该反应一定能自发进行 |
| B.因为△S<0,所以该反应一定不能自发进行 |
| C.该反应在低温下能自发进行 |
| D.在高温下进行是为了提高反应物的转化率 |
| A.NH3百分含量保持不变 |
| B.容器内N2、H2、NH3的浓度之比为1:3:2 |
| C.混合气体的密度保持不变 |
| D.容器内压强保持不变 |

①图像中T2和T1的关系是:T1
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(5)恒温下,向一个4L的恒容密闭容器中充入1.8molN2和4.2molH2,反应过程中对NH3的浓度进行检测。20min后,反应达平衡NH3的浓度为0.3mol/L,用N2表示的平均反应速率为
您最近一年使用:0次







