1 . 某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
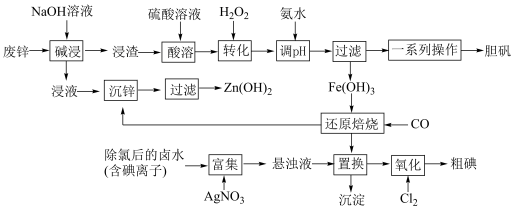
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: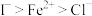
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为____________________ 。
(2)“转化”中,加入足量H2O2的目的是____________________ 。
(3)“调pH”时需控制该溶液的pH范围为______ 之间。“调pH”之后,需要加热煮沸10 min,冷却后再“过滤”。煮沸10 min的作用是____________________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为____________________ 。
(5)“氧化”过程中若反应物用量比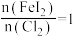 时,氧化产物为
时,氧化产物为______ (填化学式)
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
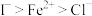
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量H2O2的目的是
(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“氧化”过程中若反应物用量比
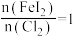 时,氧化产物为
时,氧化产物为
您最近一年使用:0次
名校
2 . 某含砷( )的有毒工业废水经如图流程转化为粗
)的有毒工业废水经如图流程转化为粗 ,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。

(1)砷是氮的同族元素,且比氮多2个电子层,则 在元素周期表中的位置为
在元素周期表中的位置为___________ ; 的电子式为
的电子式为___________ 。
(2)“碱浸”的目的是将废水中的 和
和 转化为盐。
转化为盐。 属于
属于___________ 电解质(填“强”或“弱”), 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
(3)“氧化”时,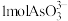 转化为
转化为 至少需要
至少需要
___________  。
。
(4)“沉砷”是将砷元素转化为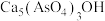 沉淀,发生的主要反应有
沉淀,发生的主要反应有
①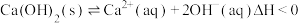
②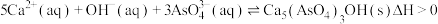
资料表明:“沉砷”的最佳温度是 ,温度高于
,温度高于 时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是
时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是___________ 。
(5)从绿色化学和综合利用的角度考虑,滤液2需要处理,可将滤液2返回___________ 环节循环使用。
 )的有毒工业废水经如图流程转化为粗
)的有毒工业废水经如图流程转化为粗 ,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
(1)砷是氮的同族元素,且比氮多2个电子层,则
 在元素周期表中的位置为
在元素周期表中的位置为 的电子式为
的电子式为(2)“碱浸”的目的是将废水中的
 和
和 转化为盐。
转化为盐。 属于
属于 转化为
转化为 的离子方程式为
的离子方程式为(3)“氧化”时,
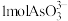 转化为
转化为 至少需要
至少需要
 。
。(4)“沉砷”是将砷元素转化为
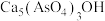 沉淀,发生的主要反应有
沉淀,发生的主要反应有①
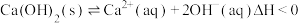
②
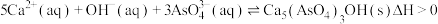
资料表明:“沉砷”的最佳温度是
 ,温度高于
,温度高于 时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是
时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是(5)从绿色化学和综合利用的角度考虑,滤液2需要处理,可将滤液2返回
您最近一年使用:0次
名校
解题方法
3 . 利用下列实验药品,能达到实验目的的是
| 选项 | 实验目的 | 实验药品 |
| A | 证明 具有氧化性 具有氧化性 |  溶液、KSCN溶液 溶液、KSCN溶液 |
| B | 证明CuS比FeS更难溶 |  溶液、 溶液、 溶液、铜粉 溶液、铜粉 |
| C | 证明氧化性 | KBr溶液、KI溶液、新制氯水、溴水、水 |
| D | 使试管中溶液变红 | 向盛 溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 下列变化中属于吸热反应的是
| A.氢气与氧气点燃形成水 | B.灼热的炭与二氧化碳生成一氧化碳 |
| C.冰融化 | D.NH4NO3(s) NH NH (aq)+NO (aq)+NO (aq) (aq) |
您最近一年使用:0次
名校
解题方法
5 . 已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 |
| C.25℃时,Mg(OH)2固体在20mL0.01mol/L氨水中的Ksp比在20mL0.01mol/LNH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2 |
您最近一年使用:0次
解题方法
6 . 科研小组用氧化—沉淀法从废电池浸出液中去除铁:用MnO2氧化废电池浸出液中的Fe2+,再加适量Na2CO3调pH使Fe3+转化为Fe(OH)3沉淀的同时并产生气体。研究发现pH对Fe2+的氧化率和铁去除率的影响如图1和图2所示。
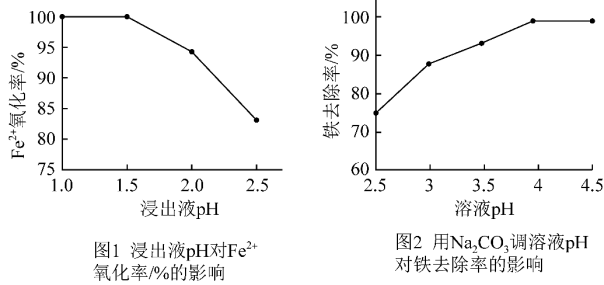
已知:i. pH越大,c(H+)越小;ii.酸性条件下MnO2被还原为Mn2+。下列说法不合理的是

已知:i. pH越大,c(H+)越小;ii.酸性条件下MnO2被还原为Mn2+。下列说法不合理的是
| A.由图1可知,Fe2+氧化率随浸出液c(H+)增大而增大 |
B.Fe2+氧化率达95%以上时反应的离子方程式为: |
C.Fe3+转变为沉淀的离子方程式为: |
| D.推测若用氨水调溶液pH也可以使Fe3+转化为Fe(OH)3沉淀 |
您最近一年使用:0次
名校
解题方法
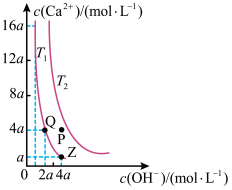
7 . 如图是 在温度分别为置T时的沉淀溶解平衡曲线[温度为
在温度分别为置T时的沉淀溶解平衡曲线[温度为 时
时 的
的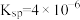 ,
,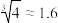 ]。下列说法正确的是
]。下列说法正确的是
 在温度分别为置T时的沉淀溶解平衡曲线[温度为
在温度分别为置T时的沉淀溶解平衡曲线[温度为 时
时 的
的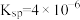 ,
,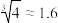 ]。下列说法正确的是
]。下列说法正确的是
A. |
B.温度为 时,P点分散系中分散质粒子直径均小于1nm 时,P点分散系中分散质粒子直径均小于1nm |
C.Q点对应的溶液中 约为 约为 |
| D.加水稀释时溶液碱性减弱,Z点对应的溶液可转化为Q点对应的溶液 |
您最近一年使用:0次
2020-10-05更新
|
372次组卷
|
5卷引用:湖南省衡阳市十校2016-2017学年高一高考调研冲刺预测卷(五)理综化学试题
湖南省衡阳市十校2016-2017学年高一高考调研冲刺预测卷(五)理综化学试题辽宁省大连市庄河市高级中学2019-2020学年高二下学期5月网上月考化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 作业帮辽宁省部分高中2021-2022学年高三上学期期中评测化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
解题方法
8 . 卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+、Mn2+等离子。以它为原料制取轻质氧化镁的工艺流程如图:

已知在此温度下,相关金属离子形成氢氧化物沉淀的pH如表:
请回答下列问题:
(1)溶液Ⅰ中加H2O2反应的离子方程式为_____ 。
(2)步骤Ⅰ是在溶液Ⅱ中加入NaOH溶液调节其pH=9.8,其目的是________ 。
(3)沉淀物Ⅰ的主要成分是_____ (填对应的化学式)。
(4)沉淀物Ⅱ加热煮沸的化学方程式为_______ 。

已知在此温度下,相关金属离子形成氢氧化物沉淀的pH如表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.9 | 11.1 |
请回答下列问题:
(1)溶液Ⅰ中加H2O2反应的离子方程式为
(2)步骤Ⅰ是在溶液Ⅱ中加入NaOH溶液调节其pH=9.8,其目的是
(3)沉淀物Ⅰ的主要成分是
(4)沉淀物Ⅱ加热煮沸的化学方程式为
您最近一年使用:0次
真题
名校
9 . 下列操作不能达到目的的是
| 选项 | 目的 | 操作 |
| A. | 配制100 mL 1.0 mol/L CuSO4溶液 | 将25 g CuSO4·5H2O溶于100 mL蒸馏水中 |
| B. | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C. | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D. | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
2387次组卷
|
17卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题山东省滕州市第一中学2015-2016学年高一4月竞赛化学试题陕西省西安市长安区第一中学2017-2018学年高一上学期期中考试化学试题广东省珠海市第二中学2019-2020学年高一上学期期中考试化学试题湖南省邵东县第三中学2021-2022学年高二上学期第三次月考化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(大纲卷)(已下线)2014届高考化学二轮专题复习 化学实验常用仪器和基本操作练习卷(已下线)2014年高考化学指导冲关 第12练物质制备方案的设计与评价练习卷(已下线)2014高考名师推荐化学实验药品保存、基本操作、检验(已下线)2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷2014-2015学年河北省正定中学高二下第三次月考化学试卷2016届内蒙古巴彦淖尔市第一中学高三上期中考试理化学试卷辽宁省大连市第四十八中学2019届高三年级5月模拟考试化学试题会做实验2020届高三化学实验复习——过滤、蒸馏、冷凝、结晶、洗气的再练习 【选择突破】重庆南开中学高2020届高三化学网络复习化学实验常用仪器和基本操作考点过关测试辽宁省锦州市渤海大学附属中学、育明高级中学2021届高三上学期第二次月考化学试题吉林省松原市前郭蒙中2020-2021学年高二下学期期末考试化学试题
名校
10 . 三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
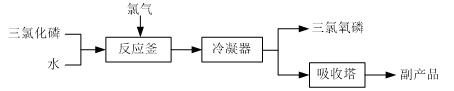
⑴氯化水解法生产三氯氧磷的化学方程式为______ 。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是______ (选填字母),滴定终点的现象为______ 。
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉
②实验过程中加入硝基苯的目的是_____________________ ,如无此操作所测Cl元素含量将会______ (填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是_________________ 。
②下图是不同条件对磷的沉淀回收率的影响图象。
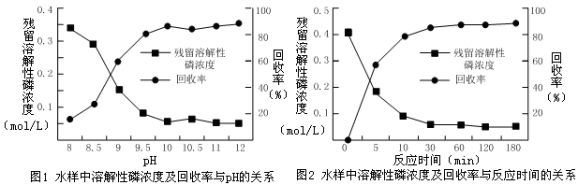
处理该厂废水最合适的工艺条件为______ (选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)=__________ mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)

⑴氯化水解法生产三氯氧磷的化学方程式为
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉
②实验过程中加入硝基苯的目的是
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是
②下图是不同条件对磷的沉淀回收率的影响图象。

处理该厂废水最合适的工艺条件为
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)=
(已知Ksp[Ca3(PO4)2]=2×10-29)
您最近一年使用:0次






