名校
解题方法
1 . 常温下,向一定浓度邻苯二甲酸钠( 表示)溶液中通入
表示)溶液中通入 气体,保持溶液体积和温度不变,测得
气体,保持溶液体积和温度不变,测得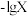 与
与 [X为
[X为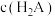 、
、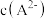 、
、 ;
;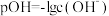 ]的变化关系如图所示,下列说法错误的是
]的变化关系如图所示,下列说法错误的是
 表示)溶液中通入
表示)溶液中通入 气体,保持溶液体积和温度不变,测得
气体,保持溶液体积和温度不变,测得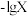 与
与 [X为
[X为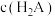 、
、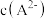 、
、 ;
;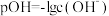 ]的变化关系如图所示,下列说法错误的是
]的变化关系如图所示,下列说法错误的是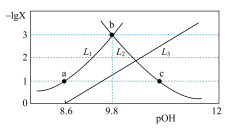
A.曲线 表示— 表示—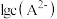 |
B.c点溶液中: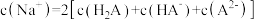 |
C.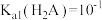 |
D.水的电离程度: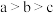 |
您最近一年使用:0次
2024-02-17更新
|
597次组卷
|
2卷引用:2024届四川省绵阳市东辰中学高三下学期模拟考试(一)理科综合试题-高中化学
名校
2 . 下列说法正确的是
| A.常温下,pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
B.常温下,水电离出的c(H+)=10-13mol/L的溶液可能与含Fe3+、NH 的溶液不共存 的溶液不共存 |
C.加入铝粉能产生H2的溶液中,可能存在大量的 Na+、Ba2+、Fe2+、AlO 、NO 、NO |
| D.pH=4的醋酸溶液,稀释至10倍后pH=5 |
您最近一年使用:0次
名校
解题方法
3 . 用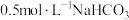 溶液滴定
溶液滴定 溶液,加入的碳酸氢钠溶液体积与溶液pH变化曲线如图所示,其中
溶液,加入的碳酸氢钠溶液体积与溶液pH变化曲线如图所示,其中 时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的
时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的 溶液体积为25.00mL时,溶液的pH稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述错误的是
溶液体积为25.00mL时,溶液的pH稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述错误的是

已知: ,
, 。
。
A.a点的混合溶液, |
| B.a→b的过程中,水的电离程度不断增大 |
C.总反应的化学方程式: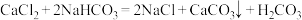 |
D.b点的混合溶液,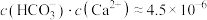 |
您最近一年使用:0次
2023-02-17更新
|
1382次组卷
|
8卷引用:四川省绵阳中学2023届高三三诊模拟考试理综-化学试题
四川省绵阳中学2023届高三三诊模拟考试理综-化学试题湖南省浏阳市第一中学2023届高三第六次月考化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)辽宁省部分学校2022-2023学年高三下学期三模化学试题 (已下线)2023年北京卷高考真题变式题(选择题11-14)辽宁省辽东南协作校2023届高三下学期第三次模拟考试化学试题河南省信阳高级中学2023-2024学年高三上学期11月一模考试化学试题新疆乌鲁木齐市2024届高三第一次质量监测化学试题
名校
4 . 已知:pOH=-lg c(OH-),298K时,向20.00mL0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
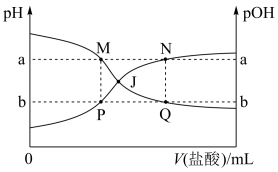

| A.曲线PJN表示溶液中pH的变化 |
| B.M点水的电离程度比N点大 |
| C.M、P两点的数值之和a+b=14 |
| D.pH与pOH交叉点J对应的V(盐酸)=20.00mL |
您最近一年使用:0次
2021-12-05更新
|
584次组卷
|
2卷引用:四川省绵阳东辰国际学校2021-2022学年高二上学期第二次月考化学试题
5 . 水是极弱的电解质,其中存在电离平衡H2O⇌H++OH-,回答下列问题:
(1)常温下,某电解质溶解在水中后,溶液中水电离的c(H+)=1×10-9,则该电解质可能是_______ (填序号)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)常温时,取0.1mol·L-1 HX溶液与0.1mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH=8。
①混合溶液中由水电离出的c(OH-)与0.1mol/LNaOH溶液中由水电离出的c(OH-)之比为_______ 。
②已知NH4X溶液呈中性,将HX溶液加入到Na2CO3溶液中有气体放出。试推断NH4HCO3溶液的pH_______ 7(填“>”“<”或“=”)。
(3)T℃时,测得0.01mol·L-1 NaOH溶液的pH=10,则此温度下水的Kw=_______ 。在此温度下,将0.01mol·L-1 H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va∶Vb=_______ (忽略溶液混合时体积的变化)。
(1)常温下,某电解质溶解在水中后,溶液中水电离的c(H+)=1×10-9,则该电解质可能是
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)常温时,取0.1mol·L-1 HX溶液与0.1mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH=8。
①混合溶液中由水电离出的c(OH-)与0.1mol/LNaOH溶液中由水电离出的c(OH-)之比为
②已知NH4X溶液呈中性,将HX溶液加入到Na2CO3溶液中有气体放出。试推断NH4HCO3溶液的pH
(3)T℃时,测得0.01mol·L-1 NaOH溶液的pH=10,则此温度下水的Kw=
您最近一年使用:0次
解题方法
6 . 298 K时,向20 mL 0.1 mol/L某酸HA溶液中逐滴加入0.1 mol/L NaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是
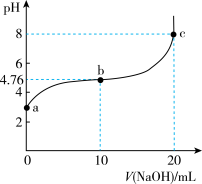

| A.a点溶液的pH为2.88 |
| B.b点溶液中:c(Na+)>c(A-)>c(HA) |
| C.b、c之间一定存在c(Na+)=c(A-)的点 |
| D.a、b、c三点中,c点水的电离程度最大 |
您最近一年使用:0次
名校
7 . 若用AG表示溶液的酸度,其表达式为:AG=lg[ ]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:
]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示: 下列说法正确的是( )
下列说法正确的是( )
 ]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:
]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示: 下列说法正确的是( )
下列说法正确的是( )| A.该滴定过程可选择酚酞作为指示剂 |
| B.C点加入盐酸的体积为10mL |
| C.若B点加入的盐酸溶液体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH−) |
| D.滴定过程中从A点到D点溶液中水的电离程度逐渐增大 |
您最近一年使用:0次
2018-01-24更新
|
503次组卷
|
3卷引用:四川省江油中学2019届高三下学期第一次月考理科综合化学试题
8 . T℃时,NaCl溶液中c(H+)=1×10-6mol/L 。下列说法正确的是
| A.该NaCl溶液显酸性 | B.该NaCl溶液中KW=1×10-12 |
| C.该NaCl溶液中c(OH-)> c(H+) | D.该NaCl溶液pH=7 |
您最近一年使用:0次
2017-11-05更新
|
532次组卷
|
6卷引用:四川省江油市太白中学2023-2024学年高二下学期开学考试化学试题
四川省江油市太白中学2023-2024学年高二下学期开学考试化学试题吉黑两省九校2017-2018学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——与pH相关的计算综合(强化练习)(已下线)3.2.1 水的电离 溶液的酸碱性与pH 练习-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)四川省成都新津为明学校2020-2021学年高二上学期第三次月考化学试题甘肃省白银市白银区大成学校2022-2023学年高二下学期开学考试(上期末)化学试题



