2023·安徽·一模
解题方法
1 . 用 溶液滴定
溶液滴定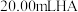 溶液过程中的
溶液过程中的 变化如图所示:
变化如图所示:

下列叙述错误的是
 溶液滴定
溶液滴定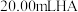 溶液过程中的
溶液过程中的 变化如图所示:
变化如图所示:
下列叙述错误的是
A. 为一元弱酸 为一元弱酸 |
B.初始 溶液中的电离度 溶液中的电离度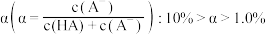 |
C.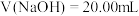 时,混合溶液中有 时,混合溶液中有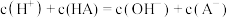 |
D.若使用酚酞作指示剂,会产生系统误差,测得 溶液浓度会偏大 溶液浓度会偏大 |
您最近一年使用:0次
2023-02-24更新
|
1925次组卷
|
7卷引用:2023四省联考化学学科试卷分析
(已下线)2023四省联考化学学科试卷分析安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试理科综合化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(选择题11-13)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(选择题11-13)(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)江西省南昌市2023届高三下学期第三次模拟测试理综化学试题
名校
2 . 室温下,向20.00mL0.1000mol•L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与pH随加如稀硫酸体积的变化如图所示。下列说法正确的是
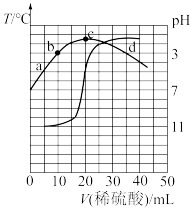

| A.稀硫酸的浓度为0.1000mol•L-1 |
| B.室温下MOH的电离平衡常数Kb=1.0×10-6 |
| C.b点对应的溶液中:2c(OH-)+c(MOH)=c(M+)+2c(H+) |
D.当pH=7时,溶液中存在c(H+)=c(OH-)<c(M+)<c(SO ) ) |
您最近一年使用:0次
2021-12-16更新
|
573次组卷
|
4卷引用:云南省师范大学附属中学2021-2022学年上学期高三高考适应性月考卷(五)理科综合化学试题
解题方法
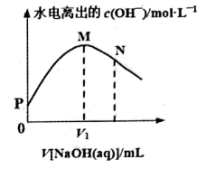
3 . 室温下,用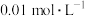 的
的 溶液滴定
溶液滴定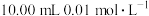 的
的 溶液,水电离出的
溶液,水电离出的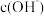 随
随 溶液体积的变化曲线如图所示。下列说法正确的是
溶液体积的变化曲线如图所示。下列说法正确的是
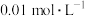 的
的 溶液滴定
溶液滴定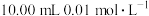 的
的 溶液,水电离出的
溶液,水电离出的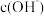 随
随 溶液体积的变化曲线如图所示。下列说法正确的是
溶液体积的变化曲线如图所示。下列说法正确的是
A.P、M、N三点,M点 最大 最大 |
B.M点溶液显中性, |
| C.该滴定过程选择甲基橙作为指示剂 |
D.N点溶液中 |
您最近一年使用:0次
2021-08-22更新
|
321次组卷
|
4卷引用:云南省大理州实验中学2022-2023学年高三上学期化学开学考试
名校
4 . 25℃时,用0.1mol·L−1NaOH溶液滴定20mL0.1mol·L−1HX溶液,溶液的pH随加入的NaOH溶液体积的变化如图所示。下列说法错误的是
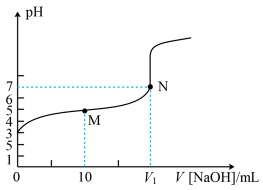

| A.HX的Ka约为1×10−5 |
| B.V1 < 20 |
| C.M点溶液中c(HX)+c(H+)= c(OH-)+c(X−) |
| D.V(NaOH)=20mL时,溶液中c(Na+)>c(X−)>c(OH−)>c(H+) |
您最近一年使用:0次
2021-07-14更新
|
379次组卷
|
2卷引用:云南省云天化中学2022届高三摸底测试化学试题
名校
解题方法
5 . 常温下,将0.1 mol/L的NaOH溶液逐滴滴入20 mL0.1 mol/L的CH3COOH溶液中,所得溶液pH变化如图所示,下列有关说法正确的是( )
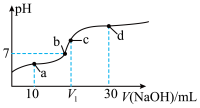

| A.a点:c(CH3COOH)>c(CH3COO-) |
| B.b点为滴定终点 |
| C.若V1=20,则c点处水的电离程度最大 |
| D.d点:c(CH3COO-)+2c(CH3COOH)=2c(OH-)-2c(H+) |
您最近一年使用:0次
2020-03-20更新
|
308次组卷
|
3卷引用:云南省大理州祥云四中2020届高三下学期3月线上模拟考试理综化学试题
名校
6 . 某研究小组将V1mL 1.0 mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度________ (填“高于”、“低于”或“等于”)22℃,判断的依据是_______ 。
(2)由题干及图形可知:V1∶V2=________ 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为______ mol·L-1。
(3)实验时将酸碱在简易量热计中混合,并用_______ 搅拌,使溶液混合均匀。经计算此反应共放出Q kJ的热量,请写出表示中和热的热化学方程式:________ 。
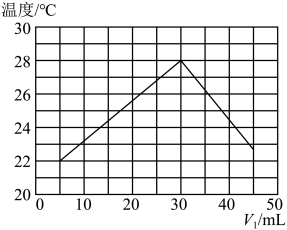
(1)研究小组做该实验时环境温度
(2)由题干及图形可知:V1∶V2=
(3)实验时将酸碱在简易量热计中混合,并用

您最近一年使用:0次
2019-11-27更新
|
165次组卷
|
4卷引用:云南省曲靖市会泽县茚旺高级中学2020届高三上学期11月月考化学试题
云南省曲靖市会泽县茚旺高级中学2020届高三上学期11月月考化学试题湖南省永州市宁远县第一中学2019-2020学年高二上学期期中考试化学试题河南省鹤壁市高级中学2018-2019学年高一下学期第一次段考化学试题(已下线)1.1.2 反应热的测量和计算(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)
7 . 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol−1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×10−10,Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________ 中溶解,完全溶解后,全部转移至100 mL的_________ 中,加蒸馏水至____________ 。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O +6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O
+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O =S4O
=S4O +2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液
+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液__________ ,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________ %(保留1位小数)。
(1)已知:Ksp(BaSO4)=1.1×10−10,Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
| 实验步骤 | 现象 |
| ①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
| ③ | ④ |
| ⑤静置, | ⑥ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O
 +6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O
+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O =S4O
=S4O +2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液
+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液
您最近一年使用:0次
2018-06-09更新
|
10547次组卷
|
16卷引用:云南省玉溪市元江一中2019届高三第一次月考化学试题
云南省玉溪市元江一中2019届高三第一次月考化学试题2018年全国普通高等学校招生统一考试化学(新课标III卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题安徽省淮北地区2019届高三上学期入学摸底考试化学试题陕西省宝鸡中学2019届高三入学调研考化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第3讲 硫及其化合物 (教学案)【市级联考】广东省化州市2019年高三上学期第二次模拟考试理科综合化学试题(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)广东省深圳市第七高级中学2022届高三上学期9月月考化学试题(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)【全国百强校】广西河池市高级中学2018-2019学年高二下学期第一次月考理综-化学试题西藏拉萨中学2019-2020学年高二上学期第三次月考理综化学试题四川省雅安中学2020-2021学年高二下学期期中考试理综化学试题广西容县高级中学2021-2022学年高二下学期开学考试理科综合化学试题 鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应
名校
8 . 表1是元素周期表的一部分:

25℃时,用浓度为0.1000 mol•L-1的氢氧化钠溶液分别滴定20.00mL浓度均为0.1000 mol•L-1 的两种酸HX、HZ(忽略体积变化),实验数据如表2,下列判断正确的是

25℃时,用浓度为0.1000 mol•L-1的氢氧化钠溶液分别滴定20.00mL浓度均为0.1000 mol•L-1 的两种酸HX、HZ(忽略体积变化),实验数据如表2,下列判断正确的是
| A.通过分析可得表格中a <7,b=7 |
| B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大 |
| C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强 |
| D.0.1000 mol•L-1 Na2Y的水溶液中:c(Y2-) + c(HY-) + c(H2Y) = 0.1000 mol•L-1 |
您最近一年使用:0次
名校
9 . 化学上常用AG表示溶液的lg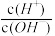 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是

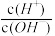 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
| A.C点时,加入NaOH溶液的体积不为20mL |
| B.D点溶液的pH=11.25 |
| C.B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2) |
| D.25℃时,HNO2的电离常数Ka=1.0×10-5.5 |
您最近一年使用:0次
2018-01-16更新
|
473次组卷
|
2卷引用:云南省师范大学附属中学2018届高三高考适应性月考卷(六)理综化学试题
名校
10 . 下列说法正确的是
| A.0.1 mol·L-1pH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-) |
B.如下图表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1 NaOH溶液时,溶液的pH随加入酸体积的变化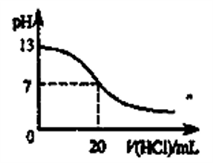 |
| C.在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-) |
D.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy |
您最近一年使用:0次
2017-10-28更新
|
956次组卷
|
7卷引用:云南省峨山彝族自治县第一中学2018届高三第四次模拟考试化学试题



