1 . 醋酸的电离方程式为CH3COOH(aq)⇌H+(aq)+CH3COO-(aq) ΔH>0,25℃时,0.1mol/L醋酸溶液Ka=1.75×10-5(Ka表示酸的电离常数)。下列说法正确的是
| A.升高温度,c(H+)增大,Ka变大 |
| B.该溶液中加少量CH3COONa固体,平衡正向移动 |
| C.该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 |
| D.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 |
您最近一年使用:0次
2020-06-01更新
|
116次组卷
|
3卷引用:广西壮族自治区田阳高中2019-2020学年高二5月月考化学试题
广西壮族自治区田阳高中2019-2020学年高二5月月考化学试题(已下线)3.1+弱电解质的电离-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河北省张家口市第一中学2020-2021学年高二上学期10月月考(衔接班)化学 试题
名校
2 . 室温下,用0.100mol·L−1的NaOH溶液分别滴定均为20.00mL0.100mol·L−1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
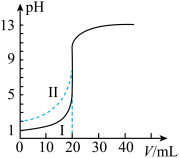

| A.Ⅰ表示的是滴定醋酸的曲线 |
| B.pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL |
| C.V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-) |
| D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
您最近一年使用:0次
2020-03-12更新
|
1497次组卷
|
12卷引用:广西自治区来宾市2020年4月份高三教学质量诊断理科综合化学试题
广西自治区来宾市2020年4月份高三教学质量诊断理科综合化学试题海南省海口市海南中学2020届高三下学期第七次月考化学试题海南省海南中学2020届高三下学期第七次月考化学试题江西省萍乡市麻山中学2020届高三下学期5月第二次教学质量检测理科综合化学试题广东省云浮市2019-2020学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测甘肃省白银市会宁县第四中学2021届高三上学期第四次月考化学试题(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅰ卷)安徽省蚌埠四校2021-2022学年高三下学期三模化学试题重庆市巫山县官渡中学2021-2022学年高二下学期第二次月考化学试题云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题
名校
3 . 常温下,在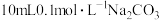 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示
溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示 因逸出未画出,忽略因气体逸出引起的溶液体积变化
因逸出未画出,忽略因气体逸出引起的溶液体积变化 ,下列说法正确的是
,下列说法正确的是


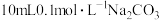 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示
溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示 因逸出未画出,忽略因气体逸出引起的溶液体积变化
因逸出未画出,忽略因气体逸出引起的溶液体积变化 ,下列说法正确的是
,下列说法正确的是


A.在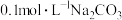 溶液中: 溶液中: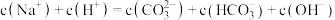 |
B.当溶液的pH为7时,溶液的总体积为 |
C.在B点所示的溶液中,离子浓度最大的是 |
D.在A点所示的溶液中: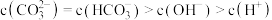 |
您最近一年使用:0次
2020-02-06更新
|
725次组卷
|
7卷引用:广西南宁市第二中学2019~2020学年高二上学期期中考试化学(理科)试题
名校
4 . 甲酸的下列性质中,可以证明它是弱电解质的是
| A..0.1mol/L 甲酸溶液的 c(H+) = 10−3mol/L |
| B.甲酸以任意比与水互溶 |
| C.10mL1mol/L 甲酸恰好与 10mL1mol/LNaOH 溶液完全反应 |
| D.甲酸溶液的导电性比一元强酸溶液的弱 |
您最近一年使用:0次
2020-01-17更新
|
248次组卷
|
10卷引用:广西桂林市中山中学2018-2019学年高二下学期期中考试化学试题
广西桂林市中山中学2018-2019学年高二下学期期中考试化学试题2016-2017学年江西省宜春市奉新一中高二上月考二化学卷内蒙古赤峰市宁城县2017-2018学年高二上学期期末考试化学试题内蒙古自治区巴彦淖尔市临河三中2018-2019学年高二上学期期中考试化学试题江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题湖北省恩施州清江外国语学校2019-2020学年高二上学期期末考试化学试题福建省南安市侨光中学2019-2020学年高二上学期第二次阶段考试化学试题新疆乌鲁木齐市第四中学2020-2021学年高二上学期期末考试化学试题选择性必修1 专题3 第一单元 弱电解质的电离平衡3.1.1强电解质和弱电解质 弱电解质的电离平衡 课后
名校
5 . 我国科学家提出了由CO2和CH4直接转化为CH3COOH的催化反应进程,该进程如图所示。下列说法错误的是
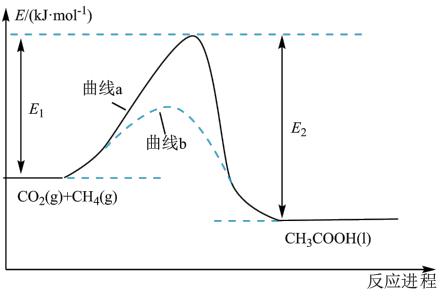

| A.该反应是放热反应 | B.曲线a的活化能大于曲线b |
| C.上述化学工艺符合绿色化学要求 | D.醋酸溶液中存在1个电离平衡 |
您最近一年使用:0次
2019-12-16更新
|
218次组卷
|
3卷引用:广西壮族自治区桂林市逸仙中学2019-2020学年高二上学期期中考试(二)化学试题
名校
6 . 已知25℃时,K=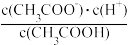 =1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )
=1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )
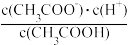 =1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )
=1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )| A.向该溶液中加入一定量的硫酸,K增大 |
| B.升高温度,K增大 |
| C.向CH3COOH溶液中加入少量水,K增大 |
| D.向CH3COOH溶液中加入少量氢氧化钠溶液,K增大 |
您最近一年使用:0次
2019-11-01更新
|
785次组卷
|
14卷引用:广西南宁市2020-2021学年高二上学期期末考试(原理)化学试题
广西南宁市2020-2021学年高二上学期期末考试(原理)化学试题广西梧州市藤县第六中学2021-2022学年高二上学期期中考试化学试题(已下线)2019年10月4日《每日一题》选修4—— 电离常数的理解河北省承德第一中学2020届高三10月月考化学试题福建省永安市第三中学2019-2020学年高二上学期期中考试化学试题宁夏贺兰县景博中学2019-2020学年高二上学期期中考试化学试题(已下线)3.1+弱电解质的电离-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)内蒙古通辽市开鲁县第一中学2020-2021学年高二上学期第一次月考化学试题(已下线)3.1 弱电解质的电离(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第3章 水溶液中的离子平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)黑龙江省牡丹江市第三中学2021-2022学年高二上学期期中考试化学(理)试题(已下线)3.1.2 电离平衡常数(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河南省宋基信阳实验中学2021-2022学年高三上学期12月月考化学试题黑龙江省牡丹江穆棱市第二中学2021-2022学年高二上学期期末考试化学试题
名校
7 . 已知25 ℃时,醋酸溶液中存在下述关系:Ka=c(H+)c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中Ka的数值是该温度下醋酸的电离平衡常数。有关Ka的下列说法正确的是( )
| A.当向该溶液中加入一定量的硫酸时,Ka的值增大 |
| B.升高温度,Ka的值增大 |
| C.向醋酸溶液中加水,Ka的值增大 |
| D.向醋酸溶液中加氢氧化钠溶液,Ka的值增大 |
您最近一年使用:0次
2019-10-19更新
|
569次组卷
|
11卷引用:广西贺州市平桂管理区公会中学2021-2022学年上学期高二第二次月考化学(理)试题
广西贺州市平桂管理区公会中学2021-2022学年上学期高二第二次月考化学(理)试题云南省大理市下关一中2018-2019学年高二上学期期中考试化学试题广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时1 弱电解质的电离平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第一节 电离平衡贵州省毕节市赫章县2021-2022学年高二上学期期末考试化学试题贵州省铜仁市贵州铜仁伟才学校2021-2022学年高二上学期期中考试化学试题云南省蒙自市第一高级中学2022-2023学年高二下学期3月月考化学试题吉林省长春市第二实验中学2023-2024学年高二上学期期中考试化学试题广东省清远市名校2023-2024学年高二上学期期中调研联考化学试题内蒙古自治区第二地质中学2023-2024学年高二上学期12月期中考试化学试题
名校
8 . 向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,原理如下:
Cu(s)+Cu2+(aq) 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl-(aq)+Cu+(aq) CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。

下列说法正确的是
Cu(s)+Cu2+(aq)
 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1Cl-(aq)+Cu+(aq)
 CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。

下列说法正确的是
| A.溶液pH越大,Ksp(CuCl)增大 |
| B.反应达到平衡时增大c(Cu2+),c(Cl-)减小 |
| C.向电解液中加入稀硫酸,有利于Cl-的去除 |
D. Cu(s)+ Cu(s)+ Cu2+(aq)+Cl-(aq) Cu2+(aq)+Cl-(aq) CuCl(s) ΔH=(a+2b) kJ·mol-1 CuCl(s) ΔH=(a+2b) kJ·mol-1 |
您最近一年使用:0次
2019-09-04更新
|
996次组卷
|
16卷引用:【全国百强校】广西壮族自治区南宁市第三中学2018-2019学年高二下学期期中考试化学试题
【全国百强校】广西壮族自治区南宁市第三中学2018-2019学年高二下学期期中考试化学试题【全国市级联考】江苏省南通市2018年高三第三次调研测试化学试题(已下线)《考前20天终极攻略》6月4日 专项四 化学坐标曲线图分析2018届南通泰州扬州等七市高三化学三模试卷(已下线)2018届高三高考题及模拟题汇编 专题10 水溶液中的离子平衡【全国百强校】江苏省徐州市第一中学2019届高三上学期第一次月考化学试题【全国百强校】湖南省衡阳市第八中学2018-2019学年高二上学期六科联赛试题(12月)化学试题湖南省衡阳市第八中学2020届高三模拟检测理科综合化学试题广东省中山一中、仲元中学等七校联合体2020届高三第一次联考(8月)理综化学试题重庆市2019-2020学年高三下学期网络考试化学试题江西省南昌市四校联盟2020届高三第二次联考理综化学试题(已下线)本册综合检测(一)——2020-2021学年高二化学选修四同步单元AB卷(人教版)吉林省长春市东北师范大学附中2020-2021学年高二上学期期末考试化学试题河北省秦皇岛市抚宁区第一中学2021届高三1月月考理综化学试题天津市耀华中学2021届高三年级第一次模拟考试化学试题2019-2020广东省广州市广州中学高三10月考试化学试卷
9 . 设NA为阿伏加 德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是
| A.每升溶液中的H+数目为0.02NA |
B.c(H+)= c(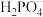 )+2c( )+2c( )+3c( )+3c( )+ c(OH−) )+ c(OH−) |
| C.加水稀释使电离度增大,溶液pH减小 |
| D.加入NaH2PO4固体,溶液酸性增强 |
您最近一年使用:0次
2019-06-09更新
|
13814次组卷
|
68卷引用:广西桂林市第十八中学2021届高三上学期第二次月考理科综合化学试题
广西桂林市第十八中学2021届高三上学期第二次月考理科综合化学试题2019年全国统一高考化学试题(新课标Ⅲ)(已下线)专题02 化学计量与化学计算——2019年高考真题和模拟题化学分项汇编(已下线)专题10 水溶液中的离子平衡——2019年高考真题和模拟题化学分项汇编湖南省娄底市娄星区2019-2020学年高二上学期期中考试化学试题贵州省遵义市南白中学2019-2020学年高二上学期期中考试化学试题(已下线)专题8.1 弱电解质的电离平衡(练)-《2020年高考一轮复习讲练测》(已下线)专题8.1 弱电解质的电离平衡(讲)-《2020年高考一轮复习讲练测》2020届高考化学小题狂练(全国通用版)专练16 盐类的水解(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)专题三 化学常用计量与阿伏加德罗常数(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题河北省冀州中学2020届高三11月月考化学试题(已下线)小题必刷11 物质的量浓度与溶液的配制——2021年高考化学一轮复习小题必刷(通用版)鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第2节 弱电解质的电离盐类的水解(已下线)3.1+弱电解质的电离-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第一节 电离平衡 高考帮黑龙江省伊春市伊美区第二中学2021届高三上学期开学考试化学试题北京二中2020-2021学年高二上学期10月月考化学试题安徽涡阳县育萃中学2020-2021学年高二上学期第二次月考化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关第25讲 弱电解质的电离平衡(精讲)-2021年高考化学一轮复习讲练测(已下线)3.2.1 水的电离和溶液的酸碱性(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)四川省邻水实验学校2020-2021学年高二上学期第三阶段考试化学试题吉林省四平市实验中学2020-2021学年高二12月月考化学试题天津市第三中学2021届高三下学期2月月考化学试题(已下线)专题02 化学用语及常用物理量——备战2021年高考化学纠错笔记(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)河北省石家庄第二中学2020-2021学年高二上学期期中考试化学试题四川省雅安中学2020-2021学年高二下学期期中考试理综化学试题(已下线)课时13 阿伏加德罗常数运用-2022年高考化学一轮复习小题多维练(全国通用)选择性必修1(SJ)专题3专题培优专练(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(一) 阿伏加德罗常数的突破(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)广东省珠海市第二中学2020-2021学年高二上学期10月月考化学试题广东省深圳市第七高级中学2022届高三第一次月考化学试卷(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向24 弱电解质的电离平衡-备战2022年高考化学一轮复习考点微专题吉林省长春市第二实验中学2021-2022学年高二上学期期中考试化学试题山西省太原市第五中学2021-2022学年高二上学期12月月考化学试题(已下线)3.2.1 水的电离 溶液的酸碱性(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)专题02 NA及其应用—2022年高考化学二轮复习讲练测(全国版)-练习云南省峨山彝族自治县第一中学2021-2022学年高二上学期12月月考化学试题(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)查补易混易错点02 阿伏加德罗常数及应用-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题02化学计量与化学计算-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点02 物质的量 气体摩尔体积-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)内蒙古包头市第四中学2020-2021学年高二上学期期中考试化学试题湖北省武汉市青山区2021-2022学年高二上学期期末考试化学试题(已下线)第21讲 电离平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)广东省中山大学附属中学2022-2023学年高二上学期期中考试化学试题(已下线)第一部分 二轮专题突破 专题14 溶液中的三大平衡及应用湖北省罗田县第一中学2022-2023学年高二上学期12月月考化学试题浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题(已下线)T11-电解质溶液第1讲 弱电解质的电离平衡05-2023新东方高二上期中考化学湖南省岳阳市华容县2023-2024学年高二上学期期末考试化学试题辽宁省大连市第四十四中学2022-2023学年高三上学期10月考试化学试题广东省茂名市高州中学2023-2024学年高一下学期期中考试化学试题
10 . 常温下,HNO2的电离平衡常数为K=4.6×10-4(已知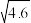 =2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
=2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
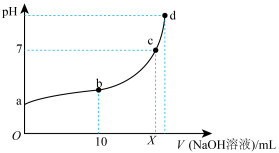
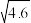 =2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
=2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
| A.X=20 |
| B.a点溶液中c(H+)=2.14×10-3 mol·L-1 |
| C.a、b、c、d四点对应的溶液中水的电离程度逐渐减小 |
D.b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>c(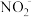 ) ) |
您最近一年使用:0次
2019-05-28更新
|
704次组卷
|
5卷引用:【市级联考】广西壮族自治区南宁市普通高中2019届高三毕业班第一次适应测试理综化学试题
【市级联考】广西壮族自治区南宁市普通高中2019届高三毕业班第一次适应测试理综化学试题【市级联考】湖南省湘潭市2019届高三下学期第二次模拟考试理科综合化学试题【市级联考】河南省新乡市2019届高三下学期第三次模拟测试理科综合化学试题(已下线)3.2.1+水的电离和溶液的酸碱性-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)吉林省(双辽市一中、长岭县一中、大安市一中、通榆县一中)2022届高三上学期摸底联考理综化学试题



